Como ya lo mencionamos, se define como el crecimiento excesivo del vello terminal facial y en el cuerpo, en el cuello y la parte baja del abdomen con un patrón de distribución masculino. Ocurre en el 70% de las mujeres con síndrome de ovario poliquístico/androgénico.
El pelo nace del folículo piloso, que es un órgano dinámico que tiene la capacidad de regenerarse; el ciclo del cabello se compone de eventos repetitivos rítmicos de crecimiento, regresión y remodelación tisular. En el hirsutismo hay prolongación de la fase de crecimiento del pelo (anágena) y se observa cuando el vello se convierte en pelo terminal. Figura 3.

El grado de hirsutismo puede estar influenciado por la actividad relativa de la enzima 5α- reductasa que convierte la testosterona en dihidrotestosterona (DHT), que es un metabolito activo. Existen diferencias étnicas y genéticas en la actividad de esta enzima, que puede modificar el grado de hirsutismo. Este puede estar acompañado de alopecia androgénica, con un patrón progresivo de pérdida de cabello debido al efecto en los folículos pilosos.3
Clasificación clínica del hirsutismo
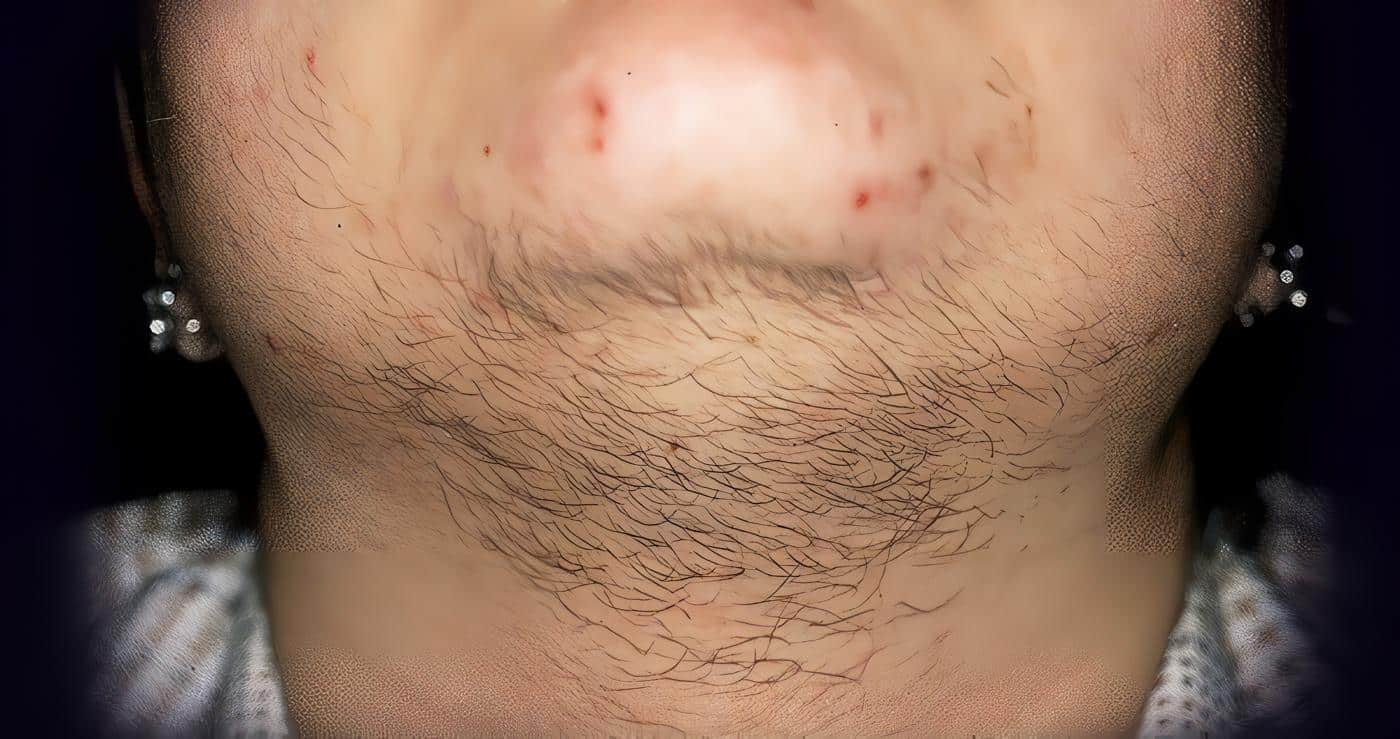
El estándar de oro para la evaluación del hirsutismo es la puntuación de Ferriman- Gallwey.4 Incluye puntuaciones de 9 de las 11 áreas del cuerpo: labio superior, mentón, pecho, parte superior y baja de la espalda, parte superior e inferior del abdomen, brazo, antebrazo, muslo y porción inferior de la pierna (figura 4).

Si el crecimiento de pelo terminal en el área examinada no está presente se da un puntaje de:
- Si es mínimo.
- Más que mínimo, pero no equivalente a un hombre adulto.
- Equivalente a un hombre adulto.
- Equivalente a hombres adultos sanos bien virilizados.
Puntuación Hirsutismo: Leve: 0-15, Moderado: 16-25, Grave: por encima de 25 (puntaje máximo de 36).
El examen de solo el mentón y el abdomen es un método de cribado simple y fiable para detectar el hirsutismo (Figura 5). Por otra parte, la reducción del número de zonas del cuerpo evaluadas puede aumentar la disposición de los participantes del estudio o pacientes a ser evaluados.
Al simplificar el método de evaluación y al reducir el número de zonas del cuerpo evaluadas, el potencial de error y la variabilidad entre observadores puede reducirse.

Causas de hiperandrogenismo
Se clasifican según el mecanismo fisiopatológico que lo origina, de la siguiente manera:5,6 • Aumento en la producción endógena (secreción directa por gónadas y/o suprarrenales: o conversión periférica).
- Alteración en el transporte (la disminución de la SHBG incrementa los niveles de la testosterona libre).
- Bloqueo de su transformación en estrógenos (carencia de aromatasas).
- Alteración en la respuesta final (aumento de la actividad enzimática de la 5-alfareductasa y/o aumento en la sensibilidad del receptor androgénico).
- Administración de andrógenos exógenos.
Según el origen de la excesiva producción en (ver tabla 2):

Hiperandrogenismo no ovárico
Pubarquia o Adrenarca prematura: Se caracteriza por la aparición de vello púbico antes de los 8 años en las niñas y antes de los 9 años en niños. Es secundaria al aumento de la producción de andrógenos.4 Está asociada a aparición de vello axilar, acné y aumento del olor corporal.
La edad ósea corresponde al crecimiento lineal de los pacientes. Los andrógenos suprarrenales están elevados, principalmente DHEA-S (dehidroepiandrosterona sulfato). Puede acompañarse de aceleración del crecimiento y edad ósea adelantada.
Hay aumento de los niveles séricos de insulina por disminución de los niveles plasmáticos de IGFBP-1 (proteína ligadora del factor de crecimiento similar a la insulina-1) y SHBG (proteína transportadora de hormonas sexuales). Hasta el 10 a 20 % de estos pacientes presentan síndrome de ovario poliquístico/androgénico7
Hiperplasia suprarrenal congénita:
La hiperplasia suprarrenal congénita (HSC) reúne una serie de trastornos de herencia recesiva que resultan de mutaciones que reducen parcial o completamente la actividad de enzimas involucradas en la síntesis de esteroides suprarrenales y ováricos.
En deficiencias de 21-hidroxilasa, 3βhidroxiesteroide deshidrogenasa, 11β-hidroxilasa, la síntesis de cortisol se traduce en un aumento de la secreción de ACTH, produciendo secreción excesiva de andrógenos suprarrenales.5
El 95% de los trastornos se debe a deficiencia de 21-hidroxilasa que produce aumento de la 17- hidroxiprogesterona y de andrógenos, y deficiencia de glucocorticoides y mineralocorticoides. En este síndrome se presenta virilización y aceleración de la edad ósea, y el diagnóstico diferencial se realiza determinando los niveles y después de estímulo con 1-24 ACTH de la concentración de 17-hidroxiprogesterona sérica.
El compromiso enzimático en la hiperplasia suprarrenal congénita está dado en un 95% por la afectación de la 21 alfa hidroxilasa, y 10 % por la 11 beta hidroxilasa.
Hiperandrogenismo no ovárico
Síndrome de Cushing:
Patología que se presenta con manifestaciones biológicas y químicas derivadas de la exposición a concentraciones persistentemente elevadas de glucocorticoides; puede cursar con desarrollo sexual prematuro, hirsutismo, acné e irregularidades del ciclo menstrual.
El hirsutismo asociado a virilización es un marcador de exceso androgénico y obliga a descartar tumores suprarrenales secretores de glucocorticoides y andrógenos.
La principal causa del síndrome es la administración exógena de esteroides; mientras que el síndrome de Cushing endógeno hace referencia a aumento de cortisol, ACTH y CRH.6
Tumores suprarrenales productores de andrógenos:
Son muy raros; en las niñas hay virilización y clitorimegalia. El inicio de los síntomas es rápido, en momentos diferentes de la menarquia y con rápida progresión. Los carcinomas son de mayor tamaño que los adenomas y tienen gran mortalidad.
Los carcinomas de la cortical suprarrenal tienen niveles elevados de dehidroepiandrosterona y testosterona, y se asocian al síndrome de Beckwith-Wiedemann y Li-Fraumeni. Se diagnostica por tomografía o RNM, y el tratamiento es quirúrgico.
Resistencia a los glucocorticoides:
Alteración del receptor de los glucocorticoides que altera su función en los tejidos diana. Hay aumento de la producción de ACTH y secreción de cortisol y andrógenos suprarrenales. Es un defecto heredado autosómico dominante. Se caracteriza por niveles elevados de cortisol con ausencia de manifestaciones de síndrome de Cushing.7
Hiperandrogenismo ovárico Síndrome de Ovario Poliquístico (SOP) o Síndrome de Ovario Androgénico (SOA). Se define como un trastorno multifactorial, complejo, genético y endocrino que se caracteriza por trastornos menstruales y/o anovulación, hiperandrogenismo clínico y/o bioquímico y/o micropoliquistosis ovárica.8
Epidemiología
La prevalencia mundial de SOP/SOA va de 4 a 21 % en función de los criterios diagnósticos utilizados.
Las variaciones en la prevalencia dentro de la misma definición en todos los países pueden ser explicadas en parte por las diferencias étnicas, por la variedad de enfoques utilizados para definir la población de estudio y la aplicación de diferentes métodos para evaluar las características clave del SOA.
Los resultados de los estudios epidemiológicos del SOA dependen en gran medida de cómo se definieron la población estudiada y los fenotipos del SOA.
Puede encontrarse hasta en un 35 % de las mujeres con amenorrea secundaria y 80 a 90% de las pacientes con oligomenorrea, en el 75 % de las pacientes que consultan por infertilidad por anovulación y en un 25 % en mujeres normales asintomáticas existe una tendencia familiar presentándose en el 32 % de las hermanas de pacientes con este diagnóstico, y en el 24 % de sus madres.9
(Lea También: Reproducción Humana y Embriología)
Fisiopatología
El aumento de andrógenos está relacionado con aumento de la hormona luteinizante (LH), y una capacidad mejorada de las células de la teca que impulsa la producción y el exceso de andrógenos ováricos. Hay secreción irregular de la GnRH (hormona liberadora de gonadotropinas) con aumento de la pulsatilidad, lo que ocasiona aumento de la LH.
Este aumento de los andrógenos está asociado con obesidad androide, depósitos de grasa visceral y dislipidemia, lo cual contribuye a la resistencia a la insulina.
La hiperandrogenemia, la obesidad y la hiperinsulinemia disminuyen la proteína globulina fijadora de hormonas sexuales, produciendo aumento de la testosterona bioactiva.
El aumento de andrógenos se traduce en un aumento de estrógenos con un estro persistente que lleva a un aumento de LH y una disminución de FSH que, como resultado, no estimula el crecimiento folicular con detención en diferentes etapas de su crecimiento con efecto morfológico directo sobre el ovario, produciendo aumento del número de los folículos, y aumentando la respuesta de las células de la granulosa a la hormona folículo estimulante, FSH32. Figura 6.

Las células de la teca son la principal fuente ovárica de andrógenos en este síndrome; además, estas células muestran una mayor capacidad de respuesta a la LH.
Las influencias ambientales también juegan un papel importante en las disfunciones multisistémicas como son la obesidad, la alteración dinámica de la gonadotropina, la producción excesiva de andrógenos y la resistencia a la insulina que se presentan como las principales características de la enfermedad. Tabla 3.

En la mujer con SOA la disminución de la sensibilidad del generador de pulsos de GnRH a la inhibición por retroalimentación de esteroides ováricos genera una rápida frecuencia de pulsos de GnRH en favor de la secreción de LH que puede tener efectos perjudiciales en la maduración de los ooocitos, la fecundación, el embarazo y las tasas de aborto involuntario.
La disminución de la producción de FSH causa arresto folicular, aumento de los niveles de inhibina e incremento persistente de estrógenos. El aumento de los niveles de LH da como resultado hiperandrogenismo asociado a concentraciones elevadas de 17-hidroxiprogesterona, androstenediona y testosterona.
Las mujeres con síndrome de ovario poliquístico/androgénico presentan disfunción reproductiva. Existen diferentes teorías de alteración de la función ovárica como son hipersecreción de LH, hiperandrogenemia, hiperinsulinemia, obesidad, disminución del activador del plasminógeno tisular y disfunción de la actividad endotelial, las cuales están relacionadas entre sí y se asocian a la anovulación y la alteración endometrial.
El SOA es probablemente la causa más común de infertilidad por anovulación; se ha asociado con un mayor riesgo de aborto involuntario después de una concepción espontánea o asistida, con una mayor incidencia de abortos espontáneos en el primer trimestre (25-73 %) y con anormalidades de la secreción de LH hasta en el 81 % de las mujeres causando pérdida fetal recurrente. En las mujeres que tenían abortos involuntarios recurrentes, con o sin síndrome de ovario poliquístico, se han observado niveles mayores de andrógenos.10
La irregularidad menstrual es la presentación ginecológica más común de este síndrome; la oligomenorrea se observa en aproximadamente 85 a 90 % de las mujeres con SOA, mientras que hasta un 30 a 40 % de las pacientes presentan amenorrea.
La disminución en los niveles de FSH produce la detención del crecimiento folicular; y la producción en exceso de estrógenos e inhibina B por múltiples folículos pequeños puede inhibir la secreción de FSH lo suficiente como para evitar la selección de un folículo dominante, lo cual contribuye al deterioro del desarrollo folicular.
La resistencia a la insulina (71 %) es la más común de las alteraciones metabólicas encontradas en las pacientes con SOA, seguida de la obesidad (52 %) y la dislipidemia (46,3 %), con una incidencia de 31,5 % para el síndrome metabólico. Los principales factores de riesgo que llevan a síndrome metabólico son la inactividad física y una dieta aterogénica, teniendo como característica clínica la obesidad abdominal o la adiposidad.
La resistencia a la insulina es fundamental en la patogénesis del SOA; es un precursor de la diabetes mellitus y además es uno de componentes del síndrome metabólico; se presenta en el 50 al 70 % de las pacientes con este trastorno endocrino y contribuye al hiperandrogenismo disminuyendo las SHBGs y estimulando la producción de LH.
La dislipidemia se presenta en el 85 % de las mujeres con SOA y se caracteriza por la elevación del colesterol total y las lipoproteínas de baja densidad (LDL), los triglicéridos, y una disminución de las lipoproteínas de alta densidad (HDL). La obesidad es otro factor que está presente en por lo menos el 50% de las mujeres con SOP y contribuye a la resistencia de la insulina y el hiperandrogenismo; de hecho, se ha demostrado en los estudios que la obesidad abdominal es un predictor independiente del paso de la normoglicemia a la intolerancia a la glucosa o DM2.
El SOA se asocia con un riesgo 50 % mayor de enfermedad cardiaca coronaria en comparación con mujeres sanas de la misma edad.
Los factores de riesgo cardiovasculares asociados incluyen resistencia a la insulina, obesidad central, hipertensión arterial, dislipidemia, hiperhomocisteinemia, aumento del grosor del endotelio y deterioro de la elasticidad vascular. Un marcador que ha demostrado ser predictor de eventos vasculares agudos como el infarto agudo de miocardio o la enfermedad cerebrovascular es la proteína C altamente específica, la cual ha estado más elevada en pacientes con SOA.11-17