Dr. Angel Emilio Bernal Baláez,
M.S., Ph. D. *
*Estomatólogo. Universidad de la Habana. Cuba. Magister en Histología Ph.D Patología Bucal. Profesor Asociado de la facultad de Odontología. Universidad Nacional de Colombia.
RESUMEN
Indudablemente la información científica sobre el surgimiento y desarrollo del cáncer, resulta una lectura de difícil compresión, atendiendo a los complejos mecanismos involucrados.
Esta dificultad ha de ser superada con una moderada dosis de autoestudio que permita, al profesional de la salud, no cerrar las puertas a un nuevo milenio en el que ineludiblemente tendrá que enfrentarse, en casi todas las especialidades, aun conjunto de explicaciones coherentes basadas en la Biología Molecular.
En la génesis del cáncer se involucran fenómenos complejos explicados de diferentes formas a lo largo de la evolución del conocimiento científico. Varias teorías han sido sugeridas al respecto donde los aspectos epidemiológicos, bioquímicos, genéticos y moleculares se combinan para dar respuesta al problema. El presente articulo, dirigido tanto a iniciados en el tema como a aquellos que se enfrentan por primera vez al mismo, recoge algunas de estas teorías y ofrece de forma resumida la idea de la carciogénesis como un proceso de “multietapas”, caracterizadas por alteraciones biomoleculares en especial las relacionadas con el ciclo celular.
PALABRAS CLAVES:
Cáncer; Carconogenesis; Iniciación; Promoción; Progresión; Neoplásica.
Una de las más interesantes paginas en la historia de la medicina los constituye la lucha contra el cáncer, que por su singular y heterodoxa conducta biológica figura entre las mas complicadas líneas del trabajo científico de nuestros días.
Numerosos intentos fueron realizados por diferentes científicos en el siglo XVIII, tratando de transplantar tumores humanos en animales. Las limitaciones científico – técnicas de la época impidieron la adecuada interpretación de los fracasos en aquellos primeros pasos de la oncología experimental. Fueron grandes los avances logrados con la aplicación de los principios de virchow sobre la patología celular para el conocimiento estructural de las neoplasias (1). Es en 1876 que el científico M.A. Novinsky realiza los primeros transplantes sucesivos de tumores malignos, considerándose a este investigador uno de los pioneros de las investigaciones experimentales sobre el cáncer (2) (3).
No fue hasta finales del siglo XIX que la experimentación oncológica transito desde el período
preaséptico hasta el período aséptico. Sin embargo el promisorio advenimiento de la época Pasteuriana basada en los conocimientos sobre la transmisión de algunas enfermedades infecciosas condujo a no pocos científicos, a equívocas interpretaciones acerca del cáncer como entidad contagiosa (3).
En el presente siglo se inicia una nueva etapa abordándose este problema desde diferentes ángulos en la medida del desarrollo de las distintas especialidades. En la actualidad, atendiendo al caudal de conocimientos que obran en la literatura mundial podemos enfocar al cáncer como una enfermedad multifactorial, de etiología discutida, donde la edad, el sexo, la raza y la herencia se reconocen como factores genéticos de riesgo, según las distintas localizaciones. La dieta, los hábitos tóxicos, el estilo de vida y el medio en general, incluyendo la infección por microorganismos, son factores que actúan sobre el genoma de las células como iniciadores ó promotores en el complejo proceso de transformación celular hacia formas de mayor complejidad biológica. Debe señalarse la relación Medio Ambiente – Herencia como los extremos de un espectro en cuyo centro se sitúa la casualidad de la mayor parte de las neoplasias que padece el hombre.
INICIACIÓN PROMOCIÓN
LOS DOS PRIMEROS AÑOS
Los resultados de Yamagiwa e Ichikawa (1915), aplicando repetidamente alquitrán en la oreja de conejos, establecieron el primer modelo de carciogénesis en el que se materializaba una vieja observación causa – efecto realizada por Sir Precival Pott (1774), quien reportó el cáncer de escroto en desollinadores de chimeneas. Años mas tarde se demostró que los responsables de estas neoplasias desarrolladas en diferentes condiciones y tiempos, eran principalmente los hidrocarburos policíclicos aromáticos contenidos en el alquitrán (4).
La existencia de dos etapas discretas para la carciogénesis, fue propuesta originalmente por Beremblum y Shubik (5), las que constituyen una de las evidencias experimentales propuestas por Gavilondo (6) como parte de ese conjunto de fenómenos que sustentan el concepto de Progresión Neoplásica enunciado por Foulds (7). Alrededor del modelo de “pasos múltiples”, se postulan teorías actuales relacionadas con el ciclo celular y su participación en estos fenómenos, lo que ha orientado la dirección de las investigaciones actuales relacionadas con este tema (6) (7) (8).
Cada cáncer posee características que reflejan su origen; la mayoría deriva de una célula anormal (origen monoclonal) iniciada en un cambio genético (11) (12) (13). Las células que conducen al cáncer pueden mostrar, en su mayoría, alteraciones en las secuencias del ácido desoxirribonucleico (ADN) que contienen una aberración heredable; también pueden existir cambios epigenéticos que no afectan directamente el ADN pero sí al patrón de expresión de un gen (14). En general el cáncer no es causado por un solo evento, sino, es el resultado de varios cambios independientes ocurridos en una célula con efectos acumulativos.
Existe una clara relación entre carciogénesis y mutagénesis inducidas por 3 clases de agentes:
– Carciógenos químicos: Causan cambios locales en la secuencia del ADN.
– Los virus: Introducen sus secuencias nucleóticas en el interior de la célula.
– Radiaciones ionizantes: Provocan traslocaciones y rupturas de cromosomas.
Algunos carciógenos, fundamentalmente químicos, actúan directamente en las células o funcionan indirectamente después de haber sido transformados en metabolitos más reactivos (15). Los carciógenos que actúan directamente sobre el ADN celular reciben el nombre de genotóxicos (16) (17), otros que no lo hacen de esta forma, no genotóxicos, tienen un mecanismo más controvertido que involucra la activación de receptores de superficie celular, la activación e inhibición de enzimas y factores transcripcionales, la inhibición de la apoptosis, o la citoxicidad celular directa con hiperplasia regenerativa, aunque para algunos la diferencia entre estas 2 categorías es arbitraria (18-21).
En el hombre ocurren 1016 divisiones celulares en el curso de la vida en un medio sin mutagenos; aproximadamente suceden 106 mutaciones por gen en cada división celular, a pesar de la reparación del ADN. Durante la vida, un solo gen puede experimentar mutaciones en 1010 ocasiones; en medio de éstas se pueden afectar los genes involucrados en la regulación de la división celular y se pierde la normal restricción de la proliferación. Las evidencias indican que es necesario que una célula sufra de 3 a 7 eventos independientes para que suceda una transformación neoplásica (14) (22).
Cuando se produce una alteración del ADN se advierten 3 posibilidades para la célula: pueden actuar los mecanismos de reparación del daño y la célula regresar a la normalidad, la célula puede morir o puede pasar a ser una célula iniciada en la transformación. La iniciación como cambio molecular heredable no es un evento suficiente, la proliferación de las células alteradas requiere de otro paso: la promoción.
Los agentes promotores pueden ser exógenos o endógenos. Los hidrocarburos policíclicos aromáticos desprendidos en la combustión de cigarros y tabacos representan un ejemplo de elementos exógenos muy ricos tanto en agentes iniciadores como en promotores, razón por la cual han sido empleados en modelos experimentales de carciogénesis (23) (24) (25). Entre los promotores endógenos podemos puntualizarse que los agentes promotores no son necesariamente carciogénicos pero pueden causar cáncer si actúan sobre una exposición previa a un iniciador (14) (26) (27) (28). (Ver gráfico 1).

El efecto de los promotores es estimular la división celular de una célula que sufrió previamente una mutación por la acción de un agente iniciador. La célula iniciada responde ante la acción del promotor con un crecimiento distinto a las células normales. Experimentalmente un papiloma, que tiene aproximadamente 105 células, puede regresar a la normalidad cuando el promotor es retirado (14) (22).
En relación a la participación de los virus en el proceso de la carciogénesis, se acepta que están relacionados con el 15% de los tumores pero es difícil definir su papel debido al tiempo que media desde la infección hasta el desarrollo del cáncer (18) (29) (39).
Existen 2 tipos de virus atendiendo al material genético que aportan: Los virus ácido ribonucléico (ARN) y los virus ADN. Cuando la célula se infecta por un retrovirus, el ARN es copiado a ADN por acción de la enzima reverso transcriptas e insertado en el genoma del huésped donde persiste en las subsecuentes generaciones celulares. Esta secuencia de ADN que es transportada por la célula, no es necesaria para la supervivencia del virus, pero provoca cambios que conllevan a la transformación celular.
Los virus ADN se insertan en el cromosoma de la célula huésped o son retenidos en un plásmido extracromosomal que se replica usando la maquinaria protéica de este y ejerce diferentes acciones. El virus del papiloma virus (HPV), que esta relacionado con el cáncer cervicouterino (HOV 16 y 18) y aislado en carcinomas escamocelulares orales (HPV 6 y 11), por ejemplo, parece actuar directamente a través de los productos de gene E6 y E7 que son 2 proteínas oncogénicas que se unen a 2 componentes protéicos sintetizados de 2 genes supresores, a las anti-oncoproteinas p53 y Rb105, importantes en la regulación del ciclo celular (31) (32).
Las radiaciones, cualesquiera sean sus fuentes (rayos ultravioleta, rayos X, fisión nuclear, radionuclidos), son carcinógenos establecidos (4). En este proceso de cancerogénesis física, se identifican radiaciones con poder genotóxico (ionizantes y no ionizantes) así como radiaciones no genotóxicas.
Las radiaciones genotóxicas ionizantes, son las más dañinas de todas, al ser portadoras de energía de muy alta penetración con capacidades muy destructivas en la materia viva, ocasionando daños, por liberación de radicales libres, como rompimientos cromosómicos y en las cadenas ADN.
Las radiaciones genotóxicas no ionizantes (Ej. UV), su energía es insuficiente para ionizar la materia y producir radicales libres, sin embargo es suficiente para interactuar con el ADN y dañarlo.
Dentro de los procesos de iniciación – promoción, es conveniente reflexionar sobre la gran susceptibilidad de las poblaciones celulares que han sufrido un daño inicial en el ADN, las cuales no evidencian aún cambios morfológicos identificables que permitan un diagnóstico precoz, y que son blanco fácil de las acciones promotoras de productos químicos o elementos físicos con capacidad de actuar sobre los mecanismos del control y la proliferación celular potenciando sus efectos mediante el fenómeno de sinergismo.
PROGRESIÓN CELULAR
TERCER PASO
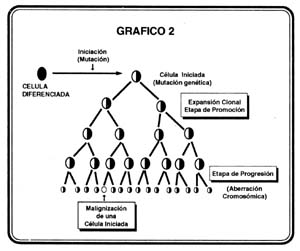
Durante el período de progresión, las células, hasta entonces premalignas, hacen su conversión en células malignas a través de un proceso multifocal donde unas se transforman más rápido que otras. La progresión de clones que han transitado por etapas de iniciación – promoción, puede ocurrir espontáneamente debido a la inestabilidad genética propia de la célula o puede ser acelerado por la exposición de elementos genotóxicos que actúan sobre éstas (33). (Ver gráfico 2).
Una masa tumoral clínicamente detectable pesa alrededor de 1g y se compone, aproximadamente, de 109 células logradas en 30 ciclos celulares. La fracción de crecimiento de un tumor contiene el reservorio de células que proliferan y es, a lo sumo, de un 20% en tumores agresivos; luego la mayoría de las células no están en fase de replicación. La duración del ciclo celular en una célula neoplásica no es más corto que el de una normal sin embargo, un tumor maligno crece más que el tejido sano (22) (34).
Cada célula pluripotencial genera una célula hija pluripotencial y otra, destinada a diferenciarse, que cesa su división. La fina homeostasia entra la producción y la perdida de células distingue a la proliferación normal de la alterada. Unos tumores son más lentos que otros; por ejemplo, en el adenocarcinoma de colon el crecimiento sólo supera la perdida en un 10% por ello, es más lento que un linfoma de alto grado de malignidad que puede harcelo a un 20% la latencia de un tumor que teóricamente dura 90 días (30 ciclos de replicación) es un suceso que puede llevar meses y hasta años. Un tumor clínicamente detectable ya cumplimentó, en general, las etapas de su desarrollo (22) (35).
Dado que entre los descendientes de las células transformadas es fácil identificar subclones que difieren en el cariotipo, expresión de antígenos de membranas, velocidad de crecimiento, capacidad de infiltración, resistencia a antineoplásicos, etcétera, entonces puede considerarse que los tumores son masas heterogéneas a pesar de su origen monoclonal (10). La desaparición de subclones por la acción del sistema inmune, o de otros factores, origina una selección sobre los subclones y muchos de los que sobreviven logran mejor capacidad para la invasión y la metástasis. La célula tumoral, además, puede estimular el desarrollo de vasos sanguíneos para los nutrientes y el O2 que necesita (14).
EL CICLO CELULAR EN LA CARCINOGENESIS
Como ya se explico anteriormente el crecimiento del tejido depende del balance entre la proliferación renovadora de células y la muerte de éstas. El paso de la información contenida en la célula madre a su descendencia se hace durante el ciclo celular por un proceso que garantiza máxima fidelidad. Este ciclo consta de 4 etapas G1, S, G2 y mitosis, pero sólo en G1, bajo la influencia de factores extracelulares (mitogéneticos), una célula prolifera o sale del ciclo hacia el reposo (G0) (tomando como modelo células estables); una vez superado este punto de restricción, mecanismos intrínsecos conducen a la división (36) (37) (Ver Gráfico 3).

El mantenimiento en el orden de las fases del ciclo es indispensable; si mitosis comenzara cuando la síntesis de ADN no hubiese concluido se generarían alteraciones de imprevisibles resultados. La progresión y el control del ciclo celular son realizados por vías bioquímicas. De forma general, una familia de kinasas (CDK), cuya acción catalítica es dependiente de la unión a proteínas ciclinas, induce la fosforilación de sustratos que a su vez controla la función de una familia de 5 reguladores transcripcionales llamados E2Fs. Los factores E2Fs transactivan genes cuyos productos son importantes en la entrada a la fase S del ciclo celular (dehidrofolato reductasa, timidina, kinasa, timidilato sintetasa, ADN polimerasa alfa, CDC2, que participan directamente en la sisaseis del nuevo ADN), pero además, promueven a la propia producción de algunas ciclinas (E,A) y autoinducen al E2F1.
Aunque se reconocen varios sustratos de las holoenzimas CDK-ciclinas, la atención se centra sobre la proteína sel retinoblastoma (RB) la cual es el producto de un gen supresor que inhibe la proliferación celular manteniendo inactivo a EF2 mediante su unión en un complejo (38) (39). La fosforilación de RB, por CDK-6 y CDK-4 unidos a ciclinas D y al complejo CAK (ciclina H más CDK-7), libera a EF2 y permite la entrada a la fase S del ciclo celular. El complejo de kinasas es regulado negativamente por la familia de inhibidores INK4, (40) (41).
La fosforilación de Rb dependiente de esta vía es inducida por factores de crecimiento que actúan a través de ciclinas D; el cese de la acción de éstos retira a la célula del ciclo. Los pasos que continúan y mantienen la activación son autorregulables e independientes de los estímulos externos y se realizan con la participación del complejo ciclinas ECDK-2 y ciclinas Ay B que fosforilan RB durante más tiempo. Varias proteínas inhiben este segundo paso y la p27KIP1 puede ser la más comprometida en la regulación a juzgar por los altos niveles observados en células quiescentes que disminuyen con la activación. Otras transiciones en ciclo como G2 mitosis son dependientes también de ciclinas y regulables en puntos de control. (42-45).
Una célula que sale del ciclo celular está destinada a madurar o a diferenciarse. La eliminación fisiológica de una célula es también programada y puede ocurrir, además, bajo circunstancias apropiadas por apoptosis sin afectación de los tejidos vecinos. Dada la importancia de estas vías en proliferación celular, no sorprende que éstas constituyen las dianas en el estudio de la acción de oncogenes y genes supresores involucrados en la carciogénesis.
Existen 2 rutas mutacionales: La primera es realizada por genes estimuladores con efecto dominante; la segunda es la de inactivar un gen inhibitorio de carácter recesivo, (8) (14) (46) (47). Aproximadamente se reconocen 100 proto-oncogenes en el hombre; muchos de ellos codifican elementos como receptores trasmembrana, proteínas de secreción, proteínas unidoras de GTP, proteínas quinasas y proteínas reguladoras que controlan la conducta “social” de las células (36) (37). Un proto-oncogen puede “activarse” por delaciones o mutaciones puntuales en la secuencia codificante, amplificación génica o reordenamiento cromosómico que incluye la traslocación (14).
La mutación de un protocongen frecuentemente perpetua la activación de la cascada constitutiva existente entre el receptor hasta el ultimo eslabón de la división celular. La traslocación de la ciclina D1 es un factor que puede conducir a la directa del sistema. La amplificación de esta ciclina aparece en el 43% de tumores de cabeza y cuello, 34% de esófago y 13% de mama. En esta última localización, sin embargo, hay un 50% de casos con incremento de la proteína sin correlación directa a la amplificación génica lo que supone mecanismos alternativos.
Las mutaciones que dañan los mecanismos reparadores del ADN impiden sus funciones y aumentan el ritmo habitual de mutaciones espontaneas que llevan al cáncer. Se ha observado un aumento de neoplasias en enfermedades con deficiencias en la reparación del ADN como por ejemplo, en la anemia de Fanconi, elementos como la P53 detienen el ciclo celular en ciertas fases y permiten la reparación del ADN hasta que sea viable o en su defecto inducen a la muerta celular (34) (37) (48).
Se ha pensado que en los fallos que ocurren durante la diferenciación participan cambios genéticos específicos. Los oncogenes c-myb han sido implicados en la progresión celular y se ha observado su disminución durante la diferenciación terminal de una célula. Su expresión constitutiva bloque la maduración de células mieloides que son inducidas a diferenciarse. MYB es una proteína enlazante de ADN que activa promotores de la transcripción en un numero de genes. Dada esta propiedad es posible que conduzca a patrones anormales de expresión génica, a expresión truncada de proteínas o a la producción de proteínas fusionadas (47).
En resumen, los cambios ocurridos desde la transformación primaria de la célula hasta el establecimiento de un tumor maligno se acompañan de alteraciones moleculares. En nuestra opinión, la extrapolación de modelos experimentales de la carciogénesis, como fue en sus inicios el modelo en “pasos múltiples”, encuentra fundamentación en estos eventos; por ejemplo, la iniciación en algunos tumores incluye la alteración de la vía de trasnducción de señales en que se afecta el oncogen ras y que establece una relación entre señales que provienen del medio extracelular con el núcleo. Durante la progresión se observa a la inactivación de la P53.
En la última etapa de conversión maligna, se observa la sobreexpresion de la actividad transcripcional del AP-1, amplificación genética, y otros cambios que facilitan la posterior migración e invasión del tumor. Por otra parte las relaciones comprendidas entre las vías del ciclo celular y los factores externos e internos que la modulan han revelado tantas conexiones que se hace difícil delimitar pasos en la formación de los tumores cuando varias vías se afectan a la vez y se descubren constantemente nuevos elementos en el sistema (49-56).
REFERENCIAS BIBLIOGRÁFICAS
- Stewart, H.L: Historix review trasplantable and transmitible tumors od animals. Atlas tumor pathology. Fascicle 40. Section XII., 1959. Pag 103.
- Shabad, L.M. and M.A. Novinsky: The founder of experimental oncology. Ed. Medicina. Moscu, 1950. P.20.
- Shabad, L.M.: Métodos de determinación de cancerígenos. Ed. Medicina Moscú, 1970. Pag. 45.
- Kumar, V. Cotran, R. And S. Robbins. Patología Humana.V.Ed. Interamericana. McGraw-Hill. México, 1995. Pag. 204.
- Beremblum, I. And P. Shubick: Anew qualitative aproach to the study of the stages of chemical carcionogenesis in the mouse skin. Br. J. Cancer 1:383,1947.
- Gavilondo, J. Estudios experimentales sobre progresión neplasica y el proceso de metastasis. Tesis de Doctorado. La haban, 1984.pag. 5,
- Foulds, L: The experimental study of tumor progresión : Areview. Cancer Res. 14: 327,1954.
- Oltvai, Z.N., Millisman , C. And S.J: Krosmayer : BCL-2 heterodimerizes in vivo with a conservated homologbox that acelerate programmes cell death. Cell 74:609,1993.
- Symonds, H., Krall, C. and L. Remingtong , P53 pendent apoptosis supresses tumor growth and progression in vivo. Cell 78:703,1994.
- Vogelstein, B. And K.W. Kinszler: The multistep nature of cancer. Trends Genet 9:138,1993
- Arnold, A. A….: Monoclonaty and abnormal parathyroid genes in parathyroid adenomas. N. Eng. J Med. 318: 658,1998.
- Fearon, R.R. : Clonal analysis of human colorectal tumors. Science 238:193,1987.
- Ponder, B.A.J : Direct examination of clonality of carcinogen induced epithelial dysplasia in chimeric mice. J. Natl. Cancer Inst. 77: 967,1986.
- Alberts, B, Bray, D., Lewis, J. Raff, M., Roberts, K. And J.D. Watsoin: Molécula
- Weisburguer, J. And G. Williams: Causas del cancer. En : Murphy, G, P. Lawrence, W., Lenrahrd, R. : Oncologia clinica. Manual de la American Cáncer society. Washintong; Publicación Científica 2.
- Lawley, P.D.: Historical origins or currentes concepts of carcionogenesis. Adv. Cáncer Res. 165: 17, 1994.
- Dipple, a.: ADN adducts of chemical carcionogens. Carcionogenesis 16 : 437,1995.
- Tenner, R. N.: A perspective on non mutagenic mechanisms in carcionogenesis.Environ. Health Perspect. 101(Soppl 3): 231,1993.
- Dunnick, J.F., Huff, J. And induced mammary gland cancer in tha national program´s carcionogenesis 16: 173,1995.
- Marsman, D.S, and J.C. Borret : Apoptosis and chemical carcionogenesis. Risk anal. 14 : 321,1994.
- Jackson, M.A., Stack, H.F. and M.D. Walters : The genetic toxicology of putative non genotoxic carcionogenes. Mutant . Res, 296: 241,1993.
- Cotran, R.S., Kumar, V. And S.L. Robbins : “Pathologic Basis of Disease”. V. Ed. W.B. Saunders Company. Philadelphia, 1990. Pags 104.
- Bernal Balaez, A.E.: Evaluacionde la actividad mitotica durante la carcionogenesis oral con el empleo de un analizador de imágenes Leitz-ASM68K. Rev. Federeacion Odontologica Colombiana. No 187. Nov/95-Mar/96. Pag.57.
- Bernal Balaez, A.E.: Modificaciones del espesor epitetiaL en el proceso de carcionogenesis bucal. Tribuna Odontologica. Revista Latinoamericana de Educacion Continuada. 3:15,1996.
- Bernal Balaez, A.E.:Estudio cariometrico de la mucosa bucal en un modelo de carcionogenesis quimica Rev. Federacion Odontologica Colombiana. No 192. Nov/97 – Abril/98.
- White , R.L. : The molecular genetics of cancer : where we are and where are going. In Forther J, Rhoads J.E. Accompolishmenst in cancer research. Lippincott,. Philadelphia, 1995. Pag 88.
- Schwartz, J.L. and G. Shklar : Verification in syngeneic hamsters of invitro transformation of hamsters oral mucosa by 7,12 – dimethylbenz(a)antracene. Oral Oncol. 33 :431,1997.
- Tanaka, T,. Kawabata , K,. Kakumoto, M., et al : Chemoprevention of 4-nitroquilonine 1-oxide- induced oral carcionogenesis by citrus auraptene in rats. Carcionogenesis 19: 425,1998.
- Shah, K.: Biology of genital tract human papilloma viruses. Urol Clin. Of North Am. 19:63,1992.
- Snijders, P. Van Den Brule, A., Merjer. C. et al : Papillomaviruses. Edited by H. Zur Hausen. Ed. Springer Verlag. Berlin, 1994. Pag. 177.
- De Caprio, J. Sv 40 large tumor antigens forms especific complex with the products of Retinoblastoma susceptible gene. Cell 54: 275,1988.
- Holey , P.: Mechanistic role for human papillomavirus in humAN CANCER. In : Forther J. Rhoads JE. Accomplishment in cancer research Lippincott. Philadelphia, 1995. Pag . 174.
- Loeb, La.: Microsatellite inestability : markert of mutation phenotype. Cancer res. 54 : 5059,1994.
- Tannock, I .F. : Tumor growth and Cell Kinetics . In : Tannock , I.F. , Hill , R. P. ; Eds. The basic science od oncology . New York : pergamon, 1987. Pag 140.
- Marinello, Z., Popov, E. Y E. Popjristova : sobre la histomorfologia de los tumores malignos. Instituto Nacional de Oncologia y Radiobiologia de Cuba. Instituto del Libro. La Habana, 1970. Pag 49.
- Kastan, M.B. Molecular biology of cancer: the cell cycle . In : De vita, V.T. Cancer : prinpiples and practie of oncology. V. Ed. Lippinfgcot. Philadelphia, 1997. Pag 121.
- Sherr, C. J. : Cancer cell cycles science 274: 1672,1996.
- Nagaraja, R.R. : Targets for cancer theraphy in tge cycle pathway. Curr. Opinion Oncol. 8.516,1996.
- Cobrinck, D. : Regulatory interactions among E2F and cell cycle control proteins. Curr. Top. Microbiol. Immunol. 208:31,1996.
- Slansky, J.E. and P. J. Farnham: Introduction to the E2F family : protein structure and gene regulation. Curr Top. Microbiol. Immunol. 208:1,1996.
- Beijersbergen, r.L. and R. Bernards: Cell cycle regulation by the retinoblastoma family of growth inhibitory proteins.Biochem. Biophys Acta 1287: 103,1996.
- Hall, M. And G. Peters : Genetic alteracions of cyclinics, cyclin dependent kinases and CDK inhibitors in human cancer. Adv. Cancer res. 68: 67,1996.
- Sherr, C.J. and J.M. Roberts: Inhibitors of mammalian G cyclin – dependent kinases Genes Devel ): 1149,1995.
- Morgan. D. O.: principles of CDK regulation Nature 374: 131,1995.
- Hirama, T. And H.P. Koeffler : Role of the cyclin dependents kinase inhibitors in the developent of cancer. Blood 86:841 , 1995.
- Marx, J.: How cells cycle toward cancer. Science 263:319,1994.
- Hortwell, L.H. and M.B. Kastan : Cell cycle control and cancer . Science 266:1821,1994.
- Perkin, A.S. and D.F. stern: Molecular biology of cancer: oncogens. In De Vita, V.T. Cancer : principles and practice of oncology V Ed. Lppicont. Philadelphia, 1997. Pag.79.
- Shibata, Y., Nishimura, S., Okuyama, A. And T. Nakamura : P53 : independent induction of apoptosis by cyclin – dependent kinase inhibition. Cell Growth Diff. 7:887,1996.
- Perry , M.E. and A.J. Levine: tumor suppresor P53 and the cell cycle. Curr. Opin. Genetec. Dvel. 3:50,1993.
- Debbas, M. And E. White: Wild type P53 mediated apoptosis by EIA which is inhibited by E1B. Genes Dev. 7. 546,1993.-
- Anderson, M.W., Reinolds, S.H., You, m., et al : Role of proto-oncogene activation in carcionogenesis. Environ Health. Perspect. 98:13, 1992.
- Weinberg RA. Tha molecular basic of oncogenes and tumor suppressor genes. Ann N. Y: Acad. Sci 718: 331,1995.
- Grenblatt, M.S., Bennett, W. P.., Hollstein, M., et al : Mutations in the P53 tumor suppressor gene : clues to cancer etiology and molecular pathogenesis. Cancer Res. 54:4855,1994.
- Aznavoorians,S., Murphy , A.N. Steler –Stevenson, W.G. et al : Molecular aspects of tumor cell invasion and metastasis. Cancer 71:1368,1993.
- Piffko, J. And A. Banlfalvi: Molecular assesment of P53 abnosmalites at the invasive front oral squamous cell carcionomas. Head Neck 20.8,1998.