DM.D., Cavelier C. Luis E., M.D., Jiménez D. Carlos, B.Sc íaz Y. Ivonne, M.D., Gómez C. Pablo,
Unidad de Fertilidad PROCREACIÓN MÉDICAMENTE ASISTIDA. Clínica Marly; Bogotá. Colombia
Auger Jacquer, M.D.PhD
Hospital Cochin, Laboratorio Biología de la Reproducción; París, Francia
Bernal Alejandra, B.Sc
Unidad de Fertilidad del Country- CONCEPTUM, Bogotá, Colombia
Introducción
El éxito de criopreservar espermatozoides no eyaculados, ha sido reportado en pacientes con azoospermia no obstructivas1,2.
Cada día más la inyección intracitoplasmática con espermatozoides de origen testicular se está convirtiendo en un método para el tratamiento de parejas infertiles por azoospermia3,4,5,6. Diferentes técnicas quirúrgicas para la obtención de espermatozoides testiculares han sido utilizadas como lo son la biopsia testicular abierta(TESE)7,8; y la aspiración con aguja(PESA)9.
Romero y col.10 reportaron fertilización con espermatozoides testiculares congelados y posteriormente; Hovatta y col.11 describieron un embarazo logrado con ICSI utilizando espermatozoides testiculares congelados. La realización de biopsia testicular en pacientes con azoospermia no obstructiva, es cada día más utilizada, no solo para diagnóstico, sino también para tratamiento; usualmente, estos pacientes tienen testículos pequeños y son sometidos de manera repetida a biopsias, lo que lleva a una disminución progresiva, tanto del tamaño como de la función testicular.
Reportamos el caso de un paciente que fue sometido a biopsia testicular diagnóstica, y a congelación y para ser utilizada en técnica de ICSI.
Caso reportado
Se trata de un paciente de 34 años, con antecedentes de prostatitis tratado con antibióticos y varicocele subclínico intervenido 2 años atrás. Como información adicional, el paciente reporta espermograma con 15 millones de espermatozoides por centímetro hace 15 años, pero ha evolucionado hacia la azoospermia a partir de este año.
Presentó un cuadro de orquitis post- parotiditis hace 7 años y refiere atrofia testicular de manera progresiva. No hay ningún otro antecedente de importancia y reporta una vida sexual totalmente normal. Al examen físico llama la atención una atrofia testicular bilateral que permite simplemente encontrar un 25% del tamaño testicular normal; el cuadro clínico se interpreta como una atrofia testicular post-parotiditis. Se solicita dosificación de FSH, la cual muestra un nivel de 38.54UI/ml.
La biopsia testicular es realizada bajo anestesia local, con apertura transversal del escroto y exposición del testículo; se realiza apertura de túnica vaginal y se procede a la extracción de la biopsia testicular, de un tamaño aproximado de 0.5 ml; se realiza cierre con catgut cromado 3 ceros y sutura por planos; no se presenta ningún tipo de complicación postoperatoria.
En la muestra obtenida, llama la atención, que al aspecto macrocóspico del tejido testicular es más oscura de lo usual. Se envía biopsia testicular para patología que es reportada como arresto espermatocítico incompleto, hiperplasia de células de Leydig y atrofia focal.
Se recibe en el laboratorio un corte de testículo derecho, que se deposita en una de caja de Petri de 35 x 10 mm (Falcon), que contenía HTF (Irvine, Sci; USA) al 4% del Albúmina humana (Irvine. Sci; USA) pre equilibrada al 5% de CO2 Y 37ºC.
Se realizó microdisección del tejido testicular con agujas de insulina y/o bisturí. Después de separar todos los tubos seminíferos, se observó la presencia de células espermáticas, encontrándose entre 1 a 2 espermatozoides móviles por campo. Luego se mantuvo este procesado durante dos horas en incubadora de CO2 a 37ºC. Posteriormente, se tomó el sobrenadante; se centrifugó por 10 minutos a 250g, desechando el sobrenadante y dejando un pellet entre 250 a 500 microlitros se procedió a realizar la mezcla en relación 1:1 con medio de congelación (Ackerman). Esta dilución se mantuvo por 15 minutos a 37ºC y se procedió al llenamiento de las pajillas de 0.25cc (tres pajillas), para realizar posteriormente el procedimiento de congelación.
La esposa de 29 años de edad sin antecedentes de importancia; con niveles al tercer día del ciclo de FSH de 4,28 mUI/ml; LH de 3.26 mUI/ml; Estradiol de 73.35 pg/ml. Se inicio esquema de inducción de ovulación para técnica de reproducción asistida (ICSI), utilizando un esquema de protocolo largo con análogos de la GnRH (Acetato de leuprolide de 3.75 mg), aplicado en la fase lutea del ciclo precedente, una vez se confirmó que los niveles de estradiol se encontraban por debajo de 50 pg/ml comenzamos la inducción de ovulación mediante FSH recombinante, aplicando un total de 22 ampollas.
Una vez se observaron folículos con tamaño superior a 18 mm, se procedió a la colocación de gonadotropina coriónica humana 10.000 UI y se realizó la aspiración folicular vía transvaginal con Ecografo marca ALOKA con transductor 7.5 Mhz; bajo anestesia general. De este procedimiento se obtuvieron un total de 5 oocitos. Las células de la granulosa fueron removidas 3 horas después de la aspiración en una solución tamponada de hialuronidasa a 80 UI/ml (Sigma, USA). Se observan cinco oocitos en Metafase II, los cuales fueron microinyectados.
La muestra de espermatozoides testiculares fue descongelada (3 pajillas), lavada una vez, resuspendida en 1 ml de medio tamponado con HEPES y mantenida a 37ºC hasta el momento de ser empleada. Al no observar ningún espermatozoide móvil, se realizó una prueba de vitalidad con Eosina (OMS, 1992), y se detectaron un 37% de gametos con adecuada integridad de membrana.
En la placa de ICSI (Beckton Dickinson, USA), se dispusieron las siguientes gotas:
Cuatro gotas de medio tamponado, dos gotas de Polivinilpirrolidona – PVP (Irvine Scientific, USA), una gota de suspensión de espermatozoides, una gota de solución hiposmótica (OMS).
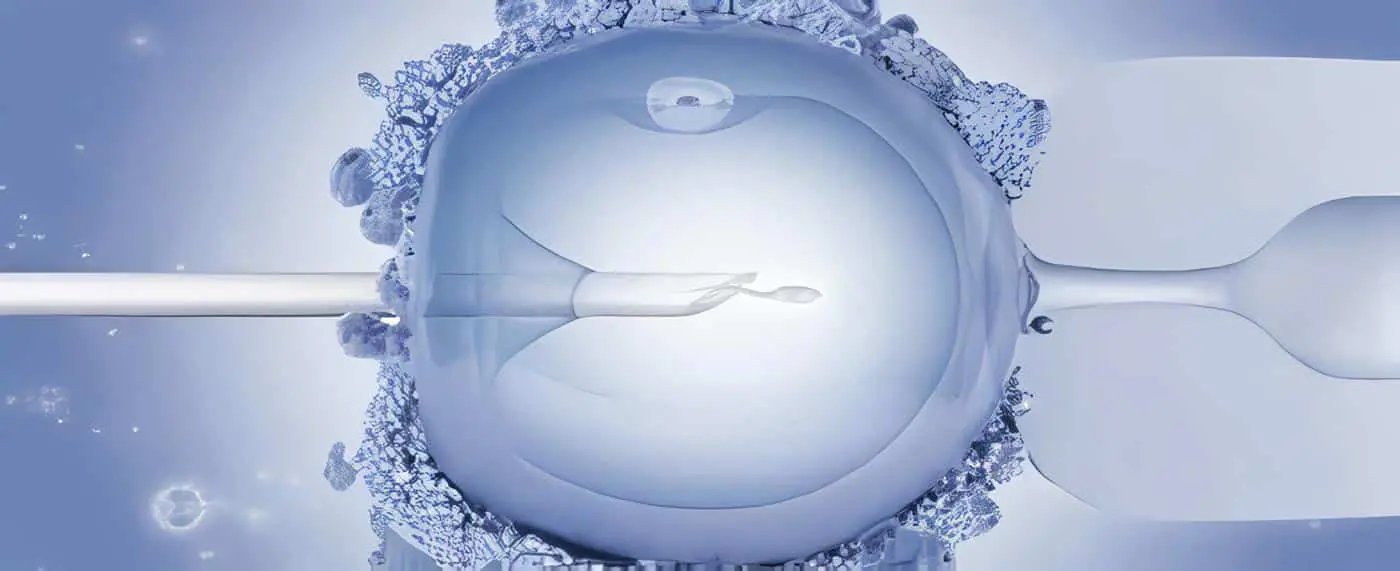
Por medio de micromanipulación se seleccionaron espermatozoides de morfología normal y se transfirieron a la gota de solución hipo-osmótica, observandolos uno a uno; aquellos donde fue evidente una reacción positiva se transfirieron a una de las gotas PVP. Para procedimiento de ICSI se empleo una pipeta de microinyección con un diámetro interno de 5 – 7 um y se realizó de acuerdo a la técnica descrita por Van Steirteghem12.
La fertilización se observó a las 16 horas de la microinyección, en la cual se apreciaba la presencia de dos pronúcleos en cuatro ovocitos. La transferencia de tres embriones y un cigoto fue llevada a cabo a las 48 horas del ICSI.
La paciente se somete a dosificación de Beta HCG cuantitativa los días 10, 12 y 14 post-transferencia, las cuales fueron de 42.8, 119 y 393 UI. respectivamente.
Se realiza ecografia transvaginal a la sexta semana de embarazo, observándose embriocardia positiva con longitud cefalocaudal embrionaria de 1.6 cm.
El bebé nació el 24 de marzo de 1999, Sexo: Masculino, Peso 4.000 gr., Estatura 53 cm, 38 semanas y media por cesárea sin ninguna complicación.
Discusión
El presente caso reportado demuestra una vez más la factibilidad de criopreservar tejido testicular durante una biopsia diagnóstica para la realización de reproducción asistida en un segundo término. En este caso específico; consideramos que la congelación de tejido testicular fue adecuada; sin embargo, no observamos movilidad post-congelación por lo que fue indispensable la realización del test hipo-osmótico para la escogencia espermática previa al ICSI; como ha sido descrito por otros autores13.
Por otra parte; la realización de biopsia testicular abierta fue una buena elección ante el estado de atrofia testicular encontrado. Creemos que la aspiración con aguja hubiese limitado aún más el número de espermatozoides encontrados.
Aunque la mayoría de pacientes con azoospermia no logran embarazo en su primer ciclo; ellos se ven obligados a repetirse la biopsia testicular en varias ocasiones; por esta razón, la búsqueda de espermatozoides por disección y su congelación posterior, evitaría una nueva biopsia con los efectos deletéreos que esto conlleva14. Cabe aclarar; que esta búsqueda de espermatozoides debe ser meticulosa, la cual requiere de tiempo (en rango de 45 minutos) que se puede reducir de acuerdo a la experiencia adquirida.
Por último, nuestra recomendación para pacientes con azoospermia no obstructiva es la realización de biopsia testicular abierta para diagnóstico y congelación; así ellos se pueden beneficiar de una técnica de reproducción asistida en un futuro.
Bibliografía
1. Nagy Z, Liu J, Janssenwillen C, Silber S, Devroey P, Van Steirteghem AC. Usin ejaculated, fresh and frozen-thawed epididymal and testicular spermatozoa gives rise to comparable results after intracytoplasmic sperm injection. Fertil Steril 1995; 63:808-15.
2. Devroey P, Silber S, Nagy Z, Liu J, Tournaye H, Joris H, et al. Ongoong pregnancies and birth after intracytoplasmic injection with frozen-thawed epididymal spermatozoa. Hum Reprod 1995; 10:903-6.
3. Schoysman, R., Vandervalzem, P., Nijs, M. et al. (1993) Pregnancy after fertilization with human testicular spermatozoa. Lancet, 342, 1237.
4. Devroey, P., Liu J., Nagy, Z. et al. (1995a) Pregnancies after testicular sperm extration and intracytoplasmic sperm injection in non-obstructive azoospermia. Hum. Reprod., 10, 1457-1460.
5. Hovatta, O., Moilanen, J., von Smitten, K. and Reima, Y. (1995) Testicular needle biopsy, open biopsy, epididymal aspiration and intracytoplasmic sperm injection in obstructive azoospermia. Hum. Reprod., 10, 2595-2599.
6. Silber, S.J., van Steirteghem, A.C., Liu, J. et al. (1995) High fertilization and pregnancy rate after intracytoplasmic sperm injection with spermatozoa obtained from testicular biopsy. Hum. Reprod., 10, 148-152.
7. Hovatta, O., Moilanen, J., von Smitten, K. and Reima, I. (1995) Testicular needle biopsy, open biopsy, epididymal aspiration and intracytoplasmic sperm injection in obtructive azoospermia. Hum. Reprod., 10, 2595-2599.
8. Devroey, P., Silber, S., Nagy, Z. et al. (1995) Ongoing pregnancies and birth after intracytoplasmic sperm injection with frozen-thawed epididymal spermatozoa. Hum. Reprod., 10, 903-906.
9. Craft, I., Tsirigotis, M. (1995) Simplified recovery, preparation and cryopreservation of testicular spermatozoa. Hum. Reprod., 10, 1623-1627.
10. Romero, J., Rubio, C., Remohi, J. et al. (1996) Fertilization after intracytoplasmic sperm injection with cryopreserved testicular spermatozoa.
11. Outi Hovatta1,2, Tuija Foudila1, Rita Siegberg1, Kristine Johansson1, Karl von Smitten2 and Ilkka Reima1. Pregnancy resulting from intracytoplasmic injection of spermatozoa from a frozen-thawed testicular biopsy specimen. Hum. Reprod., 11, 2472-2473.
12. Van Steirteghm, A.C., Nagy. Z.P., Joris, H., Liu, J., Staessen, C., Smitz, J., Wisanto, A. and Devroey, P. (1993b) High fertilization and implantation rates after intracytoplasmic sperm injection. Hum. Reprod., 8, 1061-1066.
13. Casper RF, Meriano JS, Jarvl KA, Cowan L, Lucato ML. The hypoosmotic swelling test for selection of viable sperm for intracytoplasmic sperm injection in men with complete asthenozoospermia. Fertil Steril. 1996; 65:972-976.
14. Schlegel, P.N. (1996) Physiological consequences of testicular sperm extraction. Hum. Reprod., 11 (Abstr. Book 1), 74, Abstr. 159.