Resumen
El Mycobacterium tuberculosis y el complejo Mycobacterium avium intracellulare (MAI) producen infecciones oportunistas frecuentes en pacientes infectados por el VIH.
Objetivo general
Determinar la prevalencia de micobacterias en pacientes VIH positivos en tres hospitales de Santafé de Bogotá D.C.
Materiales y métodos
Estudío descriptivo transversal, en pacientes infectados por el VIH, evaluados clínicamente y estudiados por laboratorio mediante examen directo y cultivo, de diferentes muestras clínicas: sangre, orina, materia fecal, esputo, etc. Los datos obtenidos se tabularon y analizaron en EPI-INFO versión 6.03.
Resultados
Se estudiaron 286 pacientes VIH positivos, de los hospitales Simón Bolívar, San Juan de Dios y del Instituto de Seguro Social de la ciudad de Bogotá, entre el mes de Octubre del año 1.999 al mes de Febrero del año 2.000. Se tomaron 1.616 muestras para cultivo y baciloscopia.
El 5.6% de los pacientes fueron positivos para micobacterias, predominando el complejo MAI sobre el M. Tuberculosis. En 3/13 pacientes se comprobó diseminación hematógena del complejo MAI, siendo positivas 3 baciloscopias de sangre lisada y concentrada. Todos los aislamientos de M. Tuberculosis, fueron sensibles a los medicamentos antituberculosos.
En 2 pacientes se presentó infección mixta por M. Tuberculosis y complejo MAI. Las variables clínicas asociadas a la presencia de micobacterias fueron pérdida de peso, diarrea, fiebre y tos. La muerte fue 5.1 veces mayor en pacientes con micobacterias. El cultivo mostró una sensibilidad y especificidad mayor, que el examen directo.
Conclusiones
La prevalencia de micobacterias en pacientes VIH positivos en este estudio fue del 5.6%, predominando la infección por complejo MAI, a diferencia de estudios anteriores. El cultivo mostró una sensibilidad y especificidad mayor que el exámen directo, aumentando su positividad al emplear diversas fuentes de aislamiento. La muestra de sangre mostró positividad al examen directo.
Summary
Mycobacterium tuberculosis and the Mycobacterium avium intracellulace complex (MAI) are common opportunishe infections in the HIV infected patients population.
Objetive
To determine the prevalence of Mycobacterium infections in HIV positive patients in three different hospitals in the capital city of Sta Fe de Bogotá D.C.
Materials and methods
Study in HIV (+) patients were evaluated clinical and laboratory testing(AFB stains and culture). Multiple samples were obtained from blood, urine, feces, sputum, etc. Data was analized utilizing Epi – Info version 6.03.
Results
A total of 286 HIV (+) patients were studied between octuber 1999 thru february 2000. From Hospitals Simón Bolivar, San Juan de Dios and ISS In the capital of Santa Fé de Bogotá. D.C.
A total of 1616 samples were obtained for stain (AFB) and culture. 56% of patients tested positive for Mycobacteria with predominance of MAI complex over M. Tuberculosis Psedominance Haematogenous spread for the MAI complex was continued in 3/13 patients based on AFB (+) stains from concentrate lyzed blood.
All M. Tuberculosis isolates were sensitive to standard anti- TB treatment. Two patients had both MAI complex and M. Tuberculosis infection. Clinical findings associated with Mycobacteria patients included weight loss, diarrhea, fever and cough. Death was 5.1 fold greater in HIV (+) who tested positive for Mycobacteria. The sensitivity and specificity was higher for cultures than for AFB stains.
Conclusions
The prevalence of Mycobacterial infection in HIV (+) patients was 5.6%with predominance of the MAI complex infection which is different from other published studies.
Palabras claves
Mycobacterium tuberculosis, complejo Mycobacterium avium intracellulare (MAI). Tuberculosis, infección VIH
Murcia MI, Gómez JE, Alvarado F, Bustillo JG, Deivels E , Gómez B, León CI, Triana WA, Vargas EA, Rodríguez E. Prevalencia de micobacterias en pacientes VIH/SIDA positivos en Bogotá D.C. Rev Colomb Neumol 2001;13:249-261
The sensitivity and specificity was higher for cultures than for AFB stains and particularly when multiple samples were obtained blood sampling (concentrate-lyzed blood) with AFB staining was positive during haematogenous spread.
Murcia MI, Gómez JE, Alvarado F, Bustillo JG, Deivels E , Gómez B, León CI, Triana WA, Vargas EA, Rodríguez E. Prevalence of mycobacterial in HIV positive patients in Bogotá. D.C. Rev Colomb Neumol 2001;13:249-261
Introducción sobre la prevalencia de micobacterias en pacientes con VIH/SIDA
La tuberculosis es una enfermedad infecciosa crónica, que ataca al hombre de forma epidémica. En algunos países subdesarrollados continúa siendo una causa importante de morbi-mortalidad, superando a muchas otras infecciones a nivel mundial. Su eliminación será muy difícil, permanecerá hasta que se elimine la pobreza, se controle la superpoblación mundial, y se controle la epidemia por el Virus de la Inmunodeficiencia Humana VIH1.
De acuerdo a la Organización Mundial de la Salud OMS, 1/3 de la población mundial (1.800‘ 000.000) de personas están infectadas por Mycobacterium tuberculosis. Anualmente aparecen de 8‘000.000 a 10‘000.000 de casos nuevos de TBC activa y fallecen 3‘000.000 de personas a consecuencia de la enfermedad. El 95% de los casos y el 98% de los fallecimientos ocurren en países en vía de desarrollo como el nuestro2.
La tuberculosis es una enfermedad granulomatosa crónica
Ataca principalmente los pulmones, aunque puede comprometer cualquier órgano, especialmente los que tienen mayor disponibilidad de oxígeno, manifestándose con mayor frecuencia a nivel de ganglios linfáticos, riñones, menínges, huesos, genitales e intestino3.
Es producida por el Mycobacterium tuberculosis, descubierto por el médico Alemán Robert Koch en 1.882 siendo desde entonces motivo de grandes estudios. También puede ser producida aunque con menor frecuencia por otras especies de micobacterias pertenecientes también al llamado complejo tuberculosis como son Mycobacterium bovis y raramente Mycobacterium africanum.
La tuberculosis es una enfermedad muy antigua, como se ha podido demostrar en esqueletos de habitantes de Alemania de la época prehistórica 8000 a.c., que muestran una evidencia clara de la enfermedad, también por estudios hechos en momias provenientes de la cultura Egipcia que datan de 4000 años a.c., determinándose en ellas la presencia de tuberculosis ósea1.
Se cree que la tuberculosis podría haber aparecido durante el periodo neolítico, cuando aumentó la población humana.
Una evidencia más precisa fue obtenida al utilizar la técnica PCR a DNA extraído de las momias. La enfermedad fue descrita por Hipócrates como “Phithis”; Aristóteles la describió correctamente como “contagious nature”. En América la tuberculosis se presentó antes de la llegada de Cristóbal Colón4.
La epidemia actual comenzó en Inglaterra en el siglo XVI y alcanzó su máximo pico hacia 1.780 como consecuencia de la revolución industrial que trajo consigo el crecimiento de las ciudades:
Permitiendo su transmisión de persona a persona. Se diseminó rápidamente por otros países de Europa occidental, alcanzando grandes proporciones a principios del siglo XIX. En el este de Europa el máximo se obtuvo entre 1870 y 1888. En Norteamérica y Suramérica la onda epidémica tuvo su máximo en el año 1.900, en los países de Asia y Africa la onda aún no ha alcanzado su máximo. Se ha visto que la epidemia disminuye en una zona geográfica específica, mientras que permanece, aumenta o alcanza su máximo en otras regiones5.
La industrialización y, la superpoblación de las ciudades pueden causar una epidemia de tuberculosis al reunir gran número de personas susceptibles, promoviéndose la transmisión de M. Tuberculosis de enfermos a sanos. Es la única enfermedad declarada como urgencia mundial por la OMS5.
La tuberculosis ha aumentado a nivel mundial por varias razones a saber: aumento de la pobreza, existencia de programas de control deficientes (inadecuada detección de casos y fallas en el tratamiento), cambios demográficos que han tenido consigo aumentos de la población mundial y cambios en la distribución por edades, además por el impacto de la pandemia por el Virus de la Inmunodeficiencia Humana VIH, la cual ha incrementado la incidencia y prevalencia de tuberculosis y micobacteriosis5.
La superposición de poblaciones infectadas tanto por VIH como por M. Tuberculosis:
Favorece la interacción entre ambos patógenos. El riesgo de progresión a tuberculosis activa de personas infectadas por ambos patógenos es mucho más alta (en promedio 8% por año), que el de los infectados únicamente con M. Tuberculosis (0.2% por año).
Las personas VIH positivas que contraen una primoinfección tuberculosa se encuentran en un riesgo diez veces mayor de padecer tuberculosis primaria diseminada6,7.
Se sabe que el riesgo de adquirir una tuberculosis activa entre personas infectadas por el VIH con prueba de tuberculina positiva es muy alto, se estima en un 8% anual8.
Ha observado una mayor tendencia a la transmisión nosocomial de la enfermedad9. Se ha encontrado que la infección VIH y las formas multirresistentes de Mycobacterium tuberculosis actúan sinérgicamente facilitando la adquisición de la enfermedad intrahospitalariamente10,11.
En Colombia en 1998, se informaron 9.155 casos (22.5 /100.000 habitantes), en 1999 el número de casos informados fue de 6.248 casos, (14.8/100.000 habitantes), lo cual no significa una disminución real de la incidencia, sino que las nuevas políticas de salud impiden la búsqueda activa de nuevos casos12.
En cuanto a resistencia primaria en el año 1987 se encontró que era del 11.4%, en 1992 el 12.4% y en el año 1996 del 23.1%13.
Micobacteerias no tuberculosas VIH/Sida
Antes de que se presentara la epidemia de SIDA, solamente estaban informados en la literatura 78 casos de MICOBACTERIOSIS DISEMINADAS, según la revisión hecha por Wolinsky en 1.97914.
La diseminación del complejo “MAC” Mycobacterium avium complex sólo se había informado en 37 casos15, sin embargo MAC se convirtió en infección oportunista frecuente en pacientes con SIDA16, 17, aislándose entre 17% -50% de los pacientes con SIDA y en un 40% – 50% en muestras de autopsia: principalmente órganos del sistema retículo endotelial, médula ósea, nódulos linfáticos, pulmón, hígado, bazo, intestino, piel, riñón y cerebro18,19,20.
La infección por MAC diseminada es característica de personas inmunocomprometidas y casi exclusiva de pacientes con SIDA.
Estos pacientes pueden presentar bacteremia persistente durante el curso de su enfermedad inmunosupresora, aislándose de muestras de sangre en un 16.9% de los pacientes17,18. También está asociado con enfermedad sistémica diseminada siendo positivos en alta proporción los hemocultivos superando otros procedimientos diagnósticos21,22,23.
El aislamiento de MAC a partir de sangre confirma la presencia de infección17. La bacteremia causa severa morbilidad y aumenta la mortalidad en estos pacientes23.
Los microorganismos pertenecientes al complejo MAC:
Están ampliamente distribuidos en el ambiente, y la exposición a dichos microorganismos es común.
Aunque muchas personas son colonizadas de manera temporal por el MAC, la enfermedad por éste es rara. El MAC se adquiere del ambiente y no por transmisión persona-persona.
No se ha definido un reservorio ambiental, pero la enfermedad puede ser adquirida por inhalación o ingestión de los microorganismos, vías que determinan la aparición de enfermedad respiratoria o gastro-intestinal respectivamente, siendo estas entidades previas a la diseminación17.
Se desconoce si una persona previamente infectada puede mantener microorganismo viables al igual que sucede con M. Tuberculosis.
En los pacientes con SIDA hay evidencias que indican una adquisición reciente de la infección en los casos de MAC diseminado.
Estudios recientes muestran que en algunos casos la colonización del tracto gastrointestinal por Mycobacterium avium precede de semanas a meses a su aislamiento en sangre y tejidos. Esta aseveración se ha hecho con base en estudios histopatológicos intestinales que demuestran la presencia de (baar) en la mucosa y la submucosa20.
Como algunos organismos entéricos pueden ser transmitidos mediante relaciones homosexuales, no se descarta este mecanismo en la transmisión de micobacterias no tuberculosas20,24.
Los factores de virulencia del MAC no se han determinado por completo:
Pero se ha demostrado una relación entre la inmunodeficiencia del huésped con la capacidad de desarrollar factores de virulencia, esto se evidencia por la alta capacidad de crecimiento de cepas de MAC aisladas de pacientes con SIDA con respecto a las aisladas en pacientes sanos17.
La entrada del MAC al torrente sanquíneo posiblemente es la responsable de la fiebre y la sudoración nocturna, principales síntomas de la infección diseminada16,17. El complejo MAC también se ha aislado de materia fecal en casos de diarrea en pacientes VIH positivos25,26.
Se ha identificado como causa común de enfermedad diarreica crónica en pacientes con SIDA, junto con, Criptosporidium y Microsporidia27.
Es más común en pacientes homosexuales o bisexuales presentándose en un 80% de éstos individuos, comparado con los heterosexuales en los que se presenta en un 58% de los casos28.
Otras especies de micobacterias no tuberculosas (MNT) también se han encontrado asociadas aunque con menor frecuencia que el complejo MAC en pacientes con SIDA:
M. Kansasii, puede producir micobacteriosis diseminada, infección de tracto respiratorio, sinusitis y pericoronitis, también se han encontrado implicadas M. fortuitum, M. scrofulaceum, M. chelonae, M. gordonae, M. xenopi, M. asiaticum, M. flavescens, M. malmoense, M. szulgai, M. haemophilum, M. simiae, M. genavense y M. celatum29-33.
Aunque se ha observado que a medida que se incrementan los casos de SIDA se aumentan los casos de tuberculosis y micobacteriosis, no se ha establecido en el país el alcance real ni la magnitud de esta asociación, lo cual ha impedido comprender de manera adecuada el problema epidemiológico que acompaña esta coinfección y controlar este problema de manera adecuada.
El conocimiento real de lo que ocurre en nuestro medio permitirá el establecimiento a nivel nacional de protocolos de manejo claros, que permitan el diagnóstico y tratamiento precoz de la asociación micobacterias-VIH/SIDA, mejorando la calidad y el tiempo de vida de estos pacientes.
Objetivos generales sobre el estudio de prevalencia de las micobacterias en pacientes con VIH/SIDA
- Establecer la prevalencia de micobacterias en pacientes VIH/SIDA hospitalizados y no hospitalizados positivos en Santafé de Bogotá.
- Identificar el patrón de presentación de la infección micobacteriana en pacientes VIH/SIDA positivos.
- Evaluar la sensibilidad y especificidad de la baciloscopia frente al cultivo, en el diagnóstico de las micobacterias en pacientes VIH/SIDA positivos, en muestras de esputo, sangre, líquido cefalorraquídeo, materia fecal, orina, etc.
- Identificar la susceptibilidad del Mycobacterium tuberculosis a los medicamentos antitubercu-losos y establecer la frecuencia de cepas multirresistentes.
Objetivos específicos
- Estimar la proporción de pacientes VIH/SIDA positivos que están coinfectados con Mycobacterium tuberculosis y con micobacterias no tuberculosas (MNT).
- Identificar los antecedentes de tuberculosis en los pacientes VIH/SIDA positivos.
- Tomar las muestras de sangre, materia fecal y orina, esputo, líquido cefalorraquídeo, etc, siempre que sea posible, y practicarles baciloscopia y cultivo.
- Comparar los resultados obtenidos mediante la baciloscopia y el cultivo con el fin de establecer la sensibilidad y especificidad, y el tipo de muestra que ofrece mayor rendimiento en la recuperación de micobacterias.
- Valorar la sensibilidad de las cepas de Mycobacterium tuberculosis ante diversos medicamentos antituberculosos, por medio de la técnica simplificada de las proporciones múltiples.
Materiales y métodos
Tipo y diseño de estudio
Descriptivo de corte transversal, con un componente de diagnóstico de laboratorio y un componente de análisis epidemiológico.
Prueba de referencia: cultivo para el diagnóstico de las micobacterias.
Población de estudio
Se tomó como población de estudio una cohorte de sujetos VIH/SIDA positivos, de consulta externa u hospitalizados de los centros asistenciales: Hospital Simón Bolívar (HSB).
Instituto de Seguro Social (ISS) (Clínica San Pedro Claver y Consulta externa Programa VIH/SIDA) y del Hospital San Juan de Dios (HSJD), de la cuidad de Bogotá, analizados desde el mes de Octubre del año 1.999 al mes de Febrero del año 2.000, siendo seguidos hasta el mes de Junio del mismo año, para conocer si habían muerto o no.
Criterios de inclusión
Ingresaron todos aquellos pacientes VIH/SIDA positivos, diagnosticados por 2 pruebas de Elisa positivas para anticuerpos contra el Virus de la Inmunodeficiencia Humana (VIH), confirmados por prueba de western blot. No importaba el estadío de infección VIH en el que se encontraban. Se recolectaron 286 pacientes.
Aspectos éticos
Teniendo en cuenta que se recolectó material biológico de los pacientes participantes en el estudio, se les solicitó consentimiento informado por escrito previa explicación detallada de los objetivos del estudio y del procedimiento para la toma de las diferentes muestras. (Anexo 1).
Recolección de la información
Una vez el paciente aceptaba participar en el estudio y firmaba el consentimiento, se realizaba una parte de la encuesta diseñada para el estudio, la otra parte se completaba a partir de la revisión de la historia clínica. (Anexo 2).
Se procedía a la toma de exámenes de laboratorio: 2 hemocultivos, 2 urocultivos, 2 coprocultivos, adicionalmente a los pacientes sintomáticos respiratorios se les tomaron 2 esputos. Además de acuerdo a la sintomato-logía también se tomaron líquidos como: líquido ascítico y líquido cefalorraquídeo (LCR).
Procedimientos de laboratorio
Todas las muestras fueron procesadas en cabina de flujo laminar tipo llb y concentradas por centrifugación a 5.800xg en centrífuga refrigerada Eppendorf.
Examen directo(baciloscopia)
A todas las muestras se les realizó examen directo (coloración de Ziehl Neelsen) después de su decontaminación (si era necesario) y de su concentración.
Procesamiento de muestras
- Las sangres fueron centrifugadas y su capa de blancos lisada con desoxicolato de sodio al 0.4% de acuerdo a una metodología estandarizada previamente34.
- La materia fecal fue procesado utilizando como decontaminante hidróxido de sodio de acuerdo a una metodología estandarizada previamente34.
- Las muestras de orina, esputo y líquidos corporales fueron procesadas de acuerdo al manual de procedimientos del CDC empleados en el laboratorio de micobacterias del Instituto Nacional de Salud35.
Cultivos
Todas las muestras previa deconta-minación (si era necesario) y concentración fueron cultivadas en 2 tubos con medio bifásico cuya fase sólida era Ogawa Kudoh con citrato de hierro (OKCFE) y su fase líquida Sautón Twen albúmina modificado (MSTA) y en 2 tubos de Stonebrink (STG). Las lecturas de los cultivos se realizaron a los 6 días, 2 semanas, 4 semanas, 6 semanas, 8 semanas, 12 semanas y 16 semanas.
Identificación de cultivos
Los cultivos positivos para bacilos ácido alcohol resistentes fueron identificados de acuerdo al manual de procedimientos de identificación del CDC. Utilizado en el Laboratorio de micobacterias del INS36.
Pruebas de resistencia
A todos los aislamientos identificados como M. tuberculosis se les practicó prueba de resistencia utilizando la técnica simplificada de las proporciones múltiples de Caneti, Rist y Groset, estudiando las siguientes drogas: estreptomicina (S), isoniazida (H), tioacetazona (Tb), etambutol (E) y rifampicina ( R )37.
Análisis
Se hizo una base de datos en EPIINFO 6.03 en la cual se incluyó la información recolectada en la encuesta de cada paciente: número de historia clínica, edad, fecha de primer y segundo ELISA, Western Blot, niveles de CD4, carga viral, clasificación CDC, número y fecha de ingreso a estudio, síntomas (fiebre, pérdida de peso, sudoración nocturna, disnea, hemoptisis, tos, cefalea, convulsiones, diplopía, visión borrosa, disestesias, cambios de conducta o de nivel de conciencia, ataxia, náuseas, vómito, diarrea mayor a un mes, adenopatías extrainguinales), Pneumocistosis, Criptococosis, Encefalitis por Toxoplasma, antecedentes de diarrea crónica, tuberculosis previa, tratamiento antituberculoso previo, ETS previa (Sífilis, Hepatitis B), tratamiento antirretroviral previo y muerte.
Además se incluyeron los resultados obtenidos en el estudio en cuanto al crecimiento de micobacterias. Se calcularon las distribuciones de frecuencias para cada una de las variables de Interés y en todos los casos se procedió a calcular la razón de prevalencia (RP), con límites de confianza del 95% con el fin de medir la asociación entre micobacterias y las variables independientes estudiadas, utilizando el software de Epiinfo 6.03.
Resultados sobre la prevalencia de micobacterias en pacientes con VIH/SIDA
Población de estudio
La población de estudio estuvo conformada por 286 pacientes VIH/SIDA positivos, de los cuales 10 eran del Hospital San Juan de Dios (HSJD); 139 del Hospital Simón Bolívar (HSB) y 137 del Institu
to de Seguro Social (ISS). El 20.3%58 estaban hospitalizados y el 79.7% (228), eran de consulta externa.
El 87.8% (250) eran hombres y el 12.2%35 eran mujeres, la relación hombre mujer fue 7:1. La edad de estos pacientes osciló entre 3 y 78 años con una media de 35 años (Tabla No 1).
| GENERO | N | % | %Acumulado |
| Masculino | 251 | 87.8 | 87.8 |
| Femenino | 35 | 12.2 | 12.2 |
| EDAD | |||
| 0 – 15 | 1 | 0.35 | 0.35 |
| 16 – 25 | 38 | 13.3 | 13.65 |
| 26 – 45 | 211 | 73.8 | 87.45 |
| 46 – 65 | 35 | 12.2 | 99.65 |
| 66 – 78 | 1 | 1.35 | 100 |
Cuadro No 1. Distribución sgún la edad y género de pacientes VIH/SIDA positivo, HSJD, HSB e ISS. Bogotá D.C. Octubre/1999 – Febrero/2000
La preferencia sexual del 94.3% (269) de los pacientes fue la siguiente: de 251 hombres el 38%90 eran homosexuales (HSH), el 36% (86) bisexuales (HSHSM) y el 26%90 heterosexuales (HSM). De 35 mujeres: el 90.6% 90 eran heterosexuales (MSH) y el 9.4%3 eran bisexuales (MSHSM).
El estadio de infección VIH más frecuente en los pacientes estudiados según la clasificación CDC de 1.993 fue el estadio C (Figura 1).
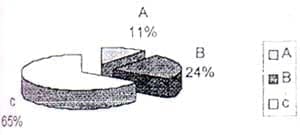
Figura No 1. Distribución de pacientes por estado clínico de infcción VIH
La carga viral de los pacientes osciló entre 50 copias a 750.000 copias/mm3. Un 68.5% de la población tomaba antirretrovirales al momento del ingreso al estudio y un 31.5% no.
Las variables clínicas (síntomas) más frecuentes en los pacientes, al momento del ingreso al estudio fueron: cefalea (48%), pérdida de peso (43%) y alteración de los niveles de conciencia 38%. (Figura 2). Un 29% de los pacientes eran sintomáticos respiratorios.

Figura No 2. Frecuencia de variables clínicas en la población estudiada
Entre las enfermedades previas al estudio predominaron la Hepatitis B y la sífilis, entidades que se presentaron en el 27% de la población, la neumonía por Pneumocystis carinii en el 20.4% y la tuberculosis en el 12.6% (Figura 3).

Figura No 3. Distribución de pacientes de acuerdo a antecedentes clínicos.
Con respecto a la administración de medicamentos antitubercu-losos antes del estudio, se encontró que el 12% de los pacientes sí habían recibido este tipo de tratamiento.
Asociación VIH/SIDA – Micobacterias
La prevalencia de micobacterias en pacientes VIH/SIDA positivos en este estudio fue del 5.6% (16/286) (Tabla 2). Un 1.4% (4/286) correspondió a tuberculosis, un 4.5% (13/286) a Complejo Mycobacterium avium intracellulare (MAI) y un 0.35% (1/286) a una micobacteria no tuberculosa (MNT) no identificada, debido a que no creció en los medios de cultivo utilizados. La distribución por especie de micobacterias se observa en la Figura 4.
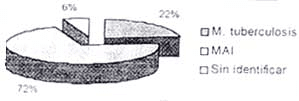
En el 12.5% (2/16) de los pacientes se aislaron simultáneamente Mycobacterium tuberculosis y Mycobacterium avium intracellulare.
| INSTITUCIÓN | PREVALENCIA % | TOTAL DE AISLAMIENTO |
| H. SIMÓN BOLIVAR | 8/139 (5.8) | 22 MAI |
| INSTITUTO SEGURO SOCIAL | 7/137 (5.1%) | 10 M. TB, 6 MAI |
| H. SAN JUAN DE DIOS | 1/10 (10%) | 5 M. Tuberculosis |
| TOTAL | 16/286 (5.6%) | 15 M. tuberculosis + 28 MAI |
Cuadro No 2. Prevalencia de micobacterias en pacientes IVH/SIDA positivos. HSJD, HSB e ISS. Bogotá D.C. octubre/1.999 – febrero/2.000
Se destaca la presencia del Complejo MAI, superando 3 veces en estos pacientes a la tuberculosis, es decir por cada paciente con M. tuberculosis, habían 3 pacientes con complejo MAI. El 87.5%14 de los pacientes con micobacterias eran hombres y el 12.5%2 mujeres.
Entre los pacientes que se encontraban en estadio A de infección VIH no se aisló ninguna micobacteria. En los pacientes en estadio B se aisló un 4,4% de micobacterias y en estadio C un 6.9% de micobacterias. Entre los pacientes que tenían un conteo de linfocitos CD4 mayores a 500/mm3 no se aisló ninguna micobacteria, en los que tenían de 200 a 499 CD4/mm3 se aisló un 7.2% de micobacterias, en los que tenían menos de 200 CD4/mm3 un 6.3%, un 3.7% de los pacientes no tenían el recuento de CD4.
Asociación tuberculosis -VIH/SIDA
La presencia de tuberculosis se diagnosticó en el 1.4% de la población de estudio (4/286), 2 pacientes tenían tuberculosis pulmonar y 2 extrapulmonar. Una paciente era mujer y 3 hombres. El M. tuberculosis se aisló a partir de diferentes muestras clínicas (Cuadro 3), siendo la sangre negativa en todos los pacientes tanto para el examen directo como para el cultivo.
MÉTODOS DIAGNÓSTICOS |
||||||
EXAMEN DIRECTO |
CULTIVO |
|||||
CASO |
TBC |
MUESTRA |
POSITIVO |
NEGATIVO |
POSITIVO |
NEGATIVO |
| 1 | Miliar | 2 Esputos | 2 | 0 | 2 | 0 |
| 2 Orinas | 0 | 2 | 2 | 0 | ||
| 1 L. ascítico | 1 | 0 | 1 | 0 | ||
| 2 Sangres | 0 | 2 | 0 | 2 | ||
| 1 M. Fecal | 0 | 1 | 0 | 1 | ||
| 2* | Pulmonar | 2 Esputos | 2 | 0 | 2 | 0 |
| 2 M. Fecales | 2 | 0 | 2 | 0 | ||
| 2 Sangres | 0 | 2 | 0 | 2 | ||
| 2 Orinas | 0 | 2 | 0 | 2 | ||
| 3** | Pulmonar | 2 Esputos | 0 | 2 | 2 | 0 |
| 2 M. Fecales | 1 | 1 | 2 | 0 | ||
| 2 Sangres | 0 | 2 | 0 | 2 | ||
| 2 Orinas | 0 | 2 | 0 | 2 | ||
| 4* | Gastroin | 2 M. Fecales | 2 | 0 | 2 | 0 |
| 2 Sangres | 0 | 2 | 0 | 2 | ||
| 2 Orinas | 0 | 2 | 0 | 2 | ||
| TOTAL | 30 Muestras | 10 | 20 | 15 | 15 | |
Cuadro No 3. localización y diagnóstico de la tuberculosis en pacientes de VIH/SIDA positivos. HSJD, HSB e ISS. Bogotá D.C. Octubre de 1.999 – Febrero/2.000
En esta población el cultivo fue el método diagnóstico más sensible para el diagnóstico de la tuberculosis, siendo positivos 15 cultivos, frente a 10 baciloscopias.
Se observó además pérdida de especificidad del examen directo, ya que observamos que a los pacientes No. 2 y 4, que presentaron baciloscopias positivas de esputo y de materia fecal, se les aislaron en las mismas muestras simultáneamente: M. tuberculosis y Complejo MAI. Lo cual ratifica el hecho de que el cultivo es el método microbiológico de elección, para el diagnóstico de las micobacterias en este tipo de pacientes.
El hecho de que la mitad de los pacientes tuvieran una tuberculosis extrapulmonar indica la necesidad de diagnosticarla, para lo cual es indispensable la utilización de diferentes muestras clínicas tales como esputo, orina, materia fecal, líquidos corporales, etc.
Los pacientes tuberculosos tuvieron un recuento de CD4 que osciló entre 145 y 282 células/mm3, (promedio 188 células/mm3). La carga viral en estos pacientes osciló entre 50 y 265.228 copias/mm3, (promedio 69.018 copias/mm3).
Los 15 aislamientos de M. tuberculosis fueron sensibles a los medicamentos antituberculosos probados: estreptomicina (S), isoniazida (H), tioacetazona (Tb), etambutol (E) y rifampicina (R).
Dentro de las micobacterias no tuberculosas (MNT), la única aislada fue el complejo Mycobacte-rium avium intracellulare en 13/286 (4.6%) pacientes.
En 3/13 (23%) pacientes se comprobó la diseminación hematógena del complejo MAI (Cuadro 4), ellos presentaron conteos de linfocitos CD4 que osciló entre 19 y 60 células/mm3, (promedio 44 células/mm3), de estos pacientes solo uno tenía recuento de carga viral cuyo resultado fue 110.399 copias/mm3.
MÉTODOS DIAGNÓSTICOS |
|||||
|
|
|
EXAMEN DIRECTO |
CULTIVO |
||
CASO |
MUESTRA |
POSITIVO |
NEGATIVO |
POSITIVO |
NEGATIVO |
| 1 | 2 Sangres | 1 | 1 | 2 | 0 |
| 1 Orina | 0 | 1 | 0 | 1 | |
| 2 | 2 Sangres | 1 | 1 | 2 | 0 |
| 2 Orinas | 0 | 2 | 0 | 2 | |
| 3* | Y 2 Sangres | 0 | 1 | 2 | 0 |
| 1 Orinas | 0 | 1 | 0 | 1 | |
| 3** | 2 Sangres | 1 | 2 | 2 | 0 |
| 1 Orinas | 1 | 1 | 2 | 0 | |
| 2 M. Fecales | 2 | 0 | 2 | 0 | |
| TOTAL | 16 | 6 | 10 | 12 | 4 |
Cuadro No 4. Diagnóstico de diseminación de Complejo (MAI) en pacientes de VIH/SIDA Positivos.HSJD, HSB, ISS. Bogotá D.C. octubre de 1.999 – Febrero/2.000
El método más sensible para la detección de diseminación del Complejo MAI fue el Hemocultivo, siendo positivos 8. Vale la pena destacar la positividad de 3/8 baciloscopias de capa de blancos lisada y concentrada por centrifugación a 5.800xg, lo cual permitió diagnosticar la mico-bacteremia inmediatamente.
Sin embargo ratificamos que el examen directo en estos pacientes pierde especificidad, por la presencia en ellos de una alta proporción de Complejo MAI. La presencia de un examen directo positivo en pacientes VIH/SIDA debe ser considerado cuidadosamente por el Clínico ya que no indica siempre la presencia de M. tuberculosis, como si lo indica en otro tipo de pacientes.
En el caso del paciente 3:
Se observó la importancia del seguimiento de los pacientes VIH/SIDA positivos en búsqueda de micobacterias, ya que en la primera oportunidad presentaba una bacteremia sub-clínica, aislándose la micobacteria de las muestras de sangre, mientras que en la segunda oportunidad ya se encontró la micobacteria en sangre, orina y materia fecal. En ninguno de estos pacientes se sospechaba la micobacteriosis. Los 3 pacientes murieron.
El complejo Mycobacterium avium intracellulare fue aislado también de muestras diferentes a sangre (Cuadro 5). Se hicieron 7 aislamientos de muestras de orina, 5 de muestras de esputos y 5 de materias fecales.
Siendo superior también la sensibilidad y la especificidad del cultivo, 16 positivos, frente a 10 baciloscopias. Observamos la importancia de la búsqueda de micobacterias en estos pacientes a partir de diferentes muestras clínicas, ya que se incrementa la posibilidad de su aislamiento.
|
|
MÉTODOS DIAGNÓSTICOS |
||||
|
|
EXAMEN DIRECTO |
CULTIVO |
|||
CASO |
MUESTRA |
POSITIVO |
NEGATIVO |
POSITIVO |
NEGATIVO |
| 1 | 2 M. Fecal | 0 | 2 | 1 | 1 |
| 2 Sangres | 0 | 2 | 0 | 2 | |
| 2 Orinas | 0 | 2 | 0 | 2 | |
| 2 Esputos | 0 | 2 | 0 | 2 | |
| 2 | 2 M. Fecal | 0 | 2 | 1 | 1 |
| 2 Sangres | 0 | 2 | 0 | 2 | |
| 2 Orinas | 0 | 2 | 0 | 2 | |
| 3* | 2 M. Fecales | 2 | 0 | 2 | 0 |
| 2 Sangres | 0 | 2 | 0 | 2 | |
| 2 Orinas | 0 | 2 | 0 | 2 | |
| 4 | 2 Orinas | 0 | 2 | 2 | 0 |
| 2 Sangres | 0 | 2 | 0 | 2 | |
| 2 M. Fecales | 0 | 2 | 0 | 2 | |
| 5 | 2 Orinas | 0 | 2 | 2 | 0 |
| 2 Sangres | 0 | 2 | 0 | 2 | |
| 2 M. Fecales | 0 | 2 | 0 | 2 | |
| 6 | 2 Orinas | 0 | 2 | 1 | 1 |
| 2 Sangres | 0 | 2 | 0 | 2 | |
| 2 M. Fecals | 0 | 2 | 0 | 2 | |
| 7 | 2 Orinas | 0 | 2 | 2 | 0 |
| 2 Sangres | 0 | 2 | 0 | 2 | |
| 2 M. Fecales | 0 | 2 | 0 | 2 | |
| 8* | 2 Esputos | 2 | 0 | 2 | 0 |
| 2 Sangres | 0 | 2 | 0 | 2 | |
| 2 Orinas | 0 | 2 | 0 | 2 | |
| 9** | 2 Esputos | 2 | 0 | 1 | 1 |
| 2 Sangres | 0 | 2 | 0 | 2 | |
| 2 M. Fecales | 2 | 0 | 0 | 2 | |
| 10*** | 2 M. Fecales | 2 | 0 | 2 | 0 |
| 2 Sangres | 0 | 2 | 0 | 2 | |
| 2 Orinas | 0 | 2 | 0 | 2 | |
| TOTAL | 62 | 10 | 52 | 16 | 46 |
* Pacientes de seguimiento, positivos en la segunda oportunidad, padecieron TBC previa, Murieron.
** Pacientes que se les aisló simultáneamente M. tuberculosis en esputo.
*** Pacientes que se les aisló simultáneamente M. tuberculosis en M. Fecal.
Cuadro No 5. Aislamiento de Complejo MAI de muestras diferentes de sangre en pacientes VIH/SIDA positivos. HSJD, HSB, ISS. Bogotá D.C. Octubre de 1.999 a Febrero/2.000
El seguimiento de los pacientes también es importante, ya que en 2 de los 10 casos, se pudo aislar la micobacteria en una segunda oportunidad, con un mes de diferencia.
El hecho de que los 2 pacientes hubieran padecido una tuberculosis previa, indica la necesidad en nuestro medio, de vigilar clínica y microbiológicamente dichos pacientes, para poder detectar a tiempo una reactivación, una reinfección o la presencia, como en este caso, de una micobacteria no tuberculosa.
Las MNT aparecen cuando es mayor la inmunosupresión del paciente; son resistentes a los medicamentos antituberculosos, por lo que su tratamiento es diferente del aplicado para M. tuberculosis.
El hecho de encontrar 10 baciloscopias positivas, de las cuales solo 2 pertenecientes al caso 9, correspondían a M. tuberculosis, como pudo demostrarse después del cultivo, indica nuevamente la pérdida de especificidad de esta técnica.
Como sucedió también con el caso 10 en el que las 2 baciloscopias de materias fecales fueron positivas, pero los cultivos demostraron simultáneamente la presencia de M. tuberculosis y Complejo MAI.
Por las razones mencionadas el diagnóstico de micobacterias en esta población debe hacerse obligatoriamente con cultivo. En los pacientes con Complejo MAI en muestras diferentes a sangre, el recuento de CD4 osciló entre 50 y 351 células/mm3, (promedio 176 células/mm3), no se conoció su carga viral.
Con respecto a las variables clínicas presentes al momento de la consulta de ingreso al estudio, se encontró una probabilidad 10.6 veces mayor de aislar micobacterias en los pacientes que refirieron pérdida de peso, 4.5 veces mayor en los pacientes con diarrea; 2.7 veces mayor en los pacientes con fiebre; 2.5 veces mayor en los pacientes con tos; 2.3 veces mayor en los pacientes con disnea; los pacientes que presentaron TBC previa tuvieron 2.4 veces mayor probabilidad de que se les aislara una micobacteria. En el caso de la muerte se obtuvo una probabilidad 5.10 veces mayor en los pacientes con micobacterias, que en los que no las tenían (Cuadro 6).
| VARIABLE | RP | IC 95% | P |
| Pérdida de peso* | 10.5 | 2.19 – 69.22 | 0.0001 |
| Diarrea* | 4.5 | 1.44 – 14.23 | 0.004 |
| Fiebre* | 2.7 | 0.88 – 8,46 | 0.047 |
| Tos | 2.6 | 0.84 – 0.83 | 0.056 |
| TBC previa | 2.48 | 0.62 – 9.09 | 0.12 |
| Adenopatías | 1.63 | 0.47 – 5.38 | 0.27 |
| Vómito | 1.59 | 0.46 – 5.27 | 0.28 |
| Diplopia | 1.43 | 0.0 – 6.81 | 0.47 |
| Nauseas | 1.18 | 0.36 – 3.71 | 0.47 |
| Sudoración | 1.16 | 0.34 – 3.65 | 0.48 |
Cuadro No 6. Frecuencia de variables clínicas y muerte en la población con micobacterias en paciente en pacintes VIH/SIDA positivos. HSJD, HSB, ISS Bogotá D.C. Octubre de 1.999 – Febrero/2.000
En el análisis univariado, las variables que fueron estadísticamente significativas en la población con micobacterias, fueron la pérdida de peso, la diarrea, la fiebre y el hecho de morir.
La relación hombre – mujer en este estudio fue 7:1, esta relación no estuvo afectada por ningún sesgo de selección puesto que no hubo negativa de los pacientes que asistieron a la consulta o que estaban hospitalizados de participar en el estudio.
Esta relación es menor a la encontrada en un estudio anterior realizado en el Hospital San Juan de Dios en el cual la relación hombre – mujer fue 12:138, lo que demuestra que cada día aumentan los casos de infección VIH en mujeres, debido probablemente a un cambio en el patrón de comportamiento sexual de la población, hecho que se pue de afirmar debido al aumento notorio en el género masculino de pacientes bisexuales y a la disminución de pacientes heterosexuales.
Este fenómeno obliga a una revisión seria de las políticas de prevención de la infección VIH, que deben enrutar sus esfuerzos a todos los grupos de riesgo.
Con respecto a la edad de la población estudiada, vale la pena destacar la presencia de 67 pacientes con rango de edad entre 41 – 78 años (23.4%), demostrando que el ataque del VIH se desplaza a grupos de mayor edad.
El hecho de encontrar el 65% de los pacientes en estadio C de infección VIH:
Indica que en nuestro medio los pacientes acuden a los organismos de salud en estadíos avanzados de la enfermedad o que no se está sospechando la infección VIH.
En este estudio un alto porcentaje de la población tomaba tratamiento antirretroviral a diferencia de los estudios anteriores, en los cuales aún no se aplicaba este tipo de medicación.
Sin embargo un 31.5% de la población no lo hacía, debido a falta de recursos que impiden a los pacientes tener acceso a esta terapia, o a las Instituciones de salud que no tienen disponibilidad de los medicamentos, o a que los pacientes por efectos secundarios los suspenden voluntariamente.
El hecho de haber encontrado un 12.6% de pacientes con tuberculosis previa al estudio corrobora el hecho de que la tuberculosis es un fuerte predictor de la infección por VIH, precediendo a otras infecciones oportunistas y en algunos casos al diagnóstico de la infección VIH39.
Debido al estadío en que se encontraba la mayor parte de la población los síntomas que predominaron fueron la pérdida de peso:
La cefalea y la alteración de los niveles de conciencia, al igual que la Hepatitis B, la Sífilis y la pneumocistosis, como enfermedades previas.
La prevalencia de micobacterias en este estudio fue 5.6%, menor a la encontrada en dos estudios anteriores, uno realizado en Cali en 1.992 que encontró un 34.8% y uno en Bogotá en 1.995 que encontró un 16.3%38,40.
Esta disminución obedece a la implementación de los tratamientos antirretrovirales, que al controlar la carga viral mejoran el estatus inmunológico de los pacientes, sin embargo, no se encontró diferencia estadísti-camente significativa entre los que tomaban dichos medicamentos y los que no lo hacían.
Llama la atención la proporción presentada entre M. Tuberculosis y MNT siendo en este estudio 1:3, lo cual indica que en nuestro medio por cada paciente que se diagnostique con tuberculosis hay 3 pacientes con MNT, lo cual difiere del estudio anterior hecho en Bogotá que mostró una relación 1:1.
El hecho de haber aislado micobacterias en pacientes en estadíos B y C de infección VIH, con CD4 por debajo de 500/mm3, indica que en nuestro medio se deben establecer protocolos de manejo que implementen la búsqueda activa de micobacterias en pacientes VIH/SIDA positivos, cuando cumplan con estas características.
La prevalencia de tuberculosis encontrada 1.4%, fue menor a la informada en estudios anteriores:
En Bogotá 8%38, en Cali 6.5%40. Menor a la informada en un estudio realizado en Medellín en el Hospital San Vicente de Paul de enero de 1998 a abril del 2000, que encontró un 24.5%, debido a que a esta Institución solo llegan aquellos pacientes en estado crítico41.
Aunque no se conoce el dato de prevalencia de tuberculosis en Santafé de Bogotá, la prevalencia encontrada debe ser mayor a la de la población general:
Con relación al diagnóstico de las micobacterias se encontró que el método que ofrece mayor sensibilidad y especificidad es el cultivo, el cual debe ser utilizado de rutina en esta población, permitiendo en un futuro administrar tratamientos adecuados para tuberculosis y micobacteriosis, impidiendo su diseminación, disminuyendo así la morbi-mortalidad debida a micobacterias.
Importante el hallazgo de coinfección por M. tuberculosis y Complejo MAI, esta asociación concuerda con los resultados del estudio hecho en el HSJD, indica que en nuestro medio la presencia de una tuberculosis no excluye la posibilidad de encontrar una MNT, lo cual alerta a los Programas de tuberculosis y VIH/SIDA para que establezcan protocolos y conductas de manejo precisos, que conlleven a diagnósticos y tratamientos certeros, que permitan disminuir en nuestro medio la morbi-mortalidad debida a la asociación VIH/SIDA-micobacterias.
La presencia de tuberculosis extrapulmonar en la mitad de los pacientes:
Indica la necesidad de buscar el Mycobacterium tuberculosis en muestras diferentes a esputo. Hecho que está de acuerdo con un estudio realizado en España y publicado en el año 2.00042.
En los pacientes tuberculosos no se encontró ninguna asociación con la carga viral, los niveles de CD4 tuvieron un promedio de 188 células/mm3, mayor al presentado en la población con MNT, lo cual coincide con un estudio Alemán realizado en el año 1999, que indica que los pacientes con tuberculosis están moderadamente inmunosupri-midos y no hay una relación clara con la carga viral43.
El hecho de que todos los aislamientos de M. tuberculosis fueran sensibles a los medicamentos antituberculosos, no significa que no circulen en nuestro medio cepas multirresistentes. Esto probablemente se debe al escaso número de pacientes tuberculosos estudiados 4; comparado con el estudio anterior hecho en Bogotá, que mostró multirresistencia en 2/6 pacientes38.
La prevalencia de MNT en la población estudiada fue menor que la encontrada en los estudios mencionados38,40.
La tendencia observada coincide con un estudio de seguimiento realizado en Alemania entre los años 1994 y 1998 en el que la prevalencia de MNT ha disminuído gradualmente en correlación con la aplicación creciente del tratamiento antirretroviral43.
Sin embargo preocupa en nuestro medio lo que pueda suceder en un futuro próximo, respecto a la asociación micobacterias VIH/SIDA, debido a la resistencia que puedan desarrollar los pacientes a los antirretrovirales, ya que los tratamientos son interrumpidos voluntaria o involuntariamente.
Debido a la detección de micobacteriosis diseminada en 23% de pacientes con complejo MAI, se deben utilizar de rutina hemocultivos seriados, en todos los pacientes en estadio C, con conteos de CD4 por debajo de 100 células/mm3 lo cual coincide con la literatura internacional 22,23,44,45,46.
El aumento en el número de aislamientos de complejo MAI y su alta correlación con el estadio C, coincide con los hallazgos de un estudio Español46 y uno Belga47, en los que consideraban a Mycobac-terium avium uno de los principales patógenos en los estadios avanzados de la enfermedad más que Mycobacterium tuberculosis, siendo un importante predictor de muerte.
Es de destacar que en el presente estudio la presencia de micobacterias aumentó 5.1 veces la probabilidad de morir48.
Aunque el complejo MAI en muestras diferentes a sangre no indica enfermedad aparente, dichos pacientes probablemente pueden estar siendo colonizados, se sabe que en pacientes con SIDA la colonización precede a la invasión49, indicando la necesidad de hacer un seguimiento periódico en los pacientes infectados por VIH a partir de su ingreso al estadio B, en el cual la micobacteria podría estar colonizando al individuo, en espera de un aumento de su inmunosupresión para producir una micobacteriosis diseminada, la cual puede ser evitada administrando un tratamiento quimiopro-filáctico.
Los hallazgos del examen directo frente al cultivo ratifican que en pacientes VIH positivos este método ofrece un rendimiento bajo, a excepción del que ofrece para el diagnóstico de la tuberculosis pulmonar, ya que en la mayoría de casos las muestras son paucibacilares debido a su ubicación extrapulmonar50, 51, 52.
Además disminuye su especificidad debido a la presencia en estos pacientes de complejo Mycobacterium avium intracellulare.
En el estudio un paciente presentó baciloscopias de materia fecal positivas frente a cultivos negativos:
Pudo tratarse de una MNT incapaz de crecer en los medios utilizados, como es el caso de un M. genavense54, o a la presencia de micobacterias no viables.
La muestra que ofreció mayor rendimiento en la recuperación de micobacterias fue la materia fecal:
seguida de la orina, la sangre y el esputo. Lo que demuestra la importancia de utilizar varias fuentes de aislamiento, para poder tener un mayor rendimiento en los cultivos.
Las variables clínicas asociadas a la presencia de micobacterias fueron: la pérdida de peso, la diarrea y la fiebre.
Aunque estos síntomas pueden presentarse en casos de otras infecciones como las producidas por Citomegalovirus, o en caso de linfoma o de síndrome constitucional, etc es importante que cuando se presenten en pacientes en estadío B y C, de infección VIH, con conteos de CD4 por debajo de 500 células/mm3, se estudie en ellos en forma repetitiva la presencia de una micobacteria, ya que se demostró que el seguimiento de los pacientes mejora la probabilidad de diagnosticar las micobacterias, además de detectar bacteremias sub-clínicas, que pueden ser tratadas a tiempo, disminuyendo la morbi-mortalidad alta debida a la coinfección, mejorando así la calidad de vida de estos pacientes.
Conclusiones
- La prevalencia de micobacterias en este estudio fue de 5.6% (16/286), siendo la de M. tuberculosis de 1.4% (4/286), la del complejo MAI 4.6% (13/286) y la de otras micobacterias no tuberculosas MNT 0.35% (1/286).
- Las variables clínicas asociadas a la presencia de micobacterias fueron pérdida de peso, diarrea y fiebre.
- La muerte fue 5.1 veces mayor en pacientes con micobacterias.
- Los aislamientos de micobacterias se hicieron evidentes en los pacientes en estadíos B y C, por lo cual consideramos que se debe iniciar un seguimiento para detectar la presencia de dichos microorganismos a partir del estadío B, para así poder determinar una colonización previa, pudiendo mediante tratamiento evitar diseminación y muerte por esta causa.
- El antecedente de tuberculosis previa aumentó 2.4 veces la probabilidad de infección por micobacterias, lo que también es indicación para el seguimiento.
- El método de elección para la detección de micobacterias en pacientes VIH positivos, es el cultivo, ya que su positividad fue mayor que la baciloscopia, pero es de destacar la positividad de baciloscopias en muestras de sangre y materia fecal; lo cual permitiría hacer un diagnóstico precoz de infección micobacteriana, siendo indispensable el cultivo para poder identificarlas.
- La sensibilidad en el diagnóstico de las micobacterias, puede aumentarse cultivando diferentes muestras, tales como sangre, orina, materia fecal, esputo, líquidos, etc.
Bibliografía
Dutt A and Steapidemiología y factores del huésped. En Schlossbergg D. Tuberculosis e infecciones por micobacterias no tuberculosas. 4 Ed. Méjico.. MaGraw Hill Interamericana;.2000. p3-13.
Kochi A. The global tuberculosis situationand the new control strategy of the World Health Organization. Tubercle.1.991:71:1-6.
Mims C. Infecciones crónicas de las vías respiratorias inferiores. Tuberculosis. En Microbiología Médica. Gran Bretaña: Mosby Doyma libros, 1.995.p22.14.
Sepkowitz K, Raffalli J, Riley L, Kiehn T and Armstrong D. Tuberculosis in the AIDS era. Clin Mic Rev.1.995;8:180-199.
Dermot m and Raviglione M. La epidemia mundial de tuberculosis: el punto de vista de la Organización Mundial de la Salud. En Schlossbergg D. Tuberculosis e infecciones por micobacterias no tuberculosas. Méjico. 4 Ed. MaGraw Hill Interamericana.2000.p120-32.
Harries A. Maher D. TB/VIH Manual Clínico para América Latina. OMS 1.997;1 p17.
Slutkin G, Leowski J, Mann J. Efectos de la epidemia de sida sobre el problema de la tuberculosis y los programas antituberculosos; prioridades para el control y la investigación 1988; OMS.
Huebner R, Villarino M, Snider D. Tuberculin skin testing and the HIV epidemic. Jama 1992; 267:409-10.Dooley S, Villarino M, Lawrence M, Salinas L, Amil S, Rullan J et al. Nosocomial transmission of tuberculosis in a hospital unit for HIV-infected patients. Jama 1992;267(19):2632-4
Catanzaro A. Nosocomial tuberculosis. Am Rev Respir Dis 1982;125:559-62.
Dolin P, Raviglione M, Kochi A. Global tuberculosis Incidence and mortality during 1.990-2.000.Bulletin of the World Health Organization 1.994;72(2):213-20.
IQUEN. Informe quincenal epidemiológico Nacional. 2.000. 5(4).
Boletín de la Organización Panamericana de la Salud (OPS). Tuberculosis.2000. 3(3).
Wolinsky E. Nontuberculous mycobacteria and associated diseases. Am Rev Respir Dis 1979;106-59.
Horsburg CR, Mason UG, Farloi DC, Iseman MD, Disseminated infection with Mycobacterium avium intracellulare. Medicine 1985;64:36-48.
Inderlied CB, Kemper C.A and Bermúdez L.E. The Mycobacterium avium complex. Clin. Microb. Rev 1.993;6(3):266-310.
Horsburgh CR Jr. The Pathophysiology of disseminated Mycobacterium avium complex disease in AIDS. Journal of Infectious Disease. 1999;179:461-5
Reicher CM, O Leary TJ, Levens DL, Simrell CR, Macher AM. Autopsy pathology in the acquired inmunodeficiency syndrome. Am J Pathol 1.983;112:357-82.
Horsburgh R and Selik R. The epidemiology of disseminated non tuberculous mycobacterial infection in the acquired immunodeficiency syndrome (AIDS). Am Rev Respir Dis. 1.989;139:4-7.
Bermúdez LE, Petrofsky M, Kolonoski P, young LS. An animal model of Mycobacterium avium complex disseminated infection after colonization of the intestinal tract. J Infect Dis 1992; 165:75-9.
Stone B, Cohn D, Kane M, Hildred M, Wilson M and Reves M. Utility of paired blood cultures and smears in Diagnosis of Disseminated Mycobacterium avium complex infections in AIDS patients. J Clin Microbiol 1994;32(3):841-42.
Crawford J. Development of rapid techniques for identification of M. avium infections. Res Microbiol 1.994;145(3):177-81.
Heifets L. Quantitative cultures and drug susceptibility testing of Mycobacterium avium clinical isolates before and during the antimicrobial therapy. Res Microbiol 1994;145(3):188-96.
De caprariis PJ, Giron JA, Goldstein JA. LaBombardi VI, Guarineri JJ, Laufer H. Mycobacterium avium intracellulare infection and possible venereal transmission (letter). Ann Intem Med 1984;101:721.
Antony MA, Breandy LJ, Klein RS and Bemstein LH. Diarrhea in patients with AIDS. Dig Disc and Sci 1988;38:1141-6.
Smith PD, Lane C, Gill VJ, Manischewitz JT, Quinnan GV, Faucl A et al. Intestinal Infections in patients with the acquired Inmunodeficiency Syndrome (AIDS). Ann Int Med 1988;108:328-33.
Framm D and Soave R. Agents of Diarrhea in Management of the HIV-Infected patients. Part II. Med Clin of North America 1.997:81(2):427-41.
Chiu J, Nassbaum J, Bozette S, Tilles JG, Young LS, Leedam J, et al. Treatment of disseminated Mycobacterium avium complex infection in AIDS with amikacin, ethambul, rifampin and ciprofloxacin. Ann Intem Med 1990:113:358-61.
Coyle MB, Carlson LD, Wallis CK, Leonard R. Laboratory aspects of “Mycobacterium genavense”, a proposed species isolated from AIDS patients. J Clin Microbiol 1992;30:3206-12.
Torres RA, Nord J, Feldman R, LaBombardi VI and Barr M. Disseminated mixed Mycobacterium simiae – Mycobacterium avium complex infection in acquired inmunodeficiency syndrome. J Infect Dis 1991; 164:432-3.
Bottger E.C, Teske A, Kirschner P, Bost S, Chang HR, Beer V and Hirschel B. Disseminated “Mycobacterium genavense” infection in patients with AIDS. Lancet 1992:340:76-80.
Saubolle M, Kiehn T, White M, Rudinsky M, and Armstrong D. Mycobacterium haemophilum: Microbiology and expanding Clinical and geographic spectra of disease in humans. Clin Microb Rev. 1996;9(54):433-47.
Tortoli E, Pierismoni C, Bacosi D, Bartoloni A, Betti F, Bono L et al. Isolation of the Newly Described Species Mycobacterium celatum from AIDS patients. J of Clin Microbiol 1995;33(1):137-40.
Murcia MI. Frecuencia de infecciones micobacterianas en pacientes VIH positivos que acuden a la consulta del Hospital San Juan de Dios (Tesis). Bogotá: Universidad Nacional de Colombia, 1996.30,31,32,80.p.
Ministerio de Salud- Instituto Nacional de Salud. Tuberculosis Manual de Procedimientos 1.990.
Center for Disease Control US. Department of Health and Human Services. Public Health Mycobacteriology. A Guide for the level III Laboratory. 1.985.
Canetti G, Rist N and Grosset J. Medida de la sensibilidad del bacilo tuberculoso a las drogas antibacilares por el medio de las proporciones múltiples. Versión en español por Raisa Nikolajuk de Inurzan. Buenos Aires. 1.965.
Murcia M, Leon CI, De La Hoz F, Saravia J. Freciencia de infecciones micobacterianas en pacientes VIH positivos que acuden a la consulta del hospital San Juan de Dios. Biomëdica, 1996:16(Sup 1)23.
Velázquez G, Goméz AR. SIDA, enfoque integral. 1 ed. Medellín: CIB 1993,2.7.
Crespo MP, Corral R, Alzate A, Tabares MN, Alvarez L y Carmona F. El diagnóstico de la infección por micobacterias en individuos VIH positivos. Colombia Med, 1994;25:86-91.
Velásquez G, Mejia P, Restrepo N, Betancour J, Comportamiento de la tuberculosis en pacientes infectados por el Virus de la inmunodeficiencia humana. Resumenes segundo encuentro nacional de investigación en enfermedades infecciosa. Medellín: Sociedad Colombiana de Infectología, 2000.:4(1) Abs. E3:32.
Lado FL, Barrio E, Carballo E, and Cabarcos A. Tuberculosis and human inmunodeficiency virus infection: clinical manifestations and performance of diagnostic procedures according to distinct forms of the localization of disease, An Med Interna 2000; 17(1):13-8.
Mauss S, Wolf E, Hans J. Changing incidence of mycobacterial diseases in German pacients with HIV Infection. 1999. The AIDS reader 9(6):386-392.
Chaisson RE, Bishai WR. MAC and TB infection: Management in HIV disease. HIV clinical management-Volume 5 1999 Medscape Inc.:https://www.medscapa.com
Cinti S, Kaul D, Sax D, Laurence R, Crane, Kazanjian H. Recurrence of Mycobacterium avium infection in Patients receiving highly active antiretroviral therapy and antimycobacterial agents. Clinical of infectious diseases, 2000;30:511-514.
Pulido F, Iribarren JA, Kindelan JM and Moreno S, Diagnóstico y Tratamiento de las infecciones por micobacterias en pacientes con VIH/SIDA. Enferm Infect Microbiol Cli 1998;16suppl 1:20-8.
Payen MC, De Wit S and Clumeck N. Manifestations, doagnostic and tretment of non –tuberculous mycobacterial infections in patients with HIV infection. Rev Mal Respir 1997; (12 Suppl 5):5142-51.
Talbot EA, Reller LB and Frothingan B.. Bone marrow cultures for the diagnosis of mycobacterial and fungal infections in patients infected with the human inmunodeficiency virus. Int J Tuberc Lung Dis 1999; 3(10):908-12.
Portaels F. Epidemiology of mycobacterial disease. In: Mycobacterial disease of the skin, clinics in dermatology, Ed. M.S. Schuster. New York 1995. Elsevier Science Inc. 13:207-222.
Shafer RW. Goldberg R, Sierra M. and Glatt A. Frecuency of Mycobacterium tuberculosis bacteremia in patients with tuberculosis in an area endemicfor AIDS. Am Rev Respir Dis 1989; 140:1611-13.
Relkin F, Aranda C, Garay S. Pleural tuberculosis and HIV infection. Chest 1994; 105:1338-1341.
Castilla G, Gutierrez A, Sanchez M. La tuberculosis en los enfermos de SIDA en España. Impacto de la ampliación de la definición de caso de SIDA. Pub of seisida 1995; 6(2):19-25.
Pitchenik AE, Cole C, Russel BW, Fischl MA, Spira TJ and Snider DE. Tuberculosis, atypical mycobacteriosis, and the adquired inmunodeficiency syndrome among haitian and non haitinian patients in south florida. Ann Intem Med 1984:101:641-5.
Kirschner P. Vogel U, Hein E. And Bottger E. Bias of culture techniques of diagnosis mixed Mycobacterium genavense and Mycobacterium avium infection in AIDS. J of Clin Microbiol 1994; 32(3):828-831.
Autor
Murcia MI 1, Gómez JE 2.3, Alvarado F 3, Bustillo JG 4, Divels E 4, Gómez B 5, León CI 6, Triana WA 7, Vargas EA 7, Rodríguez E 7,
1. Departamento de Microbiología, Facultad de Medicina-Universidad Nacional de Colombia.
2. Centro de Investigaciones Biomédicas, Facultad de Ciencias de la salud. Programa de Medicina. Universidad del Quindío.
3. Unidad de Infectología. Departamento de Medicina Interna. Facultad de Medicina- Universidad Nacional de Colombia.
4. Departamento de Medicina Interna. Hospital Simón Bolívar.
5. Programa VIH/SIDA Instituto de Seguro Social.
6. Laboratorio de Micobacterias. Instituto Nacional de Salud.
7. Facultad de Medicina- Universidad Nacional de Colombia.