Homeostasis del Calcio
El adulto normal tiene 1100 g de calcio en su cuerpo, del cual el 99% está en el esqueleto. En forma de hidroxiapatita.
Aproximadamente el 0.1% del calcio corporal se localiza en el líquido extracelular y cerca del 1% se localiza en el interior de las células.
El nivel de calcio total plasmático oscila entre 8.4 y 10.5 mg/dl en parte unido a proteínas y en parte difusible. El calcio iónico es el activo funcionalmente (calcio iónico normal: 4.6 – 5.1 mmol dL).
El hueso es un tejido con gran actividad metabólica que depende de un sincitio celular, que a su vez condiciona la remodelación esquelética. Cerca de 500 mg de calcio pueden ser recirculados por día, a partir de las URO, de modo que el hueso, como tejido dinámico que sufre un recambio diario, necesita para mantener el depósito, la extracción aproximada de 500 mg de calcio del pool extracelular a medida que se produce la osteogénesis, y regresando una cantidad similar a dicho pool en el proceso de osteólisis para equilibrar el balance18.
Calcio intracelular
Existen cuatro sistemas que promueven la entrada de calcio:
- Entrada lenta pasiva de calcio.- Funciona continuamente en reposo y transporta sólo
mínimas cantidades de calcio. - Canales voltaje dependientes o canales lentos calcio-sodio.- Permite la entrada de mayores cantidades de calcio al activarse eléctricamente. Algunos de estos funcionan para el sistema cardiovascular.
- Canales activados por receptor o por hormonas.- Las hormonas vasopresoras como los agonistas alfa-adrenérgicos, vasopreina, angiotensina II y endotelina se unen a esos receptores y activan sus canales de calcio.
- Canales activados por estiramiento.
El ciclo biológico del calcio: absorción, excreción y reabsorción
La concentración extracelular del ión calcio está determinada por la relación entre su absorción intestinal, su excreción renal y su captación y liberación ósea, todas ellas reguladas por las hormonas. La ingesta diaria recomendada de calcio varía con la edad y se considera apropiada en la posmenopáusica entre 1200 y 1500 mg. En condiciones normales oscila entre 200 y 2000 mg19. Los cationes divalentes como los iones de calcio se absorben mal en el intestino. Generalmente solo un 30 a 35% es absorbido de forma activa y pasiva, principalmente en el intestino delgado.
La absorción activa ocurre cuando el consumo de calcio es deficiente, depende de los niveles de vitamina D, los cuales a su vez disminuyen con la edad. La absorción es facilitada por la vitamina D la cual activa la síntesis de la proteína transportadora o proteína de Wassermann. Esta proteína fija el calcio de las células del epitelio intestinal y además funciona en el borde en cepillo para transportar calcio hacia el citoplasma celular.
La intensidad en la absorción de calcio parece ser directamente proporcional a la cantidad existente de esta proteína fijadora, la cual además persiste en las células varias semanas después de que el 1.25 dihidroxicolecalciferol ha sido eliminado del organismo, provocando así una absorción prolongada de calcio20.
La excreción de calcio se hace a través del tracto gastrointestinal y la vía urinaria.
En los casos de lactancia materna, la excreción láctea a través de la glándula mamaria también representa una no despreciable composición de calcio en forma iónica.
Al intestino llegan 250 mg/día adicionales de calcio proveniente de las secreciones de los jugos gástricos e intestinales y las células mucosas desprendidas y se excretan con las heces alrededor de 150 a 170 mg junto con la fracción dietética no absorbida. Como se observa, la mayor parte del calcio ingerido es eliminado en las heces.
La excreción urinaria de calcio aproximadamente es el 10% del calcio ingerido (100-200 mg/día). El 90% del calcio filtrado es reabsorbido en el túbulo distal, siendo esto controlado por la PTH. Cuando la calcemia es baja, este mecanismo se intensifica al máximo (Figura 9).
El metabolismo del calcio y su aprovechamiento está basado en la cantidad de calcio que se ingiere, en la absorción intestinal, en la excreción urinaria y la pérdida por las heces fecales. Se considera que el ingreso y la absorción del calcio influyen en un 25% del balance, mientras que la pérdida urinaria varía aproximadamente en un 50%.
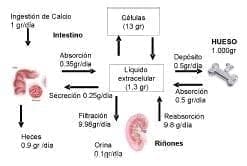
Las cifras aproximadas de recambio diario de calcio en el adulto son:
Figura 9. Intercambio de calcio entre los diferentes compartimentos tisulares, en una persona por cada 1gr de calcio ingerido al día. La mayor parte es eliminado por las heces. Adaptada de Tratado de Fisiología Guyton.
- Ingestión: 800 mg
- Absorción intestinal 350 mg
- Secreción en los jugos gastrointestinales 190 mg
- Pérdida en heces 630 mg
- Excreción en orina 170 mg
- Remodelación Ósea 500 mg
Intercambio de calcio entre el hueso y el líquido extracelular
La mayor parte del calcio intercambiable está en el hueso entre el 0.4 y el 1% de todo el calcio óseo. Este calcio está depositado en los huesos en una forma de sal, fácilmente movilizable como CaHPO4 y otras sales amorfas de calcio.
La importancia del calcio intercambiable es que brinda un mecanismo rápido de amortiguamiento para evitar que la concentración de calcio iónico de los líquidos extracelulares se eleve o descienda en exceso en situaciones transitorias de exceso o falta de disponibilidad de calcio.
PTH , calcio y fosfato
La hormona paratiroidea aumenta la absorción de calcio y fosfato en el hueso.
La PTH parece tener dos efectos sobre el hueso que provocan absorción de calcio y de fosfato. Una fase rápida que se inicia en minutos y una fase lenta que requiere días a semanas21.
Las membranas celulares de los osteoblastos y osteocitos tienen proteínas receptoras que ligan la PTH, para ejercer su acción.
Fase rápida de la absorción de calcio y fosfato
Estudios histológicos y fisiológicos han mostrado que la PTH provoca la eliminación de sales del hueso de dos zonas: de la matriz ósea vecina a los osteocitos en el interior del propio hueso y de la vecindad de los osteoclastos a lo largo de la superficie del hueso.
Los osteoblastos y los osteocitos forman un sistema de células interconectadas (sincitio) que se extiende por el hueso y sobre todas las superficies óseas excepto las pequeñas zonas de superficie adyacentes a los osteoclastos. Prolongaciones largas y laminares se extienden de un osteocito a otro por toda la estructura ósea y estas prolongaciones también conectan con los osteocitos superficiales y los osteoblastos. Este extenso sistema se denomina sistema de membrana osteocítica y se cree que representa una membrana que separa el propio hueso del líquido extracelular.
Entre la membrana osteocítica y el hueso existe una pequeña cantidad de líquido que se denomina líquido óseo. La membrana osteocítica bombea iones calcio desde el líquido óseo al líquido extracelular, creando una concentración de calcio en el líquido óseo que es de solo 1/3 respecto a la del líquido extracelular. Cuando la bomba osteocítica se activa en exceso, la concentración de calcio en el líquido óseo desciende todavía más y entonces se reabsorben sales de fosfato cálcico del hueso. Este efecto se denomina osteólisis.
Cuando la bomba se inactiva, la concentración de calcio del líquido óseo se eleva a un nivel más alto y se vuelven a depositar en la matriz sales de fosfato cálcico.
Fase lenta de la absorción ósea
Los osteoclastos no tienen receptores de PTH. Los osteoblastos y los osteocitos envían una señal a los osteoclastos haciendo que emprendan su tarea habitual.
Varios días de exceso de PTH hacen que el sistema de osteoclastos se desarrolle bien. Tras unos cuantos meses de exceso de PTH la reabsorción osteoclástica del hueso puede hacer que los huesos se debiliten y se produzca una estimulación secundaria de los osteoblastos que intentan corregir la debilidad.
En un exceso persistente de PTH en fases más tardías existe más reabsorción que depósito de hueso.
Homeostasis del fósforo
Metabolismo normal del fósforo
El contenido total del fósforo en una persona adulta sana de 70 kg de peso es aproximadamente de 7 g. El 80% está contenido en el hueso, 9% en el sistema músculo-esquelético y el resto en las vísceras y líquido extracelular. En el plasma, el fosfato inorgánico se encuentra en dos formas: HPO4-2 y H2PO4-2.
Dada la dificultad que implica determinar la proporción de ambos iones en sangre, se suele determinar la cantidad total de fosfato en términos de miligramos de fósforo por dL de sangre. La cantidad total media de fósforo inorgánico oscila alrededor de 3.4 a 4 mg/dl en el adulto.
El ión fosfato es el principal anión intracelular y es el constituyente más importante de los fosfolípidos de las membranas celulares. El fósforo es el componente metálico de los nucleótidos de alta energía en las células, fosforila la proteinquinasa y algunas enzimas del borde en cepillo y también forma parte de la estructura cristalina del hueso.
Ciclo biológico del fósforo: absorción y excreción
La absorción en la luz del tubo digestivo es muy fácil, excepto los casos en que la alimentación contiene mucho calcio, caso en el cual se forman fosfatos de calcio casi insolubles que son excretados por las heces. El porcentaje de fosfato absorbido por la dieta permanece relativamente constante.
La excreción se hace a través del tracto gastrointestinal y urinario; también a través de la glándula mamaria en las mujeres que están lactando.
El flujo de fosfato a través del epitelio gastrointestinal se ve incrementado por la acción de la vitamina D. Una dieta bien equilibrada provee de 1000 mg de fósforo cada día y tiende a ser más alta en aquellas personas que consumen grandes cantidades de carne o productos lácteos. Cuando la alimentación contiene mucho calcio se forma fosfato de calcio casi insoluble que continúa su tránsito intestinal y es excretado por las heces, la excreción es del orden de 70%.
La fosfaturia es directamente proporcional a la fosfatemia, este efecto se encuentra regulado por la acción de la PTH a través de un mecanismo de rebosamiento el cual está dado por un nivel crítico de 1 mmol/L, si la concentración es menor de este nivel se reabsorbe todo el fosfato del filtrado glomerular. La PTH tiene una gran capacidad para aumentar la excreción de fosfato por parte del riñón.
Las personas que ingieren una dieta mixta normal excretan en su orina entre el 60 y el 90% del fósforo ingerido.
El balance de fosfato diario promedio de un adulto es:
- Ingesta 900 mg
- Absorción 600 mg
- Excreción fecal 300 mg
- Excreción Urinaria 600 mg
- Remodelación ósea 250 mg
Homeostasis del magnesio
Metabolismo normal del magnesio
El magnesio es el segundo electrolito intracelular más abundante y el cuarto catión en el organismo precedido por calcio, sodio y potasio. Su importancia fisiológica radica en la preservación del potencial eléctrico de la membrana en células excitables y es importante como cofactor de diversas enzimas.
El catión divalente magnesio se encuentra en el líquido extracelular e intracelular siendo más abundante en este último.
Regulación del magnesio sérico
El magnesio es un mineral casi sin depósito y cuyo nivel plasmático depende fundamentalmente de la ingesta diaria.
El magnesio plasmático también depende de la concentración de otros cationes como el Ca y K, puesto que compite en el nivel renal con los mismos mecanismos de reabsorción tubular.
Distribución del magnesio en el organismo
El contenido corporal total de magnesio es de unos 25 mg. De todas las reservas corporales de magnesio, del 53 al 60% se encuentran en el hueso y del 20 al 27% en el músculo estriado. Únicamente el 30% del magnesio óseo y del 20- 30% del magnesio muscular se encuentra libre o en una reserva fácilmente intercambiable.
En el hueso el magnesio existe en dos formas, cerca del 70% del magnesio óseo es removido relativamente fácil con ácidos diluidos, mientras que el 30% restante está íntimamente asociado con el hueso.
El magnesio removible se encuentra en la superficie de los cristales, en el grupo fosfato de los cristales de hidroxiapatita, mientras que el magnesio firmemente unido está integrando parte de la trama cristalina ósea.
Existen muy pocas reservas corporales, sólo el 1% del magnesio esquelético es intercambiable en una hora, en una semana solo se intercambia el 5%
La concentración de magnesio en el plasma es de 1.7 a 2.4 mg.
En tejidos blandos el 80% del magnesio se encuentra en el sistema músculo-esquelético.
Magnesio en el líquido extracelular
La concentración plasmática está comprendida entre el 1.4 y el 1.7 ó 2 m Eq/L.
El magnesio del plasma está ligado a proteínas. La concentración de magnesio difusible es menos precisa que la del calcio, representa del 65 al 67% del total. El calcio y el magnesio compiten por los mismos puntos de unión de las proteínas. La competencia por los mismos receptores proteicos también significa que si la concentración de calcio aumenta, la de proteinato de magnesio disminuirá y la de iones magnesio aumentará.
Otras formas de magnesio en el nivel plasmático son:
- Magnesio iónico libre 55-60%
- Ligado a HPO4 3%
- Ligado a citrato 4%
- Otras formas (bicarbonato) 6%
- Magnesio proteico 32%
Ciclo biológico del magnesio: absorción, excreción y reabsorción
Las necesidades diarias son de 300 a 350 mg/día en el adulto.
La disponibilidad de magnesio dietario es baja; la absorción se realiza preferiblemente en el intestino delgado y está condicionada a muchos factores como relación calcio/magnesio, relación magnesio / PO4, relación K/magnesio.
Dado que el magnesio se mueve pasivamente a través de la pared del intestino delgado, la concentración de magnesio disponible en la dieta, y el tiempo de contacto entre el alimento digerido y la superficie de absorción, son los factores responsables más importantes en la absorción de este ión. La absorción del magnesio es pasiva y se efectúa a nivel del íleo.
El magnesio es excretado por vía gastrointestinal, comprende el contenido en la dieta y no absorbido, y el endógeno. El no absorbido varía con el tipo de dieta, las relaciones calcio/magnesio, potasio/magnesio, fósforo/magnesio y la cantidad de NH3 tanto luminal como intestinal.
La excreción urinaria del magnesio se realiza por un mecanismo de filtración-reabsorción, en el cual el proceso de reabsorción funciona cerca de su máximo y la excreción de magnesio es en parte dependiente de otros iones. En condiciones normales todo el magnesio absorbido aparece íntegramente en la orina. Entre el 70% y el 80% del magnesio plasmático es filtrado en el glomérulo.
Los principales factores que regulan el transporte tubular de magnesio son:
- Concentración plasmática: la hipomagnesemia aumenta el transporte, disminuyendo su excreción.
- El calcio: la hipercalcemia se asocia a hipercalciuria e hipermagnesiuria.
- Factores que producen cambios en el voltaje y permeabilidad en el asa ascendente de Henle interfiriendo con la reabsorción de NaCL.
- PH: la alcalosis metabólica estimula y la acidosis inhibe la reabsorción.
- El potasio: la hipopotasemia y la depleción de fósforo inhiben la reabsorción tubular.
La excreción láctea también presenta una no despreciable composición de magnesio, en forma iónica, asociado a coloides o en otras formas.
Referencias
- 1. National Institutes of Health. Osteoporosis. Consensus Development Conference Statement. March 27-29. J Clin Endocrinol Metab. 2001; 86(12): 5681-5686.
- 2. Wagner EF, Karsenty G. Genetic control of skeletal development. Curr Opin Gen Develop 2001; 11: 527-532.
- 3. Guzmán R. Osteoporosis: Inmunología de la Enfermedad, aspectos celulares, moleculares y genéticos. Revista Colombiana de Menopausia. 2003; 9: 317-325.
- 4. Guyton-Hall. Edición 10a 2001.Tratado de fisiología médica, pp. 1079-1098.
- 5. Ducy P, Schinke T, Karsenty G. The osteoblast: a Sophisticated fibroblast under central surveillance. Science 2000; 289: 1501-1504.
- 6. Karsenty G. Transcriptional control of osteoblast differentiation. Endocrinology 2001; 142: 2731-2733.
- 7. Skillington J, Choy L, Derynck R. Bone morphogenetic protein and retinoic acid signaling cooperate to induce osteoblast differentiation of preadipocytes. J Cell Biology 2002; 159: 135-146.
- 8. Tomkinson A, Gevers EF, Wit JM, Reeve J, Noble BS. The role of estrogen in the control of rat osteocyte apoptosis. J Bone Miner Res 1998; 13: 1243-1250.
- 9. Qiu S, Rao DS, Palnitkar S, Parfitt AM. Age a distance from the surface but not menopause reduce osteocyte density in human cancellous bone. Bone 2002; 31: 313-318.
- 10. Teitelbaum SL. Bone Resorption by Osteoclasts. Science 2000; 289: 1504-1508.
Bibliografías
- 11. Everts V, Delaisse JM; Korper W,Jansen DC, Tigchelaar-Gutter W; Saftig P y cols. The bone lining cell: Its role in cleaning Howship´s lacunae and initiating bone formation. J Bone Miner Res 2002; 17: 77-90.
- 12. Pfeifer M, Begerow B, Minne HW. Vitamin D and muscle function. Osteoporosis Int 2002; 13: 187-194.
- 13. Bossard MJ, Tomaszek TA, Thompson SK, Amegadzie BY, Hanning CR, Jones C, and cols.Proteolytic activity of human osteoclast cathepsin K-expression, purification, activation, and substrate identification. J Biol Chem 1996; 271: 12517-12524.
- 14. Delaissé JM, Engsig MT, Everts V, Ovejero MC, Ferreras M, Lund L y cols. Proteinases in bone resorption: Obvious and less obvius roles. Clin Chim Acta 2000; 291: 223-234.
- 15. Atley LM, Mort JS, Lalumiere M, Eyre DR. Proteolysis of Human bone collagen by cathepsin K: characterizacion of the cleavage site generating the cross-linked N-telopeptide. Bone 2000; 26: 241-247.
- 16. Wittrant Y, Couillaud S, Theoleyre S, Dunstan C, Heymann D, Rédini F. Osteoprotegerin differentially regulates protease expression in osteoclast cultures. Med Chem 2004; 47: 598-599.
- 17. Burr DB. The contribution of the organic matrix to bone´s material properties. Bone 2002; 31: 8-11.
- 18. Wang X, Shen X, Li X, Agrawal CM. Agerelated changes in the collagen network
and the toughness of bone. Bone 2002; 31: 1-7. - 19. The North American Menopause Society. The role of calcium in Peri and Posmenopausal women 2006 position statement. Menopause 2006; 13: 862-877.
- 20. Brown AJ, Dusso A, Slatopolsky E. Vitamina D. Am J Physiol 1999; 277: F157.
- 21. Brown EM. Extracelular Ca+2 sensing regulation of parathyroid cell function and role of Ca+² and other ions as extracelular (first) messenger Physiol Rev. 1991; 71: 371.
Del grupo de expertos en Menopausia del Centro Médico Imbanaco. Cali Colombia
CLIC AQUÍ Y DÉJANOS TU COMENTARIO