Seroprevalencia de Anticuerpos
Contra el Virus HTVL-1 en pacientes con Parálisis Facial Idiopática en Cali, Colombia
John N. Figueroa E.*, Claudia Correa C.**, Abraham Blank C.***, Pedro A. Blanco S.****
Resumen
Una de las patologías que con mayor frecuencia es remitida al otorrinolaringólogo para su estudio es la parálisis facial (PF) catalogadas, la mayoría de las veces, como idiopáticas (PFI).
En años recientes se han identificado regiones endémicas para la infección por el virus linfotrópico humano tipo 1 (HTVL-1), entre ellas el suroccidente de Colombia. Existen algunos reportes de asociación epidemiológica de esta infección y casos de (PF).
Siendo el hospital Universitario del Valle (HUV) el principal centro de referencia de esta región, se pretendió con este estudio establecer la seroprevalencia de anticuerpos contra el HTVL-1 en pacientes con (PF).
Se incluyeron todos los casos de PFI que consultaron por primera vez al servicio de ORL durante un período consecutivo de 4 meses. En total se evaluaron muestras de suero de 46 pacientes con PFI y de 109 controles utilizando de aglutinación de partículas (Serodia-HTLV-1), Fujirebio, Tokio). La prevalencia del virus HTVL-1 fue de 4,35% en el grupo de casos y de 0,91% en los controles.
Palabras clave: parálisis facial, virus HTLV-1
Introducción
bidiopática. Esta entidad es causada por múltiples procesos: inflamatorios, infecciosos, vasculares, tumorales o traumáticos (1-11).
El nervio facial es un nervio mixto y está constituido por fibras con diversa función: motoras: inervan los músculos de la cara y el músculo del estribo, sensitivas: recogen la sensibilidad del conducto auditivo externo, viscerales especiales, con fibras parasimpáticas para la glándula lagrimal y glándulas salivales submaxilar y sublingual, y sensoriales: recogen la sensibilidad gustativa de los tercios anteriores de la lengua (1-6).
El núcleo motor del nervio facial se encuentra en la zona inferior de la protuberancia del tronco encefálico. El nervio penetra en el conducto auditivo interno del hueso temporal junto con el nervio vestibulococlear y comienza su recorrido intraóseo en el conducto de Falopio. En este trayecto se divide en tres porciones: laberíntica, timpática y mastoidea. Sale del hueso temporal por el agujero estilomastoideo y se divide en sus ramas terminales en el espesor de la glándula parótida. En este recorrido aparecen tres ramas de gran importancia para establecer el topodiagnóstico de sus lesiones. El nervio petroso mayor es el responsable de la secreción lagrimal y de las glándulas salivales submaxilar y sublingual; el nervio del músculo del estribo que actúa sobre este músculo involuntario y se contrae ante sonidos intensos mayores de 80 decibeles; la cuerda del tímpano, que se une al nervio lingual y recoge la sensibilidad de los dos tercios anteriores de la lengua (7).
La disminución completa o parcial de la conducción del nervio lleva a disminución en la contractilidad de los músculos de la cara, siendo éste el primer síntoma que refiere el paciente cuando presenta una parálisis del nervio facial. Puede asociarse a disminución de la secreción lagrimal, disacusias y alteraciones del gusto (1, 2).
Existen varios procesos patológicos que pueden causar una parálisis periférica del nervio facial; procesos infecciosos, tumorales, iatrogénicos, vasculares y traumáticos (8, 17) pudieran desarrollarla. El 80% de las parálisis faciales periféricas son idiopáticas (1, 2, 16), involucrando dos posibles etiologías; una vascular explicada por un vasoespasmo y edema del poco espacio libre que deja el nervio en su recorrido por el canal de Falopio; otra viral explicada por lesión desmielinizante o por edema.
La parálisis muscular aparece abruptamente; en muchas ocasiones existe el antecedente de una infección respiratoria alta previa, hipertensión arterial o diabetes. Evoluciona hacia la mejoría completa en el 80% de los casos en los siguientes 6 meses.
Dentro de la etiología viral, el virus del Herpes simple es el más estudiado en modelos de experimentación que buscan demostrar que este agente pudiera causar una serie de cambios de desmielinización y edema que alteren la conducción normal del nervio facial, impidiendo el normal funcionamiento de éste y reflejándose con parálisis de los músculos de la mímica facial (10, 11). En dos estudios realizados en los últimos años, la relación entre la PFI y el virus linfotrópico humano tipo I (HTLV-1) se comienza a fortalecer en áreas endémicas para el virus, como las islas del caribe y el suroccidente de Colombia (12-14). Hasta ahora estos estudios han sido descriptivos y observacionales aunque conservan la fortaleza de ser realizados por grupos de investigadores respetables.
Los procesos infecciosos como la otitis media aguda pudieran producir parálisis del nervio facial explicándose que existe un 30% de la población con dehiscencia del canal del nervio facial exponiendo este último a los cambios inflamatorios del proceso infeccioso, como el edema (21).
La aparición de una parálisis del nervio facial requiere de una cuidadosa historia clínica y un examen físico minucioso tratando de identificar el factor causal de la enfermedad. En ocasiones es necesario valerse de estudios imagenológicos (RNM, TC) para aclarar la causa. El topodiagnóstico es importante para localizar el sitio de la lesión dentro de todo el trayecto del nervio. La prueba de Shirmer evalúa la primera porción del nervio mediante la lacrimación a través del nervio petroso mayor; la limitación acústica valora la segunda porción, es decir, el músculo del estribo mediante el reflejo estapedial; la gustometría valora la tercera porción – la cuerda del tímpano -; la cuarta porción se evalúa mediante el examen muscular tratando de valorar músculos inervados por las cinco ramas terminales del facial: las ramas temporales, las cigomáticas, las bucales, la marginal de la mandíbula y la del cuello. Según la literatura, la porción más frecuentemente afectada es la primera, a nivel del ganglio geniculado (1, 2, 5, 6).
En cuanto a la valoración del grado de motilidad muscular, es reconocida la clasificación de House-Brackman la cual valora la mortalidad del músculo frontal, el orbicular de los ojos y de los labios y hace una clasificación del grado I al VI, dependiendo de la severidad del compromiso muscular (18). La clasificación de la severidad en cuanto a la motilidad muscular utilizada en nuestro servicio cuantifica de 0 a 3 la función muscular del frontal, el orbicular del ojo, el elevador de la nariz, el cuadrado del mentón, el orbicular de los labios y el platisma; la apariencia facial en reposo se cuantifica de cero a dos. El puntaje máximo es de 20 y la suma de estos datos se multiplica por cinco y lo restamos de cien infiriendo el porcentaje del déficit del nervio facial (19).
Basados en la evidencia de que el virus HTVL-1 es endémico en la región pacífica colombiana, se han buscado relaciones casuales con diversas enfermedades. La paraparesia espástica tropical fue la enfermedad que inicialmente se asoció a estos virus; sin embargo, estudios ulteriores demostraron que existe también relación causal con enfermedades como el síndrome de Sjögren, leucemias y varias condiciones inflamatorias.
Revisando la literatura se encontraron dos estudios que presentaban al virus HTLV-1 como agente relacionado con la PFI. Esta enfermedad es frecuente en los servicios de Urgencias en Otorrinolaringología y sería importante abrir un poco más el enfoque que se le da a la enfermedad.
Marco Teórico
Una de las enfermedades que llevan a consultar al Otorrinolaringólogo con mayor frecuencia es la parálisis facial Estudios electrofisiológicos sirven como ayuda para inferir daño del nervio y pronóstico. La electroneuronografía expresa la relación entre la respuesta y el número de fibras funcionales. La electromiografía predice la regeneración del nervio facial paralisado (9). En Paraparesia Espástica Tropical (PET) se han encontrado retrasos con las latencias en el siguiente orden de frecuencia (31):
– Somatosensoriales de extremidades inferiores
– Somatosensoriales de extremidades superiores
– Visuales
– Cerebrales
La parálisis facial debe ser considerada como una urgencia médica y del pronto inicio del tratamiento depende la recuperación del nervio. La literatura apoya el uso de prednisolona en dosis de 1mg/kg/día durante los siete primeros días de la parálisis (4). El Acyclovir es discutido pero se está manejando por algunas escuelas con dosis de 400 mg cinco veces al día durante los diez siguientes días a la parálisis (10, 11, 21). El tratamiento quirúrgico se tiene en cuenta cuando la causa es traumática y hay que descomprimir en alguna porción, cuando se trata de un tumor o en casos de colesteatoma (22). Podría ser necesaria una timpanotomía para drenar el líquido del oído medio que en caso de otitis media efusiva podría desarrollar la parálisis (23).
Cada día se crean nuevas expectativas para encontrar nuevos factores etiológicos de la parálisis facial, incluso ya se habla de asociación de esta enfermedad con el virus varicela zoster y HTVL-1 (12-14).
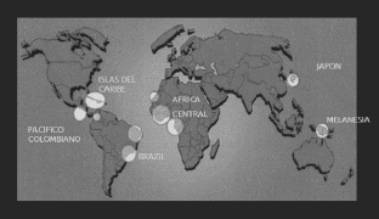
El virus HTVL-1, en retrovirus humano aislado en 1980 (14), es altamente endémico en el Japón, las islas del Caribe, noreste de Sudamérica y Africa Central (figura 1). Existen de 15 a 20 millones de personas infectadas en el mundo, pero más del 90% de ellos son asintomáticos. La transmisión se da por lactancia materna, contacto sexual y transfusiones sanguíneas.
Se ha asociado a varias enfermedades como la leucemia de células T del adulto (24), la Paraparesia Espástico Tropical (25, 26) y a varias condiciones inflamatorias como polimiositis, poliartritis, uveitis y síndrome de Sjögren (27,28).
La inmunopatogénesis del HTLV-1 asociado a cualquiera de estas enfermedades no es clara aún; se sabe poco sobre los factores que determinan la infección y el neurotrofismo del virus. Hay tres hipótesis para explicar esto.
La hipótesis citotóxica está basada en la alta frecuencia en sangre periférica y líquido cefalorraquídeo de células T CD-8 citotóxicas específicas para una proteína. Esto predice la respuesta citotóxica contra células blanco infectadas como responsable para la destrucción tisular y por ende una desmielinización progresiva. Otra hipótesis sugiere que la desmielinización es secundaria a una respuesta inmune contra células T CD-4 infectadas con el virus HTLV-1 en el Sistema Nervioso Central. La otra hipótesis, la autoinmune, propone la presencia de células T autorreactivas que cambian al ser infectadas por el virus y determinan la especificidad de la respuesta destructiva al tejido (29, 39).
En estudios experimentales se han utilizado la metilprednisolona y la pentoxifilina para el tratamiento del paciente sintomático, pero no hay resultados concluyentes (24).
* Residente II año, Otorrinolaringología. Universidad del Valle. Cali, Colombia.
** Residente II año, Otorrinolaringología. Universidad del Valle. Cali, Colombia.
*** Internista. Docente Titular. Jefe del Departamento de Morfología. Universidad del Valle. Cali, Colombia.
**** Jefe del Departamento de Otorrinolaringología. Hospital Uni- versitario del Valle. Cali, Colombia.
Materiales y Métodos
Se incluyen en este estudio prospectivo todos los casos de PFI que consultaron al Servicio de Urgencias de Otorrinolaringología del Hospital Universitario del Valle en un período comprendido entre octubre de 1999 y febrero de 2000. Los pacientes del grupo de casos son aquellos con PFI de cualquier edad, cualquier sexo y raza. Se escoge como grupo control los pacientes que consultan al Hospital por otras patologías al Servicio de Otorrinolaringología, tratando de conservar las mismas características del grupo de casos. Se evalúan en total 46 muestras de suero de pacientes con PFI y 109 muestras de suero de casos controles, utilizando la técnica de seroaglutinación de partículas (Serodia-HTLV-1, Furijebio). Como programa estadístico se utilizó Epi-info y se analizaron, entonces, los resultados arrojados.
Resultados
Seroprevalencia del HTLV-1 en PFI en Cali, Colombia 2000
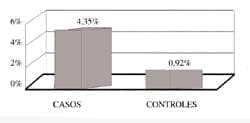
En el grupo de casos la prevalencia del virus HTLV-1 fue del 4,35% (2 de 46 pacientes), mientras que el grupo control fue del 0,91% (Figura 3). Estos dos pacientes con PFI y seroaglutinación positiva para HTLV-1, no eran procedentes del pacífico. Ambos eran de sexo femenino; una tenía 9 años y era de raza blanca, la otra tenía 70 años y era mestiza. Era el primer episodio de PFI para los dos pacientes. No habían recibido transfusiones previamente y no tenían antecedentes familiares de problemas neurológicos (paraparesias). La niña no tenía antecedente familiar de PFI, mientras que la paciente de 70 años tenía un antecedente familiar. En ambos casos la evolución al cabo de los dos meses que duró el seguimiento, fue satisfactoria, logrando un 100% de recuperación al final del estudio.
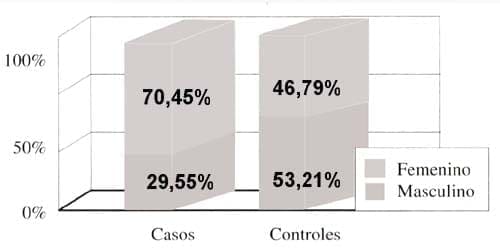
En el grupo control el 53,21% de los pacientes fueron hombres y el 46,79% fueron mujeres. En el grupo de casos, el 28,26% eran hombres y el 71,74% eran mujeres (Figura 4).
Discusión
La prevalencia del HTLV-1 en la población general fue de 0,91% y en el grupo de pacientes con PFI fue de 4,35%.
Aún no es claro el mecanismo por medio del cual este virus afectaría el nervio facial. Se podría tratar de un proceso de desmielinización rápidamente progresivo pero que recuperaría en un corto tiempo. Teniendo en cuenta que el virus HTLV-1 afecta directamente el cuerpo neuronal y no sus axones, esta propuesta sería poco viable.
Podría tratarse de un proceso inflamatorio ocasionado por el virus en el espacio perineural y esto llevaría a la liberación de los mastocitos, los cuales desencadenarán una cascada inflamatoria pudiendo comprometer el nervio facial, el cual se edematizará, llevando a una neuropraxia inmediata. Sólo cuando el proceso inflamatorio disminuya, podría verse la recuperación completa de la parálisis facial. Es posible ver ese fenómeno en otros nervios craneales.
En el grupo control, el 53,21% de los pacientes fueron hombres y el 46,79% fueron mujeres. En el grupo de casos, el 28,26% eran hombres y el 71,74% eran mujeres. La PFI fue más frecuente en las mujeres (7:3), y la distribución por sexo en la raza mestiza fue de 1:1. Los hombres tuvieron compromiso muscular mayor que las mujeres al inicio del cuadro.
Conclusiones
Queda en el ambiente la opción de que cada día la PFI comienza a ser menos idiopática al encontrarse poco a poco agentes etiológicos que, como en este caso, aunque no es una verdad absoluta, podrían explicar el desarrollo natural de la enfermedad.
El virus del HTLV-1 está asociado con varias enfermedades como: PET, síndrome de Sjögrem, linfomas, y posiblemente parálisis de Bell (PFI). Los resultados de este estudio muestran que existe una prevalencia alta en el grupo de pacientes con PFI, pero todavía faltan estudios con una población mayor y de inmunohistoquímica que explica
Abstract
One of the pathologies most frequently referred to otorhinolaryngology for study is facial paralysis. The majority are classified as idiopathic. In recent years, regions have been identified where infection by the type I human lymphotropic virus is endemic, among them the south-west of Colombia. There have been some reports of epidemiological association in these infections and cases of facial paralysis.
Since the Valle University Hospital is the main reference center for this region, this study was intended to establish the prevalence of serum antibodies against HTVL-I in patients with facial paralysis.
All the cases of idiopathic facial paralysis which had consulted the otorhinolaryngology service during a consecutive period of 4 months were included. A total of serum samples from 46 patients with idiopathic facial paralysis and from 109 follow-ups using agglutination of particles (Serodia-HTLV-I), Fujirebio, Tokyo) were evaluated and the prevalence of the HTVL-1 virus was found to be 4.35% in the group of cases and 0.91% in the subsequent check ups.
Key words: facial paralysis- HTVL-1 virus
Correspondencia: John Figueroa. Servicio de ORL. Hospital Universitario del Valle. Cali,Colombia.
Bibliografía
1. Croxon G, et al. Grading facial nerve function: House-Brackmann versus Burres-Fisch methods. Am J Otol 1990; 11:240.
2. Fisch U. Facial nerve surgery. Birminhan, Alabama: Aesculapius Publ Co 1997.
3. Hugues GB. Prognostic tests in acute facial palsy. Am J Otol 1989; 10: 304.
4. May M. The use of steroid in Bell’s palsy: a prospective controlled study. Laryngoscope 1976; 86: 906. 5. Paparella M, Scumrick D. Otolaryngology. Philladelphia: W. B. Saunders Co, 1994.
6. Adams G, Boies L. Jr. Otolaringología de Boies. Philadelphia: W. B. Saunders Co. 1992.
7. Delgado A. Anatomía humana funcional y clínica. Universidad del Valle, Cali 1994.
8. Fowler E. Variations in the temporal bone course of the facial nerve. Laryngoscope 1961; 71: 937- 46. 9. May M, Croxson G, Klein S. Bell’s palsy: management of sequellae using EMG rehabilitation,
botulinim toxin and surgery. Am J Otol 1989; 10: 220-9.
10. Ishii K, Kurata T, Hao MV, Nomura Y. An animal model of type-1 herpes simplex virus infection of facial nerve. Acta Otolaryngol (Supl) 1998; 446: 157-64.
11. Furuta Y, Fukuda S, Cfhida E, Takasu T, Ohtani T. Reactivations of herpes simple virus type 1 in patients with Bell’s palsy. J Med Virol 1998; 54(3): 162-6.
12. Bartholomew C, Cleghorn F, Jack N, Edwards J, Blattner W. Human T-cell lymphotropic virus type 1 associated facial nerve palsy in Trinidad and Tobago. Ann Neurol 1997; 41 (6): 806-9.
13. Michel P, Develoux M, Talarmin F, et al. Phatologies associated with HTLV-1 virus in Dakar (1992-1995). Med Trop 1996; 56 (3): 249-54.
14. Poiesz BJ, Ruscetti FW. Detection and isolation of type C retrovirus particles form fresh and cultured lymphocytes of a patient with cutaneous T cell lymphoma. Proc Natl Acad Sci USA 1980; 77: 7415.
15. Selesnick S, Patwardhan A. Acute Facial Paralysis: Evaluation and early management. American Journal of Otolaryngology 1994; (15) 6: 387-408.
16. Leslie PA, Zinreich SJ. Facial nerve imaging. Otolaryngol Clin North Am 1991; 24: 571-85.
17. Fisch U. Management of intratemporal facial nerve injuries. Journal of Laryngol Otol 1980; 94: 129-34. 18. House JW, Brackman DE. Facial nerve grading system. Otolaryngol Head Neck Surg 1985; 93: 146-7.
19. Blanco PA. Semiología clínica e instrumental en otorrinolaringología. Universidad del Valle 1987; 61.
20. Peiterson E. The natural history of Bell’s palsy. Am J Otol 1982; 4: 107-11.
21. Devriese PP, Moesker WH. The natural history of facial paralysis in herpes zoster. Clin Otolaryngol 1988; 13: 289-98.
22. Pollock RA, Brown LA. Facial paralysis in otitis media, in Graham MD, House WF (eds). Disorders of the facial nerve. New York: Raven 1982. p. 221-4
23. Savic DI, Dheric DR. Facial paralysis in chronic suppurative otitis media. Clin Otolaryngol 1989; 14: 515-7.
24. Takasuki K, Uchiayama T, Sagawa K. Adult T cell leukemia in Japan. In Topics in hematology. Amsterdam: Excerpta Medica eds, 1977. p. 77 1977.
25. Gessain A, Barin E, Bvernant JC. Antibodies to human T-lymphotropic virus type-1 in patients with tropical spastic paraparesis. Lancet 1985; 407.
26. Osame M, Usuku K. HTLV-1 associated myelopathy, a new clinical entity. Lancet 1986; 1031.
27. Morgan O, Rodgers-Johnson P, Mora C. HTLV-1 and polymyositis in Jamaica. Lancet 1989; 1184.
28. Nishioka K, Maruyama I. Chonic inflammatory arthropathy associated with HTLV-1. Lancet 1989; 441. 29. Jacobson S. Role of cellular immune responses in the pathogenesis of HTLV-1 associated neurologic disease. In: Höllsberg P, Hafler DA eds. Human T cell lymphotropic virus type 1. Chichester, Wiley and Sons, 1996.
30. Höllsberg P, Hafler DA. What is the pathogenesis of human T-cell lymphotropic virus type 1 associated myelophaty? Tropical spastic paraparesis? Ann Neurol 1995; 37: 143-5.
31. Osame M, Nagakun M, Izumo S. HTLV-1 associated myelophaty/tropical spastic paraparesis. Adult T-cell leukemias. Tokio: Ed. Takatsuky. Oxford Medical Publication 1995. p. 162-80
CLIC AQUÍ Y DÉJANOS TU COMENTARIO