Diagnóstico por imágenes
A lo largo de tiempo las pruebas imagenológicas enfocadas al estudio del paciente con EGB se basaron específicamente en la realización de técnicas de Gammagrafía (Centellografía). En la actualidad, algunos algoritmos diagnósticos aún sitúan a esta modalidad diagnóstica como primera elección en el proceso de estudio del paciente con EGB; sin embargo, el acceso limitado a dicha técnica de imagen, y el uso cada vez más generalizado de la ultrasonografía ha originado que las indicaciones de la Gammagrafía cada vez sean menores, sin que esto reste la importancia y el sitial que bien ganada tiene esta última.
La ecografía en pacientes con EGB usualmente demuestra una glándula aumentada de tamaño, con baja ecogenicidad tiroidea; en la evaluación del flujo sanguíneo con Doppler a color se demuestra un aumento marcado y difuso del flujo sanguíneo intratiroideo, dicho incremento se correlaciona bien con la captación de yodo –en la gammagrafía- y con los valores de las hormonas tiroideas; dicho componente vascular se ha denominado “Infierno Tiroideo”, que corresponde a un patrón de mosaico de distintos colores, como manifestación de la vibración tisular producida por los shunts arteriovenosos; en la evaluación ecográfica se tienen en cuenta ciertas variables imagenológicas, entre esas se destacan el tamaño tiroideo, la vascularidad y la Velocidad del Pico Sistólico (VPS) de la Arteria Tiroidea Inferior (ATI), en general, los pacientes con EGB sin tratamiento y con enfermedad activa muestran un aumento del tamaño glandular, aumento de la vascularidad y del flujo sanguíneo tiroideo (establecido por el aumento de la VPS de la ATI; además, se ha sugerido que la vascularidad glandular podría predecir el curso de la enfermedad a largo plazo, bajo terapia médica; desde el punto de vista fisiopatológico es claro que el hipertiroidismo induce un aumento del flujo sanguíneo arterial, con un incremento del gasto cardiaco, pero el aumento del flujo sanguíneo intratiroideo no es exclusivo de la EGB, ya que también puede presentarse en la enfermedad de Hashimoto –con hipotiroidismo-, por lo que algunos autores recomiendan que junto a la medición de la VPS de la ATI concomitantemente se evalúe la VPS de las arterias carótidas comunes(55,56). Otra ventaja de la ecografía tiroidea es el rendimiento diagnóstico que tiene para detectar la presencia de nódulos –los cuales podrían no ser detectados ni por la gammagrafía ni al examen físico, pero pueden hacer parte del espectro de presentación de la EGB-. A futuro es probable que la ecogenicidad glandular permita determinar con mayor precisión la dosis de I-131 que se calcula como tratamiento de la EGB, en los pacientes candidatos a esta modalidad terapéutica.
La gammagrafía tiroidea se lleva a cabo con una cámara de Centellografía gamma, las imágenes obtenidas tienen varias proyecciones: Oblicua, anterior y posterior; los detalles morfológicos de la glándula se obtienen utilizando algunos “Radionúclidos”, entre esos están el Pertecnectato de Tecnecio 99 (Tc99m) el I-123 y el I-131. Cuando se utiliza el Tc99m las imágenes se obtienen a los 20 minutos después de su administración (dosis de 10 mCi −370 MBq-). Al utilizar I-123 las imágenes se obtienen a las 4-24 horas después de la ingestión, y al usar I-131 las imágenes se obtienen a las 24-72 horas después de ingerido, se debe tener en cuenta que el istmo tiroideo puede mostrar menor actividad que el lóbulo derecho e izquierdo glandular.
El uso de estas técnicas de imágenes permitedeterminar el estado funcional de la glándula y además permite establecer la presencia de nódulos con características de malignidad (“hipocaptantes o hipercaptantes”) El Tc99m evalúa en cierta forma la funcionalidad, pero más que todo la morfología, ya que la glándula atrapa el Tc99m pero no lo organifica, mientras que en el caso del I-123 y el I-131 la tiroides los atrapa y los organifica, de allí que por ejemplo, el I-131 se utiliza para obtener la captación del yodo tiroideo en 24 horas y la captación tiroidea refleja el porcentaje de la dosis suministrada al paciente y que además acumula en su glándula, el rango de captación normal en 24 horas es de 10 a 30% (después de una dosis de 5 μCi −0.19 MBq- de I-131). Lo mismo se aplica para el I-123 (para éste se utiliza una dosis de 300 μCi −11.11 MBq-).
La cantidad de radiación liberada a la tiroides por el I-123 es del 1% de la radiación liberada por la misma cantidad de I-131, es por eso que se prefiere el I-123 sobre el I-131 (57). Al evaluar el funcionamiento glandular con I-131 ó I-123 se encuentra un aumento de la captación de trazador, la cual es generalmente homogénea, pero existen casos donde la captación a las 4-6 horas está elevada y es normal a las 24 horas, lo anterior se presenta como resultado de una depuración acelerada del yodo radioactivo. Ciertosmedicamentos como los medios de contraste yodado, anti-tiroideos, hormona tiroidea, algunos antibióticos y antihistamínicos pueden reducir el rango de captación (58,59). Ocasionalmente la enfermedad nodular tiroidea puede acompañar a la EGB, su presencia es variable, pero puede alcanzar tasas del 25-30%; un alto porcentaje de esos pacientes tienen nódulos “hipoactivos”, pero un número mínimo de pacientes pueden tener nódulos “hiperactivos o autónomos”; a éstos sujetos que tienen tirotoxicosis originada por EGB y bocio nodular tóxico se les conoce con el epónimo de “Síndrome de Marine-Lenhart”, en estos casos se puede encontrar una glándula con un aumento difuso en la captación, con zonas de “realce” en una u otras zonas que se corresponden con nódulos hallados en la ecografía (nódulos funcionales autónomos en personas con EGB), dicha característica se presenta en el 0,8-2,7% de sujetos con EGB (60,61).
Diagnóstico histopatológico
En la EGB desde el punto de vista macroscópico, se encuentra una glándula que puede estar leve a moderadamente aumentada de tamaño, este aumento es simétrico, compromete ambos lóbulos y al istmo, su superficie es vascularizada y generalmente lisa, ocasionalmente se evidencia modularidad ligera. La superficie de corte es blanda, mostrando una coloración rojiza, la cual se presenta por la marcada vascularización presente en la glándula, puede observarse fibrosis ligera, generalmente en los casos que han recibido tratamiento previo con Tionamidas, en los casos con curso prolongado en el tiempo la glándula puede tomar una coloración pardo-amarillenta y tener consistencia friable.
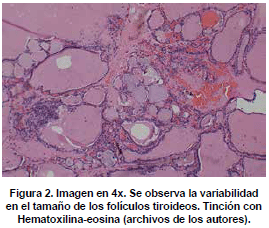
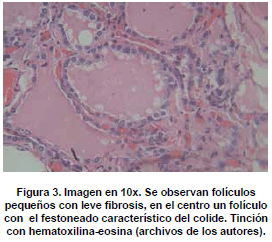
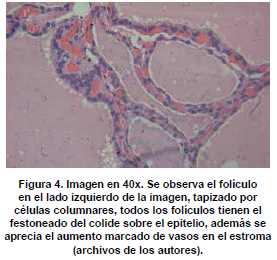
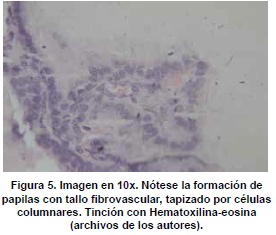
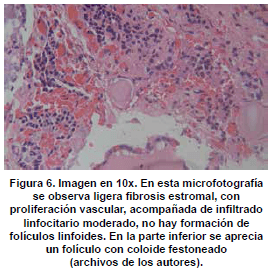
Microscópicamente, se observan folículos tiroideos de diferentes tamaños, los cuales pueden ser hiperplásicos o muy pequeños, algunos folículos tienen formación prominente de papilas, que se pueden confundir en ocasiones con el carcinoma papilar de tiroides, los núcleos están tapizados por células columnares, las cuales tienen el núcleo localizado hacia la base, redondo u ovalado, de bordes regulares, la cromatina es finamente granular sin atipias; los núcleos en el aspirado pueden exhibir una vacuola citoplasmática clara, marginal, adyacente al núcleo y se denominan células flama, las cuales exhiben un nucléolo pequeño, sin barra nuclear o vacuola intranuclear, hallazgos también característicos del carcinoma papilar. El citoplasma de los tirocitos en la EGB puede tomar una coloración rosada o anfofílica, con un aspecto granular o microvacuolado. El coloide es de coloración mas pálida que lo usual, vacuolado, con presencia de un festoneado adyacente al epitelio, que indica actividad de la célula folicular. En casos de larga data, se describe metaplasia de células de Hürthle, la cual es leve, a diferencia de lo que usualmente se aprecia en la tiroiditis de Hashimoto (62). En el estroma se observa un aumento leve del infiltrado linfocitario, en ocasiones este infiltrado puede ser mayor, incluso formando folículos linfoides. El tratamiento con yodo radioactivo produce pleomorfismo de las células foliculares, disolución de folículos y alteraciones vasculares, con el tiempo se puede observar algún grado de formación de nódulos, atrofia folicular y fibrosis. En estudios de microscopia electrónica se observan depósitos de complejos inmunes en la membrana basal folicular. En el exoftalmos se observa a nivel de los músculos periorbitarios marcado edema interfibrilar, perdida de la estriación de las fibras musculares e infiltración difusa de linfocitos (63,64). En la piel, es común observar un marcado edema de la dermis papilar y reticular, con actividad nuclear de los fibroblastos, este edema, toma una coloración azul en la coloración de alcian blue, demostrando la positividad de los mucopolisacáridosproducidos por los fibroblastos activos y secretados hacia la matriz extracelular (Ver figuras 2,3,4,5 y 6) .
 |
 |
 |
 |
AGRADECIMIENTOS
Al departamento de Medicina Interna de la Facultad Ciencias de la Salud de la Universidad del Cauca.
FINANCIACIÓN
El trabajo actual ha sido financiado por recursos propios de los autores.
CONFLICTOS DE INTERÉS
Los autores del artículo declaran no tener conflictos de intereses en la realización del artículo.
REFERENCIAS
1. Flajani G, 1802 Sopra un tumor freddonell’anterior parte del collo broncocele (Osservazione LXVII).
Collezioned’osservazioni e reflessioni di chirurgia, Rome, Milano, A Ripa Presso Lino Contedini 3:270-273 2. Testa AG.Dellemalattie del cuore, loro cagioni, specie, segni e cura. Bologna, secondaedizione. 3 volumes, 1810.
3. Parry CH 1825 Enlargement of the thyroid gland in connection with enlargement or palpitations of the heart. In: Collections from the unpublished medical writings of H. Parry, London; pp, 111-129.
4. Graves RJ, 1835 New observed affection of the thyroid gland in females. London Medical and Surgical Journal. 7:516-517.
5. Basedow C A. March 28th 1840 Exophthalmos durch Hypertrophie des Zellgewebes in der Augenhöhle. Wochenschrift fur die gesammte Heilkunde Berlin. 6:197-220.
6. Young P, Finn BC, Bruetman JE. La enfermedad de Graves, signos y síntomas. An Med Interna (Madrid) 2007;24:505-508.
7. McKenna TJ. Graves’ disease. Eponym. Lancet 2001; 357:1793-1796.
8. McLeod Donald SA, Cooper DS. The incidence and prevalence of thyroid autoimmunity.Endocrine 2012; 42:252-265.
9. Baltisberger B, Minder C, Burgi H. Decrease of incidence of toxic nodular goitre in a region of Switzerland after full correction of mild iodine deficiency. Eur J Endocrinol.1995; 132:546-549.
10. Golden SH, Robinson KA, Saldanha I, Anton B, Ladenson PW. Prevalence and Incidence of Endocrine and Metabolic Disorders in the United States: A Comprehensive Review.J Clin Endocrinol Metab. 2009; 94:1853-1878.
11. Abraham-Nordling M, Torring O, Lantz M, Hallengren B, Ohrling H, Lundell GJ, et al. Incidence of hyperthyroidism in Stockholm, Sweden, 2003-2005. Eur J Endocrinol. 2008; 158(6):823-827.
12. Manji N, Carr-Smith JD, Boelaert K, Allahabadia A, Armitage M, Chatterjee VK, et al. Influences of age, gender, smoking, and family history on autoimmune thyroid disease phenotype. J Clin Endocrinol Metab 2006; 91:4873-4880.
13. Ploski R, Szymanski K, Bednarczuk T. The GeneticBasis of Graves’ Disease.Current Genomics. 2011; 12:542-563.
14. Ban Y. “Genetic Factors of Autoimmune Thyroid Diseases in Japanese,” Autoimmune Diseases, vol. 2012, Article ID 236981, 9 pages, 2012. doi:10.1155/2012/236981.
15. Davies TF, Latif R, Yin X, “New Genetic Insights fromAutoimmune Thyroid Disease, “Journal of Thyroid Research, vol. 2012, Article ID 623852, 6 pages, 2012. doi:10.1155/2012/623852.
16. Clayton DG, McKeigue PM. Epidemiological methods for studying genes and environmental factors in complex diseases. Lancet. 2001; 358:1357-1360.
17. Lohmueller KE, Pearce CL, Pike M, Lander ES, Hirschhorn JN. “Meta-analysis of genetic association studies supports a contribution of common variants to susceptibility to common disease”. Nat Genet. 2003; 33:177-182.
18. Weetman AP. The genetics of autoimmune thyroid disease. Horm Metab Res. 2009 41(6):421-425.
19. Gu LQ, Zhu W, Zhao SX, Zhao L, Zhang MJ, Cui B, Song HD, Ning G, Zhao YJ. Clinical associations of the genetic variants of CTLA-4, Tg, TSHR, PTPN22, PTPN12 and FCRL3 in patients with Graves’ disease. ClinEndocrinol (Oxf). 2010;72(2):248-55.
20. Sibarani RP. Genetics of Graves’ disease: the lost concept. Acta Med Indones. 2009;41(1):37-40.
21. Brand OJ, Gough SCL. Immunogenetic Mechanisms Leading to Thyroid Autoimmunity: Recent Advances in Identifying Susceptibility Genes and Regions. Curr Genomics. 2011; 12(8): 526–541.
22. Holm IA, Manson JE, Michels K, et al. Smoking and Other Lifestyle Factors and the Risk of Graves’ Hyperthyroidism. Arch Intern Med. 2005; 165:1606-1611.
23. Ando T, Imaizumi M, Graves PN, Unger P, Davies TF. Intrathyroidal Fetal Microchimerism in Graves’ Disease. J Clin Endocrinol Metab. 2002; 87: 3315-3320.
24. Brent GA, “Clinical practice. Graves’ disease,” NEngJMed. 2008; 358(24): 2594-2605.
25. Fadel BM, Ellahham S, Ringel MD, Lindsay J, Wartofsky L, Burman KD. Hyperthyroid heart disease. Clin Cardiol.2000; 23:402-408.
26. Mansourian AR. A review of literature on the AdverseEffects of Hyperthyroidism on the Heart Functional Behavior. Pakistan Journal of Biological Sciences.2012; 15:164-176.
27. Ebert EC, “The thyroid and the gut”. J ClinGastroenterol. 2010; 44(6):402-406.
28. Maser C, Toset A, Roman S. Gastrointestinal manifestations of endocrine disease.World J Gastroenterol. 2006; 12 (20):3174-3179
29. Burman KD, McKinley-Grant L. “Dermatologic aspects of thyroid disease”. Clinics in Dermatology. 2006; 24(4):247-255.
30. Doshi DN, Blyumin ML, Kimball AB. “Cutaneous manifestations of thyroid disease”. Clinics in Dermatology. 2008; 26(3):283-287.
31. Niepomniszcze H, Amad RH. Skin disorders and thyroid diseases. J Endocrinol Invest. 2001; 24(8):628-638.
32. Yudiarto FL, Muliadi L, Moeljanto D, Hartono B. Neuropsychological findings in hyperthyroid patients. Acta Med Indones. 2006; 38(1):6-10.
33. Canton A, de Fabregas O, Tintore M, Mesa J, Codina A, Simo R. Encephalopathy associated to autoimmune thyroid disease: a more appropriate term for an underestimated condition? . J Neurol Sci. 2000; 176:65-69.
34. Doherty C. Neurologic Manifestations of Thyroid Disease. The Neurologist.2001; 7:147-157.
35. Wiersinga WM, Smit T, van der Gaag R, Mourits M, Koornneef L. Clinical presentation of Graves’ ophthalmopathy. Ophthalmic Res.1989; 21:73-82.
36. Pérez Moreiras JV, Prada Sánchez MC, Coloma J,et al. Oftalmopatía distiroidea. En: Pérez Moreiras JV, Prada Sánchez C. Patología orbitaria. Exploración, diagnóstico y cirugía. Barcelona: Edika Med 2002; 2: 940-990.
37. Gaddipati RV, MeyerDR. Eyelid Retraction, Lid Lag, Lagophthalmos, and von Graefe’s Sign. Quantifying the Eyelid Features of Graves’ Ophthalmopathy. Ophthalmol. 2008;115:1083-1088.
38. Fernández-Hermida RV, Pinar S, Muruzábal N. Manifestaciones clínicas de la oftalmopatía tiroidea. An. Sist. Sanit. Navar. 2008; 31 (Supl. 3): 45-56.
39. Li JH, Safford RE, Aduen JF, Heckman MG, Crook JE, Burger CD. Pulmonary Hypertension and Thyroid Disease. CHEST.2007;132(3):793-797.
40. Armigliato M, Paolini R, Aggio S, Zamboni S, Galasso MP, Zonzin P, Cella G. Hyperthyroidism as a cause of pulmonary arterial hypertension: a prospective study. Angiology. 2006; 57(5):600-606.
41. Mariani LH, Berns JS. The Renal Manifestations of Thyroid Disease. JASN. 2012; 23(1): 22-26.
42. Dhanwal DK. Thyroid disorders and bone mineral metabolism. Indian J Endocrinol Metab.2011; 15:S107-112.
43. Mosekilde L, Eriksen EF, Charles P. Effects of thyroid hormones on bone and mineral metabolism. EndocrinolMetabClin North Am.1990; 19:35-63.
44. Kendall-Taylor P. Thyrotoxicosis. In: Grossman A, ed. Clinical endocrinology. Oxford, England: Blackwell Science, 1998:328-358.
45. Trzepacz PT, Klein I, Roberts M, Greenhouse J, Levey GS. Graves’ disease: an analysis of thyroid hormone levels and hyperthyroid signs and symptoms. Am J Med.1989; 87:558-561.
46. Hegazi MO, Ahmed S, “Atypical Clinical Manifestationsof Graves’ Disease: An Analysis in Depth,” Journal of Thyroid Research, vol. 2012, Article ID 768019, 8 pages, 2012. doi:10.1155/2012/768019.
47. Kalra S, Khandewal SK, Goyal A. Clinical Scoring Scales in Thyroidology: A Compendium. Indian J Endocrinol Metab. 2011; 15(Suppl 2):S89-S94.
48. Klein I. Clinical, metabolic and organ-specific indices of thyroid function. Endocrinol Metab Clin N Am. 2001; 30(2):415-427.
49. Klein I, Trzepacz PT, Roberts M, Levey GS. Symptom rating scale for assessing hyperthyroidism. Arch Intern Med. 1988; 148:387-390.
50. Nayak B, Hodak SP. Hyperthyroidism. Endocrinol Metab Clin N Am. 2007; 36(3):617-656.
51. Ross DS. Serum Thyroid-Stimulating Hormone Measurement for Assessment of Thyroid Function and Disease. Endocrinol Metab Clin N Am. 2001;30(2):245-264.
52. Dufour RD. Laboratory Tests of Thyroid Function: Uses and Limitations. Endocrinol Metab Clin N Am. 2007; 36:579–594.
53. Kamath C, Adlan MA, Premawardhana LD. The Role of Thyrotrophin Receptor Antibody Assays in Graves’ disease. J Thyr Res Vol 2012, Article ID 525936, 8 pages doi:10.1155/2012/525936.
54. Lytton SD, Kahaly GJ. “Bioassays for TSH-receptor autoantibodies: an update,” Autoimmunity Reviews. 2010; 10(2):116-122.
55. Soto GD, Halperin I, Squarcia M, Lomeña F, Domingo MP. Update in thyroid imaging. The expanding world of thyroid imaging and its translation to clinical practice. Hormones (Athens). 2010; 9(4):287-298.
56. Chaudhary V, Bano S. Imaging of the Thyroid: Recent Advances. Indian J Endocr Metab.2012; 16:371-376.
57. Meller J, Becker W. The continuing importance of thyroid scintigraphy in the era of high-resolution. Ultrasound. Eur J Nucl Med.2002; 29(Suppl 2):425-438.
58. Piga M, Cocco MC, Serra A, Boi F, Loy M, Mariotti S. The usefulness of 99mTc-sestaMIBI thyroid scan in the differential diagnosis and management of amiodarone-induced thyrotoxicosis. Eur J Endocrinol. 2008; 159(4):423-429.
59. Iagaru A, McDougall IR. Treatment of thyrotoxicosis. J Nucl Med. 2007; 48:379-389.
60. Intenzo C, Jabbour S, Miller JL, Ahmed I, Furlong K, Kushen M, Kim SM, Capuzzi DM. Subclinical hyperthyroidism: current concepts and scintigraphic imaging. ClinNucl Med. 2011;36(9):e107-113.
61. Brahma A, BeadsmooreC, DhatariyaK.The Oldest Case of Marine Lenhart
syndrome?J R Soc Med Sh Rep. 2012; 3:21.
62. LiVolsi VA. The pathology of autoimmune thyroid disease: a review. Thyroid. 1994;4:333-339.
63. Kumarasinghe MP, De Silva S. Pitfalls in cytological diagnosis of autoimmune thyroiditis. Pathol 1999;31:1-8.
64. Baloch Z, LiVolsi VA. Pathology of the Thyroid Gland. Philadelphia, PA: Churchill Livingstone; 2002:61-88.
Fecha de recibido: Febrero 20, 2013.
Fecha de aprobado: Marzo 4, 2013
Dirección para correspondencia:
Hernando Vargas U.
hernandovargasu10@yahoo.com