RESULTADOS
Familia 2. La secuenciación de los productos de PCR permitió identificar en el propósito (IV.1) de la familia 2, el cambio de una valina por una leucina en el codón 264 (V264L) como se muestra en la figura 1. Adicionalmente, la mutación fue identificada en la madre (III.2) y en su tío (III.3), sin embargo no se encontró en el padre (III.1) ni en la abuela materna (III.4). El abuelo (II.3) no estaba disponible pero su hermano gemelo (II.2), al cual se le realizó la caracterización molecular, no presentó la mutación, así como tampoco su hija (III.10), como se muestra en la figura 2.
En cuanto al análisis de las pruebas hormonales realizadas al propósito de la familia 2, se obtuvieron valores elevados para: T3 total; 3,54 nmol/L (rango normal, 1.1 – 3.3 nmol/L), T4 total; 233,5 nmol/L (rango normal, 58 – 161 nmol/L) y T4 libre; 2,34 ng/ dL (rango normal, 0,7-1,7 ng/dL). Sin embargo los valores de TSH obtenidos, se encuentran dentro del rango; 3,43 uUI/mL (rango normal, 0.4-4.0 uUI/mL).
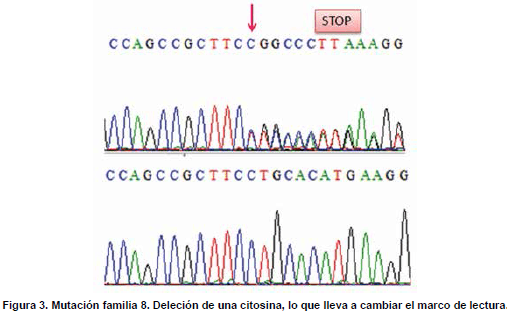
Familia 8. En el propósito de la familia 8, se identificó la deleción de una citosina en el nucleótido 1609 del gen TRβ, que lleva a un cambio en el marco de lectura y finalmente a un codón de parada en la posición 442, como se muestra en la figura 3. El paciente es heterocigoto para la mutación, ya que presenta un alelo mutado y un alelo silvestre. Además, la mutación no está presente en ninguno de los padres ni en sus dos hermanas sanas, por lo tanto son homocigotos para el tipo silvestre del gen TRβ. Lo anterior sugiere un evento mutacional de novo en el exón 10 del gen TRβ, la cual se denominó 1609delC.
Por último, según las pruebas hormonales realizadas a los propósitos de ambas familias, las concentraciones de T3 total, T4 total y T4 libre son muy elevadas aunque la concentración de TSH se encuentra dentro del rango normal.


El propósito de la familia 8, presentó una concentración de T3 total mayor a 12.3 nmol/L (rango normal, 1.38- 2.8 nmol/L), de T4 total mayor a 386 nmol/L (rango normal 64-154 nmol/L) y de T4 libre mayor a 12ng/dl (0,8-2,7 ng/dl). En la prueba TSH se obtuvo un valor de 2,7μUI/ml y la gammagrafía mostró bocio simple normocaptante IA: 3,2. Estos resultados muestran que el propósito presenta concentraciones muy elevadas de T3 total y T4 total, así como también de T4 libre, lo que se ajusta con el fenotipo de RTH. Sin embargo, se observó que tiene niveles normales de TSH, ya que la concentración obtenida se encuentra dentro del rango establecido.
DISCUSIÓN
A nivel mundial, para el año 2002, ya se habían identificado 122 mutaciones diferentes en el gen TRβ en individuos con RTH pertenecientes a 300 familias. De estas familias, 285 presentaban sustituciones de un solo nucleótido, de las cuales 281 resultaron en cambio de aminoácido y 4 en codón de parada. La prevalencia de mutaciones de novo para este año era de 16.7% [8]. No obstante, para el año 2010 había más de 1000 casos de RTH publicados que involucraban 372 familias, de las cuales 183 fueron estudiadas en la Universidad de Chicago por el Dr. Samuel Refetoff y colaboradores. De estas 183 familias el 85% presentaban mutaciones en el gen TRβ y el 28% de estas mutaciones eran de novo [9].
En este estudio se lograron identificar dos mutaciones en el gen TRβ. La primera fue encontrada en un paciente colombiano de 3 años con sospecha clínica de RTH, ya que presentaba niveles elevados de TSH y T4 total, sin síntomas clásicos de hipertiroidismo. De esta manera, por medio de estudios moleculares se logró identificar y caracterizar una mutación de novo en el exón 10 del gen TRβ. Dicha mutación genera un cambio del marco de lectura y como consecuencia un codón de parada en la posición 442, que lleva a que la proteína no se traduzca completamente y por lo tanto se trunca, causando así un efecto dominante negativo. Debido a ello, la proteína mutada competirá con la proteína silvestre por los sitios de unión al ADN, disminuyendo de ésta manera la transcripción de genes esenciales para el buen funcionamiento del cuerpo. Así mismo, se identificó una nueva mutación no sinónima en el exón 8 de un paciente de 5 años de edad con sospecha clínica de RTH en el momento de la evaluación y en algunos de sus miembros, esta mutación lleva al cambio de una valina por una leucina en el codón 264. Es importante mencionar que algunos miembros de la familia presentan hipotiroidismo, por ejemplo, aunque el individuo III.2 tiene la mutación, su diagnóstico clínico es más consistente con hipotiroidismo.
Hay que resaltar que las mutaciones encontradas están situadas en los exones 8 y 10, los cuales hacen parte del dominio de unión a la hormona tiroidea y por lo tanto se deduce que dichas mutaciones podrían afectar la unión de T3 a su receptor, ya sea disminuyendo su afinidad o anulando completamente la unión. Esto traería como consecuencia un cambio en la expresión de genes regulados por el receptor o la inhibición absoluta de la transcripción de dichos genes. Así mismo, pueden afectarse las interacciones entre los correguladores (correpresor NCOR y coactivador SRC-1) y la proteína TRβ. Por un lado, al haber mutaciones en el TRβ, este podría disminuir o aumentar su afinidad por el correpresor NCOR lo que llevaría a que no se libere correctamente. Por otro lado, podría generarse una inhabilidad por parte del receptor para reclutar el coactivador, lo que llevaría a que no se de la unión del SRC al complejo formado por el receptor y la T3, disminuyendo la eficiencia de la transcripción de genes blanco, tales como los involucrados en el desarrollo del cerebro, el desarrollo del oído, el crecimiento óseo, el metabolismo y el ritmo cardíaco [10].
Lo anterior se ha demostrado en estudios previos, donde encontraron en la madre una mutación no sinónima en el exón 10 del gen TRβ en el codón 458 que llevaba a un cambio de una valina por una glicina, sin embargo en uno de sus hijos observaron una mutación de novo en el mismo exón que llevaba a un cambio de la valina por ácido glutámico, con estas mutaciones llevaron a cabo estudios de función. De esta manera, por medio de ensayos de movilidad electroforética (EMSA), se evidenció una deficiencia en la formación del complejo coactivador con el receptor mutado y la T3, por lo que concluyeron que mutaciones en el dominio de unión a la T3 y/o deficiencias en el receptor para reclutar el coactivador podrían causar un fenotipo severo de RTH [11].
Así mismo, se ha probado que mutaciones en el extremo carboxilo del receptor de la hormona tiroidea producen una inhabilidad del receptor para unirse al correpresor, siendo ésta una causa aparente del síndrome de resistencia a la hormona tiroidea, ya que genes que deberían ser suprimidos, para mantener la regulación de diferentes funciones, van a expresarse constantemente[12].