Dr. Germán Barón Castañeda, M.D.
La paciente generalmente se presenta con algún trastorno del ciclo.
Si hay amenorrea se inicia el estudio indicado de acuerdo a las pautas expuestas en el capítulo correspondiente. Si se sospecha que el problema anovulatorio es de un tiempo largo de evolución, siempre se recomienda practicar una biopsia de endometrio con el fin de descartar la hiperplasia. Y si no hay signos de androgenización como hirsutismo o virilismo, no es necesario medir los niveles séricos de andrógenos.
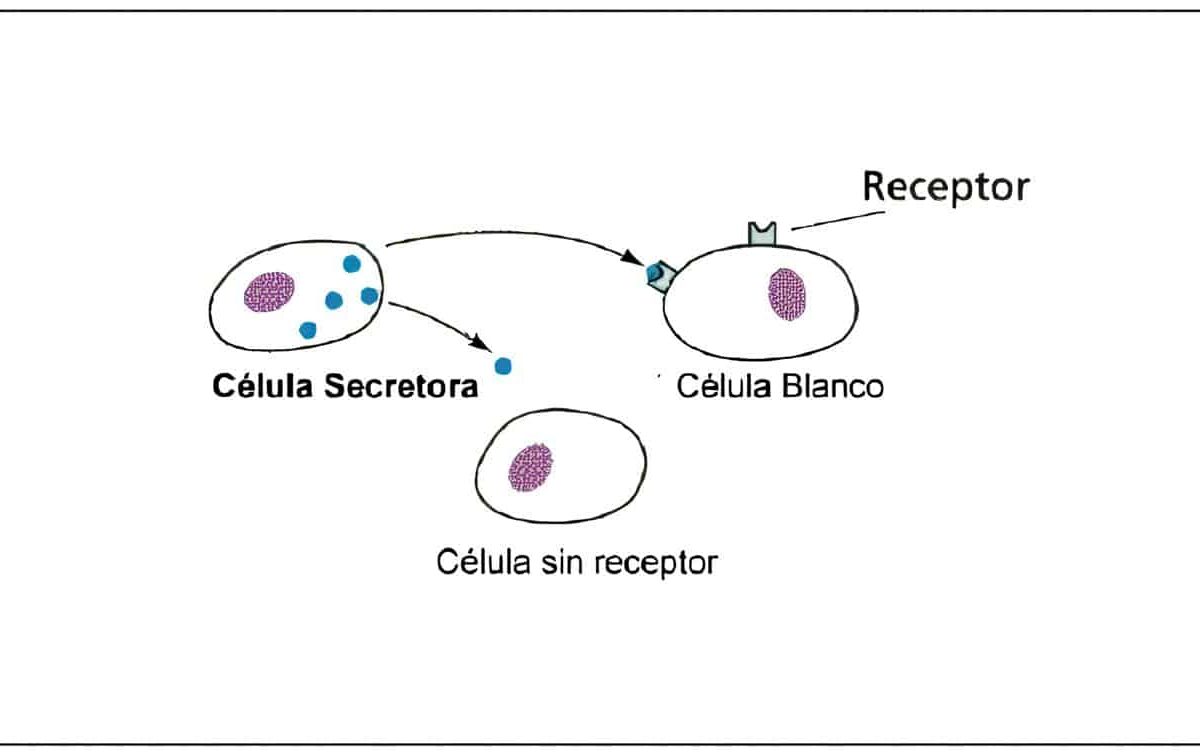
Aunque solo un pequeño porcentaje de las pacientes con síndrome de anovulación crónica tienen hiperprolactinemia o hipotiroidismo, se considera que estas son entidades que merecen un tratamiento específico, por lo cual siempre se recomienda como parte de la evaluación inicial solicitar niveles séricos de Prolactina y TSH.
El manejo depende de lo que se detecte en cada paciente.
En aquellas mujeres que han consultado por infertilidad se utilizan los esquemas corrientes de inducción de ovulación. Se ha postulado que en ellas hay un riesgo incrementado de aborto espontáneo, posiblemente por aumento en los niveles de LH, que alterarían el microambiente ovárico óptimo. Por lo tanto, en estas pacientes está indicado, cuando es posible, hacer antes de la inducción de ovulación una supresión total del eje hipotálamo – hipofisiario con análogos de GnRH. Y si después de tres ciclos no se ha logrado una adecuada respuesta folicular con el clomifeno, puede tener alguna utilidad el bloqueo de la producción suprarrenal de andrógenos; esto se logra con dosis bajas de corticoides, como 0.5 mg diarios de dexametasona o 5 mg de prednsisona.
Si la paciente no desea embarazo, la meta del tratamiento es interrumpir la exposición continua del endometrio y el tejido mamario a los estrógenos. Se puede indicar el manejo con acetato de medroxiprogesterona 10 mg diarios por doce días a partir del día 12 del ciclo. Si la paciente es sexualmente activa y quiere evitar la gestación, es aconsejable utilizar cualquiera de los anticonceptivos orales de microdosis.
Si la paciente presenta sobrepeso y se sospecha resistencia a la insulina, tiene mayor riesgo de problemas cardiovasculares. Es ideal lograr una reducción de por lo menos el 5% del peso inicial. Con esta sola medida en muchas ocasiones se puede romper el círculo vicioso de la anovulación.
Referencias
- Anttila L., Ding YQ., Ruutiainen K., et al. Clinical features and circulating gonadotropin, insulin, and androgen interactions in women with polycystic ovarian disease. Fertil Steril. 1991; 55: 1057.
- Berga SL., Mortola JF., Girton L., et al. Neuroendocrine aberrations in women with functional hypothalamic amenorrhea. J Clin Endocrinol Metab. 1989; 68: 301.
- Berga SL., Yen SCC. Opioidergic regulation of LH pulsatility in women with polycystic ovary syndrome. Clin Endocrinol. 1989; 30: 177.
- Burger CW., Korsen T., van Kessel H., et al. Pulsatile luteinizing hormone patterns in the follicular phase of the menstrual cycle, polycystic ovarian disease (PCOD) and non-PCOD secondary amenorrhea. J Clin Endocrinol Metab. 1985; 61: 1126.
- Buyalos RP., Geffner ME., Bersch N., et al. Insulin and insulin-like growth factor-I responsiveness in polycystic ovarian syndrome. Fertil Steril. 1992; 57: 796.
- Calaf J. Amenorrea de causa hipotalámica. En Vanrell JA., Calaf J., Balasch J., Viscasillas P. Fertilidad y esterilidad humanas. Salvat (1a). 1992: 109-118.
- Calaf J. Amenorrea de causa hipofisiaria. En Vanrell JA., Calaf J., Balasch J., Viscasillas P. Fertilidad y esterilidad humanas. Salvat (1a). 1992: 121-132.
- Calaf J. Estudio de la anovulación crónica y las amenorreas. En Vanrell JA., Calaf J., Balasch J., Viscasillas P. Fertilidad y esterilidad humanas. Salvat (1a). 1992: 189-200.
- Cataldo NA., Giudice LC. Follicular fluid insuline-like growth factor binding protein profiles in polycystic ovary syndrome. J Clin Endocrinol Metab. 1992; 74: 695.
- Casper RF., Greenblatt EM. Laparoscopic ovarian cautery for induction of ovulation in women with polycystic ovarian disease. Seminars Reprod Endocrinol. 1990; 8: 208.Chang RJ. Ovarian steroid secretion in polycystic ovarian disease. Seminars Reprod Endocrinol. 1984; 2: 244.
- Ciaraldi TP., El-Roeiy A., Madar Z., et al. Cellular mechanisms of insulin resistance in polycystic ovarian syndrome. J Clin Endocrinol Metab. 1992; 75: 577.
- Conover CA., Lee PDK., Kanaley JA., et al. Insulin regulation of insulin-like growth factor binding protein-1 in obese and non-obese humans. J Clin Endocrinol Metab. 1992; 74: 1355.
- Conway GS., Agrawal R., Betteridge DJ., et al. Risk factors for coronary artery disease in lean and obese women with polycystic ovary syndrome. Clin Endocrinol. 1992; 37: 119.
- Dahigren E., Johansson S., Lindstedt G., et al. Women with polycystic ovary syndrome wedge resected in 1956 to 1965: a long-term follow-up focusing on natural history and circulating hormones. Fertil Steril. 1992; 57: 505.
- Dale PO., Tanbo T., Vaaler S., et al. Body weight, hyperinsulinemia, and gonadotropin levels in the polycystic ovarian syndrome: evidence of two distinct populations. Fertil Steril. 1992; 58: 487.
- Dunaif A., Green G., Phelps RG., et al. Acanthosis nigricans, insulin action and hyperandrogenism: clinical, histological, and biochemical findings. J Clin Endocrinol Metab. 1991; 73: 590.
- Dunaif A., Segal KR., Futterweit W., et al. Profound peripheral insulin resistance, independent of obesity, in polycystic ovarian syndrome. Diabetes. 1989; 38: 1165.
- Erickson GF., Garzo VG., Magoffin DA. Insulin-like growth factor-I regulates aromatase acitivity in human granulosa and granulosa luteal cells. J Clin Endocrinol Metab. 1989; 69: 716.
- Erickson GF., Magoffin DA., Cragun R., et al.. The effects of insulin and insulin-like growth factors I and II on estradiol production by granulosa cells of polycystic ovaries. J Clin Endocrinol Metab. 1990; 70: 894.
- Escobedo LG., Lee NC., Peterson HB., et al. Infertility associated endometrial cancer risk may be limited to specific subgroups of infertile women. Obstet Gynecol. 1991; 77: 124.
- Elkind-Hirsch KE., Valdes CT., McConnell TG., et al. Androgen responses to acutely increased endogenous insulin levels in hyperandrogenic and normal cycling women. Fertil Steril. 1991; 55: 486.
- Erickson GF., Magoffin DA., Garzo VG., et al. Granulosa cells of polycystic ovaries: are they normal or abnormal? Hum Reprod. 1992; 7: 293.
- Falcone T., Bourque J., Granger L., et al. Polycystic ovary syndrome. Curr Probl Obstet Gynecol Fertil. 1993; 16: 65-95.
- Falcone T., Little B., Morris D. Impaired glucose effectiveness in patients with polycystic ovary syndrome. Hum Reprod. 1992; 7: 992-925.
- Fava M., Copeland PM., Schweiger U., et al. Neurochemical abnormalities of anorexia nervosa and bulimia nervosa. Am J Psychiatry. 1989; 146: 963.
- Franks S. Polycisitic ovary syndrome: a changing perspective. Clin Endocrinol. 1989; 31: 187.
- Gammon MD., Thompson WD. Polycystic ovaries and the risk of breast cancer. Am J Epidemiol. 1991; 134: 818.
- Gonzalez F., Hatala DA., Speroff L. Basal and dynamic hormonal responses to gonadotropin releasing hormone agonist treatment in women with polycystic ovaries with high and low dehydroepiandrosterone sulfate levels. Am J Obstet Gynecol. 1991; 165: 535.
- Haffner SM., Valdez RA., Hazuda HP., et al. Prospective analysis of the insulin-resistance syndrome (syndrome X). Diabetes. 1992; 41: 715.
- Imse V., Holzapfel G., Hinney B., et al. Comparison of luteinizing hormone pulsatility in the serum of women suffering from polycystic ovarian disease using a bioassay and five different immunoassays. J Clin Endocrinol Metab. 1992; 74: 1053.
- Insler V., Shoham Z., Barash A., et al. Polycystic ovaries in non-obese and obese patients: possible pathophysiological mechanism based on new interpretsation of facts and findings. Hum Reprod. 1993; 8: 379.
- Jalkanan J., Suikkari AM., Koistinen R., et al. Regulation of insulin-like growth factor-binding protein-1 production in human granulosa-lutheal cells. J Clin Endocrinol Metab. 1989; 69: 1174.
- Jialal I., Naiker P., Reddi K., et al. Evidence for insulin resistance in nonobese patients with polycystic ovarian disease. J Clin Endocrinol Metab. 1987; 64: 1066.
- Littley MD., Shalet SM., Beardwell CG., et al. Radiation-induced hypopituitarism is dose-dependent. Clin Endocrinol. 1989; 31: 363.
- Loucks AB., Mortola JF., Girton L., et al. Alterations in the hypothalamic-pituitary-ovarian and the hypothalamic-pituitary-adrenal axes in athletic women. J Clin Endocrinol Metab. 1989; 68: 402.
- Mason HD., Margara R., Winston RL., et al. Insuline-like growth factor-I (IGF-I) inhibits production of IGF-binding protein-1 while stimulating estradiol secretion in granulosa cells from normal and polycystic human ovaries. J Clin Endocrinol Metab. 1993; 76:1275.
- Matteri RK., Stanczyk FZ., Gentzschein EE., et al. Androgen sulfate and glucoronide conjugates in nonhirsute and hirsute women with polycystic ovarian syndrome. Am J Obstet Gynecol. 1989; 161: 1704.
- McKenna TJ. Pathogenesis and treatment of polycystic ovary syndrome. N Engl J Med. 1988; 318: 558.
- Nestler JE., Powers LP., Matt DW., et al. A direct effect of hyperinsulinemia on serum sex hormone-binding globulin in obese women with the polycystic ovary syndrome. J Clin Endocrinol Metab. 1991; 72: 83.
- O’Meara NM., Blackman JD., Ehrman DA., et al. Defects in b-cell function in functional ovarian hyperandrogenism. J Clin Endocrinol Metab. 1993; 76: 1241.
- Pache TD., de Jong FH., Hop WC., et al. Association between ovarian changes assesed by transvaginal sonography and clinical and endocrine signs of the polycystic ovary syndrome. Fertil Steril. 1993; 59: 544.
- Peiris AN., Sothmann MS., Aiman EJ., et al. The relationship of insulin to sex hormone-binding globulin: role of adiposity. Fertil Steril. 1989; 52: 69.
- Pestell RG., Best JD., Alford FP. Lymphocytic hypophysitis: The clinical spectrum of the disorder and evidence for an autoimmune pathogenesis. Clin Endocrinol. 1990; 33: 457.
- Polson DW., Wadsworth J., Adams J., et al. Polycystic ovaries: a common finding in normal women. Lancet. 1988; 2: 870.
- Poretsky L. On the paradox of insulin-induced hyperandrogenism in insulin-resistant states. Endocrin Rev. 1991; 12:3.
- Reavens GM. Role of insulin resistance in human disease. Diabetes. 1988; 37:1595.
- Rebar RW. Gonadotropin secretion in polycistic ovary disease. Seminars Reprod Endocrinol. 1984; 2:223.
- Rosenfield RL., Barnes RB., Cara JF., et al. Dysregulation of cytochrome P450c 17b as the cause of polycystic ovarian syndrome. Fertil Steril. 1990; 53: 785.
- Rosner W. The functions of corticosteroid-binding globulin and sex-hormone-binding globulin: recent advances. Endocr Rev. 1990; 11: 80.
- Schoemaker RJ. Neuroendocrine control in polycystic ovary-like syndrome. Gynecol Endocrinol. 1991; 5: 277.
- Schwanzel-Fukuda M., Bick D., Pfaff DW. Luteinizing hormone-releasing hormone (LHRH) expressing cells do not migrate normally in an inherited hypogonadal (Kallmann) syndrome. Mol Brain Res. 1989; 6: 311.
- Seibel MM. Ovarian dysfunction and anovulation. En Carr BR., Blackwell RE. Textbook or reproductive medicine. Ed. Appleton & Lange (1a). 1993: 355-369.
- Seifer DB., Collins RL. Current concepts of b-endorphin physiology in female reproductive dysfunction. Fertil Steril. 1990; 54: 757.
- Simpson ER., Merril JC., Hollub AJ., et al. Regulation of estrogen byosynthesis by human adipose cells. Endocr Rev. 1989; 10: 136.
- Speroff L., Glass RH., Kase NG. Anovulation and the polycystic ovary. En Speroff L., Glass RH., Kase NG. Clinical Gynecologic Endocrinology and Infertility. Ed. Williams & Wilkins (5a), 1994; 457-482.
- Stuart CA., Nagamani M. Insulin infusion acutely augments ovarian androgen production in normal women. Fertil Steril. 1990; 54: 788.
- Tulppala M., Stenman UH., Cacciatore B., et al. Polycystic ovaries and levels of gonadotropins and androgens in recurrent miscarriage: prospective study in 50 women. Obstet Gynecol. 1993; 100: 348.
- Wajchenberg BI., Achando SS., Mathor MM., et al. The source(s) of estrogen production in hirsute women with polycystic ovarian disease as determined by simultaneous adrenal and venous catheterization. Fertil Steril. 1988; 49: 56.
- Wild RA., Van Nort JJ., Grubb B., et al. Clinical signs of androgen excess as risk factors for coronary artery disease. Fertil Steril. 1990; 54: 255.
- Yeh J., Rebar RW., Liu JH., et al. Pituitary function in isolated gonadotrophin deficiency. Clin Endocrinol. 1989; 31: 375.
- Yen SCC. Anovulación crónica causada por trastornos endocrinos periféricos. En Yen SSC., Jaffe RB. Endocrinología de la reproducción. Ed. Panamericana (3a). 1993: 603-657.
- Yen SCC. Anovulación crónica debida a disfunción del sistema SNC-hipotalámico-hipofisiario. En Yen SSC., Jaffe RB. Endocrinología de la reproducción. Ed. Panamericana (3a). 1993: 658-714.