Capítulo VI
Dr. Germán Barón Castañeda, M.D.
Clásicamente se ha clasificado la amenorrea como primaria o secundaria de acuerdo a su presentación clínica.
Desde el punto de vista práctico es más sencillo incluir estos dos términos bajo un mismo marco de referencia que sirva para su estudio y manejo.
Son múltiples las escuelas que manejan en forma diferente la amenorrea; siempre nos ha parecido un enfoque sencillo y fácilmente aplicable en nuestro medio el presentado por Leon Speroff de Portland, Oregon, razón por la cual gran parte de este capítulo está basado en sus conceptos.
Definición
Toda paciente que cumpla una de las siguientes características debe ser incluida en el capítulo:
- Ausencia de menstruación a los 14 años sin desarrollo de las características sexuales secundarias.
- Ausencia de menstruación a los 16 años a pesar de la presencia de crecimiento y desarrollo normal de características sexuales secundarias.
- En toda mujer que ha venido menstruando, la ausencia de reglas por un lapso equivalente a tres de los intervalos previos de sus ciclos o seis meses sin menstruación, se considera en amenorrea.
La demostración clínica de una función menstrual adecuada es de la aparición de sangre en el exterior. Para que esto suceda se requiere la presencia de un tracto de salida íntegro que conecte los genitales internos con el exterior; esto implica la presencia y desarrollo del endometrio en la cavidad uterina.
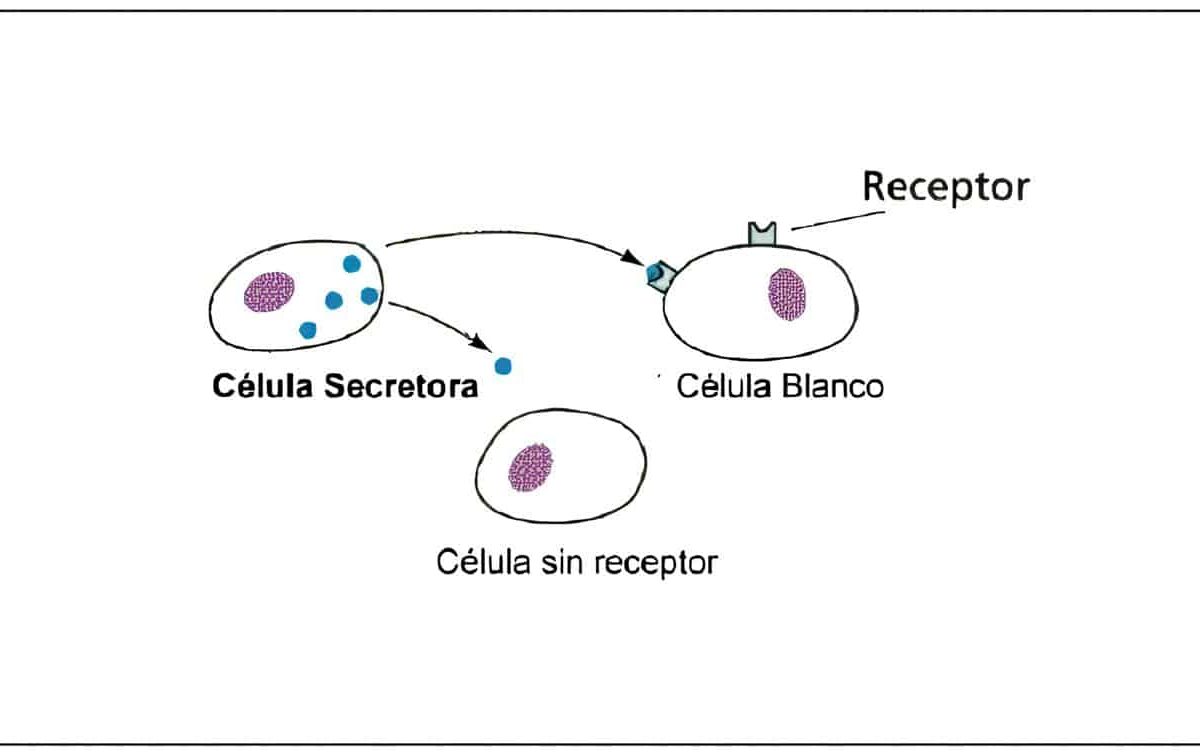
Este tejido debe ser estimulado y regulado por una secuencia y concentración adecuadas de las hormonas esteroideas estrógenos y progesterona, producidas en el ovario. Para el desarrollo del aparato folicular es indispensable la presencia de las gonadotropinas FSH y LH originadas en la hipófisis anterior y reguladas por la GnRH secretada en forma pulsátil en el hipotálamo basal.
Todo este sistema es regulado por un complejo que integra información biofísica y bioquímica comprometida en las señales hormonales, factores autocrinos y paracrinos y función de la célula blanco en el útero, el ovario, la hipófisis, el hipotálamo y otros centros del sistema nervioso central.
De esta manera y con el fin de estudiar la amenorrea se puede dividir el organismo en cuatro compartimientos, los cuales pueden explicar las posibles causas de la siguiente manera:
- Primero, Compartimiento I: el tracto de salida u órgano blanco uterino.
- Segundo, Compartimiento II: el ovario
- Tercero, Compartimiento III: la hipófisis anterior
- Cuarto, Compartimiento IV: el hipotálamo y el sistema nervioso central.
Evaluación de la Amenorrea
Como en todo acto médico se debe partir de una historia clínica cuidadosa y examen físico completo; deben buscarse evidencias de disfunción psicológica o estrés emocional, historia familiar de anomalías genéticas aparentes, signos de algún problema físico con énfasis en el estado nutricional, crecimiento y desarrollo, características del tracto reproductivo normal y la posibilidad de enfermedades del sistema nervioso central.
El estudio de la amenorrea debe seguir los pasos que se enumeran a continuación.
Paso I
El paso inicial en el estudio de la paciente con amenorrea es descartar el embarazo. Una vez excluida esta posibilidad se inicia el estudio con medición de TSH, prolactina y una prueba progestacional.
Aunque son pocas las pacientes que tienen hipotiroidismo su diagnóstico es tan sencillo y el tratamiento tan fácil, con respuesta rápida y regreso de los ciclos ovulatorios que se justifica su estudio.
Al aumentarse la TSH hay disminución de la dopamina en la hipófisis, lo cual hace que se aumente la prolactina. En estos casos es exótico encontrar niveles de prolactina superiores a 100 ng/ml.
El propósito de la prueba progestacional es evaluar el nivel de estrógenos endógenos y la competencia del tracto de salida. Se administra un agente progestacional que no contenga ningún tipo de actividad estrogénica; se recomienda el acetato de medroxiprogesterona vía oral 10 mg diarios durante cinco días.
Se espera que haya sangrado entre 2 y 7 días después de terminada la droga. Si hay sangrado se puede confirmar el diagnóstico de anovulación. De esta manera se comprueba la presencia de un tracto de salida íntegro, con un endometrio funcional, adecuadamente estimulado por estrógenos.
La cantidad del sangrado necesaria para considerar la prueba como positiva es un manchado mínimo. Hay dos situaciones en las cuales se puede presentar una prueba progestacional negativa a pesar de tener niveles adecuados de estrógenos endógenos.
En ambos casos el endometrio se encuentra decidualizado y por lo tanto no va a ser descamado con el progestágeno exógeno. Esto se presenta cuando hay niveles elevados de andrógenos, por ejemplo en la paciente con ovarios poliquísticos y en mujeres con niveles elevados de progesterona encontrados en las deficiencias enzimáticas en la glándula suprarrenal.
Si hay ausencia de galactorrea y niveles de prolactina y TSH normales, no se requiere más estudio.
Si la paciente ha permanecido en anovulación por un período prolongado, se recomienda hacer una biopsia de endometrio para descartar atipia o malignidad.
La terapia mínima de las pacientes anovulatorias requiere la administración mensual de un agente progestacional. La experiencia con el endometrio en la terapia estrogénica ha demostrado que se requiere mínimo de 10 días para proveer una protección adecuada sobre los efectos mitogénicos de los estrógenos.
El tratamiento más sencillo es con acetato de medroxiprogesterona 10 mg/día por 12 días al mes, a partir del día 12 del ciclo. Si se desea anticoncepción se puede utilizar cualquiera de las píldoras de microdosis.
En algunos casos la prueba progestacional puede disparar la ovulación; esto se demuestra por la presencia de sangrado más tardío, 14 días después de la prueba.
Existe una regla que puede aplicarse en estos casos: Un sangrado positivo en respuesta a la medicación progestacional, ausencia de galactorrea y nivel normal de prolactina excluyen la presencia de un tumor hipofisiario significativo.
La presencia de un manchado escaso implica niveles marginales de estrógenos, por lo cual estas pacientes periódicamente deben ser reevaluadas. El sangrado en cualquier cantidad superior a unas pequeñas gotas hace la respuesta positiva.
Paso II
Si no existe sangrado después de la prueba progestacional existen dos posibilidades: o el órgano blanco del tracto de salida no es funcional o no hubo estimulación estrogénica que permitiera la proliferación del endometrio.
Este segundo paso está diseñado para diferenciar estas posibilidades. Se administra una dosis adecuada de estrógenos que permita la proliferación del endometrio (2.5 mg de estrógenos conjugados por 21 días) y los últimos 5 días se asocia acetato de medroxiprogesterona 10 mg/día.
Si no existe sangrado después de la prueba estrógeno/progestágeno se puede confirmar el diagnóstico de una alteración en el endometrio o el tracto de salida. Si hay sangrado se puede asumir que el tracto de salida tiene una función normal si es estimulado adecuadamente por estrógenos.
Los problemas del tracto de salida son secundarios a raspados exhaustivos que producen adherencias, a infecciones o a una amenorrea primaria producida por alteraciones del tracto mülleriano. Estas alteraciones son raras y si no hay una razón que las haga sospechar, este paso puede ser omitido.
Paso III
Para que se produzcan estrógenos, los ovarios con aparato folicular normal deben tener un estímulo por parte de las gonadotropinas. Este paso está diseñado para determinar cual de estos dos componentes está alterado. Con este fin se hace la medición de los niveles séricos de las gonadotropinas.
Si se ha realizado el paso II se pueden alterar los niveles de gonadotropinas, por lo tanto se debe esperar por lo menos dos semanas después del estímulo estrógeno-progestacional. Siempre se debe tener en cuenta el pico preovulatorio de la LH, ya que es alrededor de tres veces superior al nivel basal; si no hay sangrado después de dos semanas de haber practicado el examen, cualquier nivel elevado de LH se puede asumir como anormal.
El resultado de las gonadotropinas en una mujer con amenorrea que no sangra después de la prueba progestacional puede ser anormalmente alto, anormalmente bajo o en el rango normal.
Gonadotropinas elevadas
La asociación entre niveles postmenopáusicos de gonadotropinas y la falla ovárica es bastante confiable. Sin embargo existen situaciones poco frecuentes en las cuales se pueden encontrar gonadotropinas elevadas existiendo folículos en los ovarios:
En raras ocasiones hay tumores productores de gonadotropinas. Generalmente están asociados con carcinoma de pulmón; son tan raros que con la historia clínica y el examen físico se puede descartar, por ello no es necesario realizar radiografía de tórax en forma rutinaria en todas las pacientes con amenorrea.
Existen algunos reportes de la deficiencia aislada de alguna de las gonadotropinas. Esta condición se puede confirmar cuando se encuentra una de las gonadotropinas muy elevada y la otra dentro de rangos normales.
Las gonadotropinas elevadas pueden ser el resultado de un tumor hipofisiario productor de ellas. Estos adenomas no se asocian con hipogonadismo y por lo tanto son difíciles de diagnosticar. En la mayoría de los casos producen clínica secundaria a la expansión de la masa.
Durante el periodo perimenopáusico con frecuencia se encuentran niveles aumentados de la FSH, incluso antes de que cese el sangrado. En los casos de falla ovárica prematura esta alteración puede aparecer a los 25 o 30 años de edad. El aumento de la FSH está asociado con una disminución de la inhibina. El valor de medir tanto la FSH como la LH en estos casos radica en que los niveles de LH se encuentran dentro del rango normal
El síndrome de ovario resistente o insensible se presenta también en pacientes con amenorrea y gonadotropinas elevadas a pesar de la presencia de folículos ováricos. Se cree que esta condición representa la ausencia de receptores para las gonadotropinas en los folículos o a un defecto en la señal post-receptor.
La única forma de comprobar este diagnóstico es por laparotomía y biopsia de ovario. Como esta condición es rara y la posibilidad de lograr un embarazo es remota, el riesgo – beneficio no amerita realizar la biopsia en todas las mujeres. La ecografía transvaginal puede tener alguna utilidad ya que puede demostrar la presencia de folículos.
La falla ovárica prematura puede ser secundaria a enfermedades autoinmunes. En este caso se ven folículos primordiales de características normales pero los folículos en desarrollo contienen linfocitos y células plasmáticas tanto en las capas de la teca como de la granulosa.
Con frecuencia se asocia con alteraciones de la función tiroidea; por este motivo se recomienda realizar en forma rutinaria la evaluación completa de la función tiroidea incluyendo la titulación de anticuerpos.
Otras alteraciones inmunes asociadas con falla ovárica prematura son raras; incluyen el síndrome poliglandular (hipoparatiroidismo, insuficiencia suprarrenal, tiroiditis y moniliasis), la miastenia grave, la púrpura trombocitopénica idiopática, la artritis reumatoidea, el vitiligo y la anemia hemolítica autoinmune. En casos muy raros se pueden lograr embarazos; hay reportes que muestran que puede recuperarse la función ovulatoria después del tratamiento con corticoides.
Pacientes con galactosemia presentan un componente carbohidrato anormal dentro de la molécula de las gonadotropinas, por lo cual la FSH y la LH se tornan biológicamente inactivas. En estos casos también puede haber una falla gonadal primaria ya que la galactosa puede impedir la migración de las células germinales hacia la cresta gonadal.
(Lea También: Trastornos Específicos en los Compartimientos)
Otra situación clínica rara que se presenta con gonadotropinas elevadas es la deficiencia de la enzima 17-hidroxilasa (P450c17) en ovarios y suprarrenales. Es fácil de diagnosticar puesto que hay ausencia del desarrollo de características sexuales secundarias, hipertensión, hipokalemia y niveles elevados de progesterona.
Todas las pacientes menores de 30 años en las cuales se ha confirmado el diagnóstico de falla ovárica prematura deben tener una determinación del cariotipo. La presencia de mosaicos con cromosoma Y hace mandatoria la laparotomía y extirpación de las áreas gonadales, porque el componente testicular tiene un riesgo elevado de sufrir transformación maligna.
Aproximadamente 30% de los pacientes con cromosoma Y no desarrollan signos de virilización, por lo cual el fenotipo de una mujer adulta normal no descarta la necesidad de realizar el cariotipo.
En casos de talla baja también se recomienda realizar el cariotipo ya que algunos genes responsables de la estatura se encuentra en el cromosoma X; las deleciones parciales implican una adecuada consejería genética para el resto de la familia.
En los últimos años se han descrito varios casos en los cuales mujeres con diagnóstico de falla ovárica han reanudado sus ciclos ovulatorios; siempre ha existido la asociación con la suplencia estrogénica, lo cual sugiere que los estrógenos pueden inducir la formación de receptores en los folículos y las mismas gonadotropinas elevadas llevar al crecimiento y desarrollo folicular.
Como gran cantidad de casos de falla ovárica se asocia con trastornos autoinmunes se recomienda realizar como parte del estudio: calcio, fósforo, cortisol basal, T4 libre, TSH, anticuerpos antitiroideos, cuadro hemático con sedimentación, proteinemia total y diferencial, factor reumatoideo y anticuerpos antinucleares.
La inducción de la ovulación se puede intentar cuando la relación FSH:LH es menor de 1 y el valor sérico de estradiol superior a 50 pg/ml. Puede haber alguna ventaja en disminuir las gonadotropinas antes de intentar la inducción de la ovulación, lo cual se puede lograr con la administración de estrógenos o análogos de la GnRH.
Aunque no hay reportes en la literatura, hemos observado que otra causa que puede llevar a la falla ovárica prematura es la cirugía, especialmente la ligadura de trompas en la cual puede haber compromiso vascular que altere la función ovárica. Este es un tema que amerita una investigación más detallada en el futuro.
Gonadotropinas normales
El por qué se puede encontrar un estado hipoestrogénico con gonadotropinas normales puede ser explicado por la heterogeneidad de las hormonas glicoprotéicas.
En estos casos se encuentran las gonadotropinas con aumento en la cantidad de ácido siálico en la porción carbohidrato, por lo cual son biológicamente inactivas; en el radioinmunoanálisis se puede reconocer una porción suficiente de la molécula que arroja un resultado de laboratorio normal.
Se ha descrito un trastorno raro en el cual hay una alteración en la síntesis de gonadotropinas que lleva a la producción de hormonas inmunológicamente activas pero biológicamente inactivas.
El punto básico es que cuando están normales la FSH y LH con una prueba progestacional negativa se debe sospechar una disfunción hipófisis – sistema nervioso central. Esta es la situación clínica encontrada con mayor frecuencia. El estudio se hace de la misma forma que para las pacientes con gonadotropinas bajas.
Gonadotropinas bajas
Se debe diferenciar si la falla está en la hipófisis o en el hipotálamo – sistema nervioso central. Esto se realiza con la evaluación imagenológica de la silla turca, buscando cambios que sugieran la presencia de una masa.
La modalidad diagnóstica de elección es la tomografía axial computarizada con medio de contraste intravenoso. En algunos centros se prefiere utilizar la resonancia magnética nuclear, que aunque tiene algo más de sensibilidad tiene el inconveniente del costo elevado.
Se ha recomendado el manejo conservador de los tumores hipofisiarios productores de prolactina. Cuando son pequeños se puede hacer el seguimiento clínico y radiológico anual; en otros casos se prefiere el manejo con agonistas de la dopamina cuando el tumor es mayor o demuestra crecimiento.
La cirugía se reserva únicamente para aquellos casos en los cuales no hay respuesta al manejo médico. Si el nivel de prolactina es superior a 100 ng/ml, o cuando hay alteración en la radiografía cónica de la silla turca, se debe realizar el TAC o la resonancia magnética; este tipo de estudio también es recomendado cuando hay cefalea o trastornos visuales.

Figura 6.1 Flujograma para el diagnóstico de amenorrea
La terapia con agonistas de la dopamina se reserva para aquellas pacientes que desean embarazo o cuando hay galactorrea.
Hipogonadismo Hipogonadotrópico
Amenorreas en pacientes sin galactorrea y con RX de silla turca normales se clasifican como de origen hipotalámico. El mecanismo de producción de la amenorrea es por supresión de la secreción pulsátil de GnRH por debajo de su nivel crítico.
Este es un diagnóstico hecho por exclusión. En algunos casos es posible sospechar algunas causas desencadenantes como la anorexia y la pérdida de peso pero no hay forma de manipular o medir la función hipotalámica para confirmar el diagnóstico.