Dr. Germán Barón Castañeda, M.D.
La regulación de estas hormonas incluye tres partes importantes: 1. heterogeneidad de la hormona, 2. regulación hacia arriba y hacia abajo de los receptores y 3. regulación de la adenil-ciclasa.
Heterogeneidad
Las glicoproteínas tales como FSH y LH no son proteínas únicas sino una familia de formas heterogéneas (isoformas) con diversa actividad biológica e inmunológica. Las isoformas tienen variación en la vida media y peso molecular.
Esta familia de glicopéptidos incluye la FSH, LH, TSH y HCG. Todas son dímeros compuestos de dos subunidades polipeptídicas glicosiladas, las subunidades a y b. Todas comparten la subunidad a que es idéntica, conformada por 92 aminoácidos. Las cadenas b difieren tanto en los aminoácidos como en el contenido de carbohidratos, lo cual les confiere especificidad.
El factor limitante en la producción hormonal está dado por la disponibilidad de cadenas b, ya que las a se encuentran en cantidad suficiente a nivel tisular y sanguíneo.
Las glicoproteínas pueden variar en su contenido de carbohidratos. La remoción de residuos de la FSH lleva a la producción de compuestos capaces de unirse al receptor pero no de desencadenar acciones biológicas.
La prolactina consta de 197 a 199 aminoácidos; tiene también variaciones estructurales que incluyen glicosilación, fosforilación y cambios en unión y carga eléctrica. Se encuentran varios tamaños que han llevado a utilizar términos como pequeña, grande y gran-gran prolactina.
Todas estas modificaciones e isoformas llevan a que el inmunoanálisis no siempre pueda reflejar la situación biológica.
(Lea También: Neuroendocrinología)
Regulación hacia arriba y hacia abajo
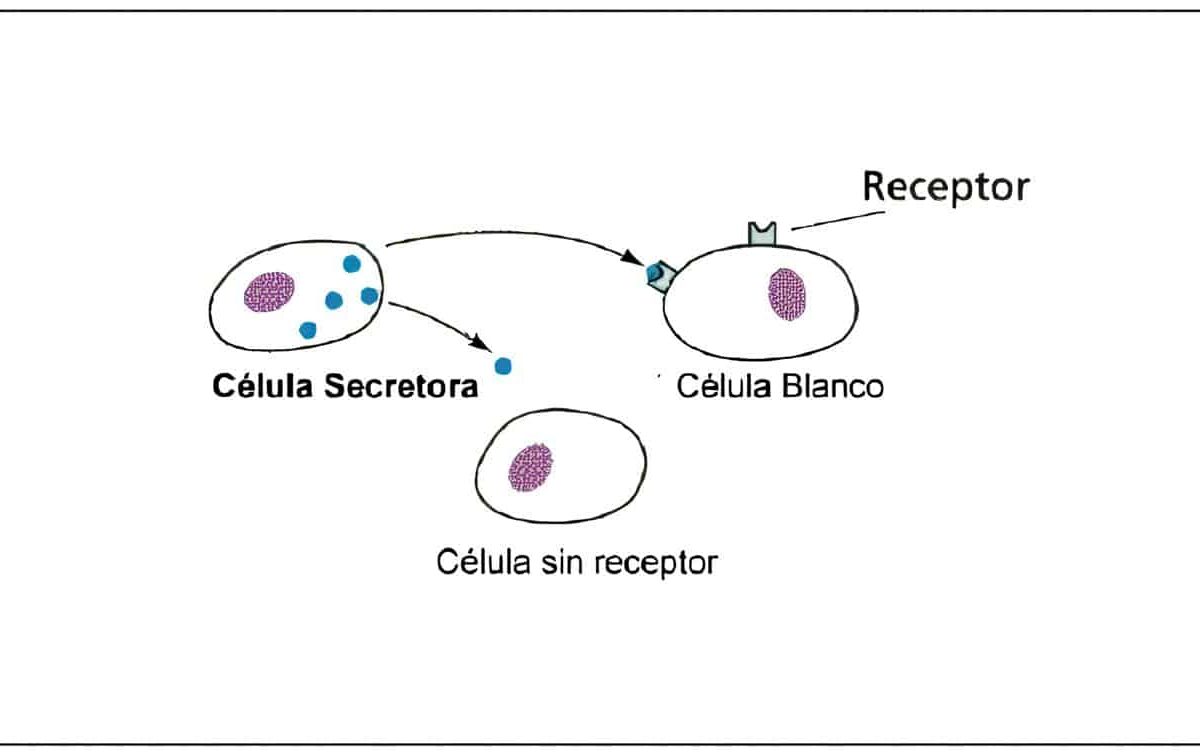
La modulación positiva o negativa de los receptores por hormonas homólogas es conocida como regulación hacia arriba y hacia abajo.
Poco se conoce sobre la regulación hacia arriba, pero se sabe que hormonas como la prolactina y la GnRH pueden aumentar la concentración de sus propios receptores en la membrana.
La principal forma biológica como las hormonas peptídicas controlan el número de receptores y por ende, la actividad biológica, es a través del proceso de internalización. Esto explica el por qué de la secreción pulsátil de las gonadotropinas para evitar la regulación hacia abajo.
Cuando hay concentraciones elevadas de hormona en la circulación, el complejo hormona-receptor se mueve hacia una región especial en la membrana, el “hueco revestido” (“coated pit”). A medida que esta región se va llenando sufre el proceso de endocitosis mediada por receptores. Esta región de la membrana celular es una vesícula lipídica que está sostenida por una canasta de proteínas específicas llamadas clatrinas.
Cuando está completamente ocupada la vesícula es invaginada:
Se separa e ingresa a la célula como una vesícula cubierta, llamada también receptosoma. Es transportada a los lisosomas donde sufre el proceso de degradación. El receptor liberado puede ser reciclado y reinsertado en la membrana celular; a su vez, tanto el receptor como la hormona pueden ser degradados disminuyendo la actividad biológica.
Este proceso de internalización no solo es utilizado para el control de la actividad biológica sino para transporte intracelular de sustancias como hierro y vitaminas.
Los receptores de membrana han sido divididos en dos clases. Los de clase I son utilizados para modificar el comportamiento celular por regulación hacia abajo; son ocupados por FSH, LH, HCG, GnRH, TSH, TRH e insulina. Los receptores de clase II son utilizados para ingreso de sustancias indispensables para la célula y para remover noxas; por ejemplo son usados por la LDL para el transporte de colesterol a las células esteroidogénicas.
Regulación de la adenil-ciclasa
La adenil ciclasa está compuesta por tres unidades proteicas: el receptor, una unidad reguladora y una unidad catalítica. La unidad reguladora es controlada por el GTP; por lo tanto es llamada la proteína de unión a GTP o proteína G. La unidad catalítica es la enzima encargada de convertir el ATP a AMPc. Después de la unión de la hormona, el complejo hormona-receptor se liga a su unidad reguladora y ejerce la acción; el GTP rápidamente es convertido a GDP, con lo cual la enzima regresa a su estado inactivo.
Se sabe que a medida que aumenta la concentración hormonal hay desensibilización de la adenil-ciclasa, independiente del proceso de internalización de receptores. Esto incluye la fosforilación del receptor, lo cual lleva a separación de las unidades reguladora y catalítica de la adenil-ciclasa.
Referencias
- Auerbach GD. Polypeptide and amine hormone regulation of adenylate cyclase. Annu Rev Physiol; 1982; 44: 653-666.
- Beato M. Gene regulation by steroid hormones. Cell 1989; 56: 335.
- Becker AB., Roth RA. Insulin receptor structure and function in normal and pathologic conditions. Annu Rev Med 1990; 41: 99-115.
- Benbrook D., Pfahl M. A novel thyroid hormone receptor encoded by a cDNA clone from a human testis library. Science 1987; 238: 788-791.
- Berg JM. DNA binding specificity of steroid receptors. Cell 1989; 57: 1065-1068.
- Blubdell T., Wood S. The conformation, flexibility and dynamics of polypeptide hormones. Annu Rev Biochem 1982; 51: 123-154.
- Bradshaw MS., Tsai MJ., O’Malley BW. A steroid response element can function in the absense of a distal promoter. Mol Endocrinol 1988; 2: 1286-1293.
- Carson-Jurica MA., Schrader WT., O’Malley BW. Steroid receptor family: structure and functions. Endocr Rev 1990; 11: 201.
- Catt KJ., Dufau ML. Hormonas gonadotróficas: biosíntesis, secreción, receptores y acción. En Yen SSC., Jaffe RB. Endocrinología de la reproducción. Ed Panamericana (3a); 1993: 126-178.
- Clark JH., Schrader WT., O’Malley BW. Mechanisms of action of steroid hormones. En Williams Textbook of Endocrinology. Ed. W.B. Saunders Comp (8a). 1992; 35-90.
- Clark JH., Peck EJ. Female sex steroids: receptors and function. Monogr Endocrinol 1979; 14: 4-36
- Dynan WS. Modularity inpromoters and enhancers. Cell 1989; 58: 1-4.
- Evans RE. The steroid and thyroid hormone receptor superfamily. Science 1988; 240: 889.
- Freedman LP. Anatomy of the steroid receptor zinc finger region. Endocr Rev 1992; 13: 129.
- Green S., Chambon P. A superfamily of potentially oncogenic hormone receptors. Nature 1986; 324: 615-617.
Bibliografía
- Green S., Kumar V., Krust P., et al. Structural and functional domains of the estrogen receptor. Cold Spring Harbor Symp Quant Biol 1986; 51: 751-758.
- Gorden MS., Notides AC. Computer modeling of estradiol interactions with the estrogen receptor. J Steroid Biochem 1986; 25: 177-181.
- Hill D. Growth factors and their cellular actions. J Reprod Fertil. 1989; 85: 723.
- Hokin LE. Receptors and phosphoinositide-generated second messengers. Annu Rev Biochem 1985; 54: 202-235.
- Kahn CR., Smith RJ., Chin WW. Mechanism of action of hormones that act at the cell surface. En Williams Textbook of Endocrinology. Ed. WB Saunders Comp (8a) 1992; 91-134.
- Kahn CR. Membrane receptors for hormones and neurotransmitters. J Cell Biol 1976; 70: 261-286.
- Kelly PA., Djiane J., Edery M. Different forms of the prolactin receptor: insights into the mechanism of prolactin action. Trend Endocrinol Metab. 1992; 3: 54-59.
- King RJB. Strucutre and function of steroid receptors. J Endocrinol 1987; 114: 341.
- Koike S., Masaharu S., Maramatsu M. Molecular cloning and characterization of rat estrogen receptor cDNA. Nucleic Acids Res 1987; 15: 2499-2513.
- Kumar V., Green S., Stack G., et al. Functional domains of the human estrogen receptor. Cell 1987; 51: 941-951.
- Kumar V., Chambon P. The estrogen receptor binds tightly to its responsive element as a ligand induced homodimer. Cell 1988; 55: 145-156.
- LaPolt PS., Tilly JL., Aihara T., et al. Gonadotropin induced up- and down-regulation of ovarian follicle-stimulating hormone (FSH) receptor gene expression in inmature rats: effects of pregnant mare’s serum gonadotropin, human chorionic gonadotropin, and recombinant FSH. Endocrinology 1992; 130: 1289.
- Lubhan DB,., Joseph DR., Sullivan PM, et al. Cloning of human androgen receptor complementary DNA and localization to the X chromosome. Science 1988; 240: 327-330.
Fuentes
- Medici N., Minucci S., Nigro V., et al. Metal binding sites of the estradiol receptor from calf uterus and their possible role in the regulation of the receptor function. Biochemistry 1989; 28: 212-219.
- Metzger D., White JH., Chambon P. The human oestrogen receptor functions in yeast. Nature 1988; 334: 31-36.
- Michel RH. How do receptors at the cell surface send signals to the cell interior? Br Med J 1987; 295: 1320-1323.
- Migliaccio A., Di Domenicio M., Green S., et al. Phosphorylation on tyrosine of in vitro synthesized human estrogen receptor activates its hormone binding. Mol Endocrinol 1989; 3: 1061-1069.
- Miller WL. Molecular biology of steroid hormone synthesis. Endocr Rev 1988; 9: 295.
- Misrahi M., Atger M., d’Auriol L. Complete aminoiacid sequence of the progesterone receptor deduced from cloned cDNA. Biochem Byophys Res Commun 1987; 143: 740-748.
- Morgan DO., Edman JC., Standring DN., et al. Insuline-like growth factor II receptor as a multifunctional binding protein. Nature 1987; 329: 301-307.
- Muldoon TG., Evans AC. Hormones and their receptors. Arch Intern Med 1988; 148: 961-967.
- Nicoll RA. The coupling of neurotransmitter receptors to ion channels in the brain. Science 1988; 241: 542-551.
- O’Malley BW. Did eucaryotic steroid receptors evolve from intracrine gene regulators? Endocrinology 1989; 125: 1119-1120.
- O’Malley BW., Strott CA. Hormonas esteroides: metabolismo y mecanismo de acción. En Yen SSC., Jaffe RB. Endocrinología de la reproducción. Ed Panamericana (3a); 1993: 179-203.
- Peale FV., Ludwig LB., Zain S., et al. Properties of a high-affinity DNA binding site for estrogen receptor. Proc Natl Acad Sci USA 1988; 85: 1038-1042.
Referencias Bibliográficas
- Pratt WB., Jolly DJ., Pratt DV., et al. A region in the steroid binding domain determines formation of the non-DNA-binding, 9S glucocorticoid receptor complex. J Biol Chem 1988; 263: 267-273.
- Rasmussen H. The calcium messenger system. New Engl J Med. 1986; 314: 1096-1164.
- Raymoure WJ., McNaught RW., Smith RG. Reversible activation of non-steroid binding oestrogen receptor. Nature 1985; 313: 745-747.
- Sabbah M., Redeuilh G., Secco C., et al. The binding activity of estrogen receptor to DNA and heat shock protein is dependent on receptor-bound metal. J Biol Chem 1987; 262: 8631-8635.
- Salemme FR. Structural polymorphism in transmembrane channels. Science 1988; 241: 229-230.
- Simpson ER., Mendelson CR. The molecular basis of hormone action. En Carr BR., Blackwell RE. Textbook of reproductive medicine. Ed Appleton & Lange (1a); 1993: 121-140.
- Speroff L., Glass RH., Kase NG. Hormone Byosynthesis, Metabolism, and Mechanism of Action. En Speroff L., Glass RH., Kase NG. Clinical Gynecologic Endocrinology and Infertility. Ed. Williams & Wilkins (5a), 1994; 31-92.
- Sutherland EW. Studies on the mechanism of hormone action. Science 1972; 177: 401-408.
- Thompson CC., Weinberger C., Lebo R., et al. Identification of a novel thyroid hormone receptor expressed in tha mammalian central nervous system. Science 1987; 237: 1610-1614.
- Tsai SY., Carlsted-Duke J., Weigel NL., et al. Molecular interactions of steroid hormone receptor with its enhancer element: evidence for receptor dimer formation. Cell 1988; 55: 361-369.
Fuentes Bibliográficas
- Walter PW., Green S., Green G., et al. Cloning of the human estrogen receptor cDNA. Proc Natl Acad Sci USA 1985; 82: 7889-7893.
- Webster NJ., Green S., Jin JR., et al. The hormone-binding domains of the estrogen and glucocorticoid receptors contain an inducible transcription activation function. Cell 1988; 54199-207.
- Yip CC. Cell-membrane hormone receptors: some perspectives on their structure and function relationship. Biochem Cell Biol 1988; 66: 549-556.