Hematología
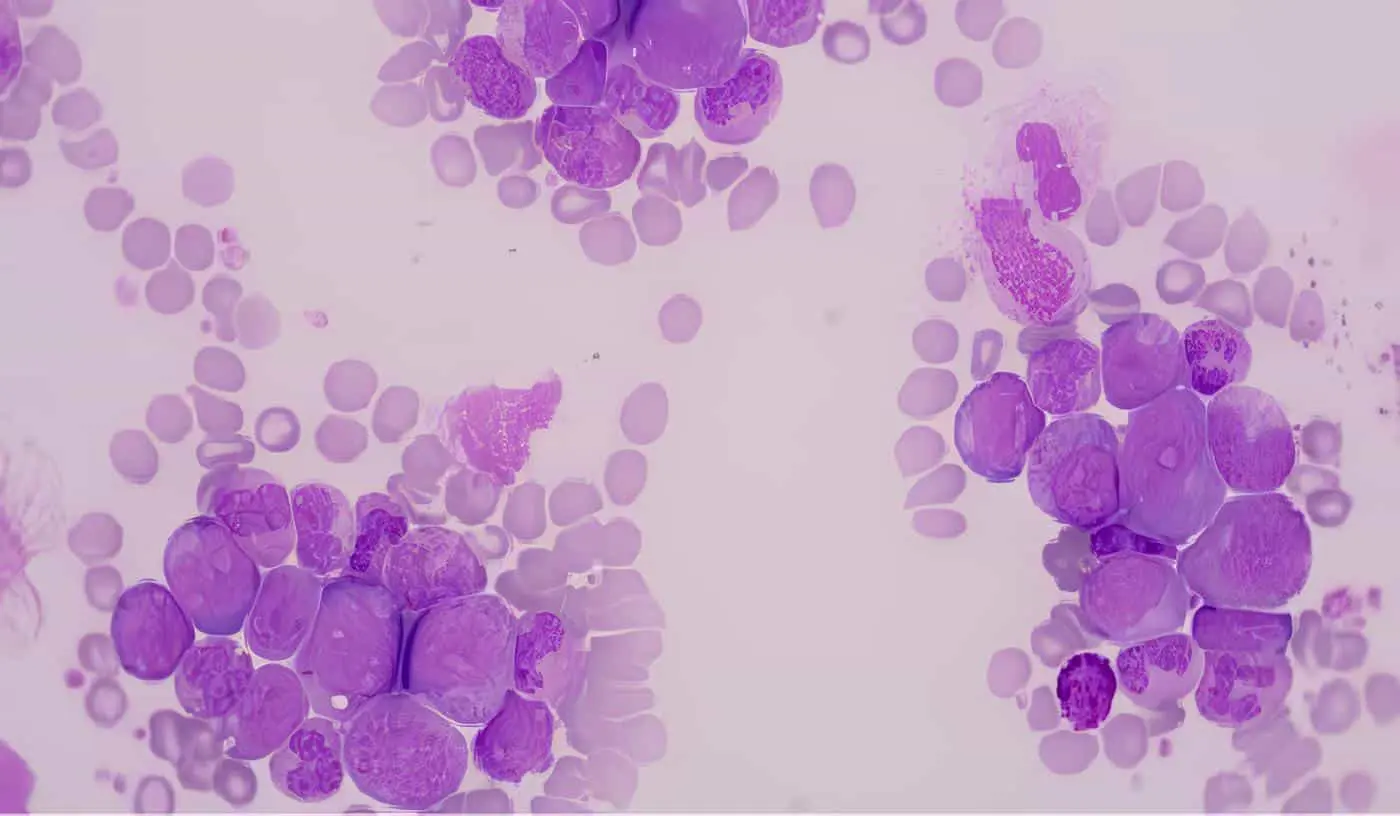
Las leucemias son proliferaciones clonales de células inmaduras del sistema hematopoyético que se caracterizan por un bloqueo en la diferenciación celular o una diferenciación aberrante. Las células de leucemia rápidamente se acumulan en la médula ósea reemplazando la mayoría de las células hematopoyéticas normales, impidiendo la producción de las células sanguíneas periféricas, llevando a manifestaciones clínicas de anemia, trombocitopenia e infecciones.
Simultáneamente, puede ocurrir invasión del sistema monocítico-macrofago, llevando a la expresión clínica de hepato-esplenomegalia o linfadenopatía generalizada, cuando el compromiso es ganglionar. (Ver también: Cáncer Suprarrenal Adrenocortical)
Leucemia Linfoide Aguda del Adulto
Epidemiología
Las leucemias linfoides agudas (LLA) son principalmente enfermedades de la infancia, con incidencia mayor entre los 2 a 5 años de edad; en este grupo, en los Estados Unidos representan el 80% de las leucemias. La incidencia ajustada de LLA en adultos (definidos como mayores de 15 años) es aproximadamente 1250 casos nuevos anualmente. La LLA tiene una distribución bimodal, con un segundo aumento en la incidencia alrededor de los 50 años y un aumento pequeño, pero sostenido con la edad más avanzada.
A escala mundial, los rangos de incidencia varían entre 10 y 65 casos por un millón de habitantes. La incidencia y mortalidad son ligeramente superiores en hombres.
Etiopatogenia
Los factores de riesgo conocidos sólo logran ser identificados en una minoría de los casos. Entre ellos, se incluyen exposición a radiación, exposición ocupacional al benceno y agentes quimioterapéuticos.
En los cuadros de tipo génico se identifican síndromes asociados como el síndrome de Down, la anemia de Fanconi, el síndrome de Bloom y la ataxia- telangiectasia.
Anormalidades genéticas clonales adquiridas pueden encontrarse hasta en el 67% de los pacientes adultos con LLA, siendo las más frecuentes la t(9,22), t(4,11), t(8,14).
Radiación ionizante: la exposición a las bombas atómicas de Hiroshima y Nagasaki produjo un aumento en el riesgo relativo de 9,1. Otras poblaciones expuestas son los trabajadores con radium, y los pacientes irradiados, paradójicamente, por enfermedades benignas.
Con relación al benceno, los estudios de casos y controles han encontrado aumento de 4,5 veces en el riesgo de leucemia y daño citogenético.
El cigarrillo es factor de riesgo, tanto para leucemia linfoide aguda (LLA) como para la leucemia mieloide aguda (LMA), con mayor incidencia en la población mayor de 60 años.
De los virus implicados, el HTLV-1 ha sido identificado como causa de leucemia/ linfoma de células T en humanos y el virus Epstein-Barr ha sido asociado con la oncogénesis en LLA B, en el linfoma Burkitt epidémico y en los linfomas asociados al HIV.
Cuadro Clínico
Los síntomas pueden ser insidiosos y lentamente progresivos, pero más frecuentemente son agudos y explosivos. Los síntomas y signos resultan de la falla medular o del compromiso de sitios extramedulares por la leucemia. Y los síntomas mas comunes son fatiga, letargia, fiebre, pérdida de peso y dolor óseo o en las articulaciones.
En el examen físico los hallazgos más comunes son esplenomegalia, linfadenopatía, hepatomegalia, púrpura. El recuento de leucocitos está elevado en un 60% de los casos en el momento del diagnóstico. Puede presentarse compromiso del sistema nervioso central hasta en el 5% de los pacientes en el momento del diagnostico, o compromiso mediastinal si se trata de una leucemia de linaje T.
Diagnóstico
La demostración de linfoblastos en cantidad mayor del 30% en la medula ósea establece el diagnóstico. La precisión en el diagnóstico y la clasificación pueden requerir el uso de técnicas como histoquímica, inmunofenotipo y estudio citogenético. Rutinariamente se deben ordenar radiografía de tórax, para descartar la presencia de masa mediastinal, un perfil bioquímico y demás pruebas, de acuerdo con la condición especial del paciente.
Factores Pronósticos
Se consideran factores de mal pronóstico una edad mayor de 35 años, fenotipo de célula B madura, presencia de cromosoma Filadelfia, tiempo en adquirir la remisión completa mayor de cuatro semanas, leucocitosis >50.000 y compromiso del sistema nervioso central.
Los adultos con LLA tienen un pronóstico pobre. En el estudio del Grupo Cooperativo Italiano, en los paciente menores de 60 años la supervivencia media libre de enfermedad fue de 17 meses. Sólo 25% exhiben remisiones completas que se prolongan a 10 años. Con los tratamientos actuales, se logran tasa de remisión completa en 65-85% de los pacientes diagnosticados de novo, pero desafortunadamente 60-70% de los que obtienen una respuesta completa, recaen. En forma global, sólo 20% a 30% de los pacientes son curados de su enfermedad.
Clasificación
La LLA se diagnostica con base en la morfología celular y en la citoquímica y se subclasifica por inmunofenotipos. Aproximadamente 20% de las LLA son de origen T, 75% son de célula precursora B y 5% son de célula B madura, algunas veces llamadas tipo Burkitt (LLA L3).
Los parámetros morfológicos y citoquímicos son contemplados en la clasificación FAB (Franco Américo-Británica) que unificó los criterios diagnósticos:
L1 Células predominantemente pequeñas con escaso citoplasma y un cleolo poco aparente, mieloperoxidasa negativa y TdT usualmente positiva.
L2 Población heterogénea, con predominio de blastos grandes, moderada cantidad de citoplasma, borde nuclear irregular y un cleolo bien definido, mieloperoxidasa negativa y TdT usualmente positivo.
L3 Población homogénea de grandes blastos. Citoplasma intensamente azul con abundantes vacuolas, núcleo regular con uno o más núcleos los bien aparentes. TdT negativo. Se asocia con t(2;8), t(8;14) ot (8 ;22).
Clasificación inmunológica:
El uso de anticuerpos monoclonales permite clasificar las leucemias de acuerdo al estado evolutivo de las células inmaduras de las diferentes líneas hematopoyéticas. Se realiza mediante la citometría de flujo. Las leucemias linfoides las clasifica en linaje B, T y no B no T, con sus diferentes estados evolutivos que van de pre-pre B a células maduras B o T.
Los anticuerpos CD 19, CD20, CD21, CD22, CD 10, reconocen linfocitos B.
Los anticuerpos CD1, CD2, CD3, CD4, CD5, CD7 y CD8 reconocen los linfocitos T. El HLA DR linfocitos B, monocitos y células T activadas.
Por medio de la citometría de flujo, se han separado las leucemias de linaje B en 4 grupos:
B muy temprana (pre-pre B) CD19+, HLADR+, TdT+, IgM citoplasmática negativa.
B temprana (pre B) CD10+/- CD19+, HLADR+, TdT+, IgM citoplasmática positiva.
LLA B común CD10+, CD19+, HLA DR+, TdT+, IgM citoplasmática negativa.
B madura DR+, CD19+, CD20+, TdT-, CD10-, inmunoglobulina de superficie positiva.
Las de linaje T fueron clasificadas en 3 diferentes grupos:
T: CD2+, CD5+, CD7+
T común: las anteriores mas CD 1+, CD3+, CD4- CD8-
Y T tardía: CD2+, CD5+, CD7+, CD1-,CD3+, CD4+ o CD8+

Tratamiento
Protocolo de quimioterapia alemán o Hoelzer modificado, que consta de una etapa de inducción que tiene dos fases, seguido por etapa de mantenimiento corto en con radioterapia profiláctica holoencefálica, intensificación para pacientes de alto riesgo y posteriormente reinducción. Finalmente el paciente pasa a mantenimiento corto por un lapso no inferior a 101 semanas.
Inducción
Fase I
Daunorrubicina 25 mg/m2 , IV, días 1,8,15, 22.
Vincristina 1,5 mg/m2, IV, días 1,8,15, 22.
Prednisona 60 mg/m2 , VO, días 1-28
Ciclofosfamida 650 mg/m2 , IV, días 1 y 15
(si es de linaje T)
Mielograma de control el día 28.
Fase II
Ciclofosfamida 650 mg/m2 , IV, días 29, 43, 57
Citarabina 75 mg/m2 , IV, días 31-34,38-41,45-48, 52-55
6 Mercaptopurina 60 mg/m2 , IV, días 29-57
Methotrexate 15 mg/m2 , IT, días 31, 38, 45, 52
Citarabina 50 mg IT, días 31, 38, 45, 52
Dexametasona 8 mg IT, días 31, 38, 45, 52
Radioterapia profiláctica holoencefálica. Semana 4-8, radioterapia mediastinal en caso de LLA-T.
Se realiza nuevo mielograma de control al finalizar esta fase.
Una vez haya recuperación hematológica se inicia Mantenimiento Corto (semana 10 a 18).
6 Mercaptopurina 60 mg/m2, IV, diariamente semanas 29-130
Methotrexate 20 mg/m2 , IV o VO, semanal, excepto 12 y 16
Citarabina 5 mg/m2 , IV, días 1-5 semanas 12+16
Etopósido 60 mg/m2 , IV, días 1-5 semanas 12+16
(Lea También: Linfomas no Hodgkin)
Reinducción
Debe ser iniciada a los 3 meses del diagnóstico. Si hubo retraso en el protocolo, se acortará el tiempo del mantenimiento corto. Realizar mielograma previamente.
Fase I
Dexametasona 10 mg/m2 , VO, días 1-28
Doxorrubicina 25 mg/m2 , IV, días 1, 8,15, 22
Vincristina 1.5 mg/m2 , IV, días 1,8,15, 22
Ciclofosfamida 650 mg/m2 , IV, día 1, (si se trata de linaje T)
Fase II
Ciclofosfamida 650 mg/m2 , IV, día 29
Citarabina 75 mg/m2 , IV días 1-5, semanas 12 y 16
Tioguanina 60 mg/m2, VO, días 29-42
Mielograma de control al finalizar la reinducción.
Mantenimiento largo
Se inicia una vez haya recuperación hematológica y se extendie por 101 semanas, completando así 130 semanas de tratamiento.
6-mercaptopurina 60 mg/m2 , VO, diario, semanas 29-130
Methotrexate 20 mg/m2 , VO/IV, semanal, semanas 29-30
Citarabina 75mg/m2 , IV, días 1-5 semanas 20+26
Etopósido 60mg/m2 , IV, días 1-5 semanas 20+26
Recomendaciones
Todo paciente que inicie este protocolo de tratamiento debe recibir antiamebianos y antihelmínticos.
La vincristina se administra como dosis máxima, 2 mg por dosis y el methotrexate 15 mg IT.
Si el paciente presenta masa mediastinal, se realiza radioterapia de mediastino durante la fase II de inducción y se inicia ciclofosfamida desde la primera fase de inducción en los días 1,15 y 28. Si existe compromiso del SNC, se induce con dosis altas de Ara C en la fase I de inducción, continuando con la fase II del protocolo, al igual que los pacientes diagnosticados como leucemia indiferenciada.
Pacientes mayores de 60 años se inducen con fase I, pasando posteriormente a mantenimiento largo.
Todo paciente, una vez alcance la respuesta completa, debe ser sometido a estudios de HLA, ante la posibilidad de ofrecer el transplante alogénico, si tiene donante compatible, para efectuarlo en primera remisión completa (RC) si es cromosoma Filadelfia positivo o cursa con t(4 ;11), o en segunda RC en los demás casos.
Si ocurre una recaída temprana (antes de haber iniciado el mantenimiento largo), según los factores pronósticos, se decide entre manejo paliativo o rescate con el protocolo de Ara C, etopósido (VP 16) y mitoxantrone (AME). En caso de recaída tardía (luego de 12 meses de RC), se debe iniciar la fase I de inducción adicionando L asparaginasa.
Si la recaída es testicular o en el SNC, se remite a radioterapia y se inicia inducción completa.
Para la recaída en el SNC se reinicia quimioterapia intratecal (IT), con aplicación de droga dos veces por semana hasta obtener tres muestras negativas consecutivas de LCR; se continúa semanal por 4 semanas, luego quincenal por dos meses y luego mensual hasta completar 6 meses.