¿Un fenómeno metaplásico o distrófico?
Dr. ÁNGEL EMILIO BERNAL BALÁEZ, M.S., Ph.D.
Estomatólogo. Universidad de La Habana. CUBA. Magister en Histología
Ph.D Patología Bucal. Profesor Asociado de la Facultad de Odontología.
Universidad Nacional de Colombia.
Palabras clave: Folículos Dentales ; Calcificaciones.
RESUMEN
Los Sacos Foliculares (FD), representan una estructura de frecuente manejo quirúrgico por parte de los odontólogos. La relativa escasa información de los mismos así como su reconocida relación con neoformaciones de diferentes complejidades biológicas, conforman el propósito general de la presente publicación.
Esta estructura es la última formación embriológica del diente en culminar el proceso de desarrollo diferenciación/involución y el mismo constituye una fuente incalculable de moléculas biológicamente activas las que se expresan inicialmente como factores de crecimiento determinantes para garantizar la erupción dental.
Con el objetivo de precisar la relación exitente entre las calcificaciones, observadas en los FD, y diferentes variables tales como la edad, sexo, localización anatómica y la presencia de restos epiteliales, se estudiaron 75 especímenes obtenidos quirúrgicamente, seleccionados de acuerdo a un conjunto de criterios de exclusión. Los mismos fueron procesados por la técnica de inclusión en parafina y coloreados con Hematoxilina y Eosina, PAS y von Kossa. Los datos obtenidos fueron volcados en gráficos confeccionados al efecto para su ulterior análisis matemático.
Se plantea una discusión sobre la presencia de las calcificaciones en estas estructuras como resultado de un fenómeno distrófico o metaplásico. Del mismo modo se presentan ilustraciones que describen las más frecuentes formas de presentación de estas calcificaciones inmersas en los FD. Es de destacar que el procedimiento estadístico evidenció dependencia entre la variable localización anatómica y las calcificaciones.
CONTROL SEMÁNTICO
Folículo Dentario (FD): Órgano en forma de saco dentro de los maxilares que contiene el diente antes de su erupción.
Saco Pericoronario: En el caso que el diente complete el desarrollo anatómico dentro del tejido óseo, la parte coronaria del FD se designa como SACO PERICORONARIO (SP), en el cual pueden permanecer restos epiteliales residuales de la lámina lateral o restos epiteliales de los brotes del epitelio externo que se introducen en el mismo.
Distrofia: (de dis- y el gr. trophé, nutrición) Lesión orgánica debido a un trastorno de la nutrición, local o general.
Metaplasia: (de meta- y el gr. plassein, formar). Producción por las células de una especie determinada de tejido distinto al que producen normalmente, cambio de un tejido en otro.
INTRODUCCIÓN
Los Folículos Dentales (FD), son parte de las estructuras inmaduras que componen la porción ectomesenquimatosa de los gérmenes dentarios. Ellos participan no sólo en la formación del cemento, sino también del ligamento periodontal (1) (2).
Desde el punto de vista radiográfico, el FD es una delgada radiolucidez semicircular alrededor de los dientes retenidos con un borde radiopaco, que en ocasiones puede presentar modificaciones en cuanto al aumento de espesor y asimetría. El espacio folicular debe medir hasta 2.5 mm en estudios radiográficos intraorales y hasta 3 mm en las panorámicas (3) (4).
Esta estructura es la última formación embriológica del diente en culminar el proceso de desarrollo diferenciación/involución y el mismo constituye una fuente incalculable de moléculas biológicamente activas, las que se expresan inicialmente como factores de crecimiento determinantes para garantizar la erupción dental (5) (6). Queda aún por establecer la participación en otros eventos de mayor complejidad biológica por su permanencia en los organismos vivos atendiendo a la potencialidad que le ofrecen la expresión de factores de crecimiento, receptores u otros mediadores biomoleculares.
Por un inevitable proceso filogenético, la retención dental es y será un fenómeno que acompañe al desarrollo y nuestras condiciones de vida, solamente un “salto” evolutivo con la desaparición de determinadas piezas dentarias lo evitaría. Ese cambio dialéctico, cuali-cuantitativo, es un acto de larga evolución.
Desde el punto de vista anatómico y conceptual, el SP permanece indefectiblemente unido al diente retenido, por lo que resulta fácilmente comprensible la necesidad de mejorar el conocimiento disponible sobre las características estructurales y su patogenicidad, ya que los libros de textos de la especialidad se encuentran carentes de una suficiente descripción tal y como aparecen otras estructuras y sus alteraciones.
La insuficiente información sobre el tema conduce, en no pocas ocasiones, a serias dificultades (7-10) y errores diagnósticos, aún entre profesionales calificados, llegando a demostrarse, en un estudio llevado a cabo por la Armed Forces Institute of Pathology (AFIP) (1993), hasta un 20% de fallas en la interpretación de los especímenes, un 10% sin diagnóstico y un 17% de los patólogos consultados solamente ofrecieron una descripción morfológica de las láminas recibidas (11).
El presente artículo pretende contribuir al enriquecimiento de los conocimientos existentes sobre la histomorfología de los SP, su participación en la etiopatogenia de neoformaciones odontógenas y diagnósticos diferenciales con lesiones afines. Al cumplirse este propósito estaremos colaborando con el Programa de la Organización Mundial de la Salud (OMS) para la reducción de Enfermedades no Transmisibles (12), teniendo en cuenta los ya impresionantes reportes sobre neoplasias orales en el país (13)(14).
OBJETIVOS
1.- Determinar si la aparicióm de calcificaciones en el SP de los dientes retenidos es dependiente de la edad, el sexo y la localización anatómica.
2.- Determinar si existe dependencia entre los restos epiteliales inmersos en el estroma de los SP y las calcificaciones.
METODOLOGIA
Materiales:
Se seleccionaron 75 SP de dientes retenidos, obtenidos de pacientes a los cuales se les realizó exeresis quirúrgica de los mismos teniendo en cuenta:
a. Que las raíces hubieran completado 2/3 o más de su desarrollo anatómico y que sus coronas permanecieran inmersas en el tejido óseo circundante.
b. Que en la hoja de solicitud de examen histopatológico no se reportaran datos sugerentes de anormalidad imagenológica por parte del cirujano.
c. Que al examen macroscópico de la relación saco-corona del diente ésta se encontrara firmemente adherida a la superficie del esmalte.
Método:
Para la obtención de los fragmentos se separó el SP de la corona anatómica del diente utilizando hojas de bisturí (Fig. 1). Una vez separado el SP se obtuvo un fragmento rectangular practicándose un corte al tejido de la cara vestibular adyacente al cuello del diente, siguiendo una orientación mesiodistal, de manera que el espesor del bloque de tejido seleccionado correspondiera a una franja aproximadamente de más de 3mm de ancho. Los fragmentos fueron incluidos perpendicularmente en parafina siguiendo la técnica descrita por McManus (15), realizándose cortes para el estudio microscópico de un espesor que osciló entre 3 y 5 micras. Se emplearon las coloraciones de Hematoxilina y Eosina, PAS y von Kossa (16).
 Fig. 1 :
Fig. 1 :
Fotografía que ilustra el procedimiento para la obtención de los cortes de tejido del SP.
En los cortes microscópicos obtenidos según la metodología ya descrita, se consideraron calcificaciones aquellas formaciones teñidas de azul, con la Hematoxilina y Eosina, de bordes precisos o bien definidos. Las estructuras que se correspondían con la mencionada morfolofía y basofilia fueron corroboradas con la coloración de von Kossa.
aquellos cortes donde las calcificaciones aparecían en un solo campo fueron consideradas como ESCASAS y la ausencia de calcificaciones se consideró como patrón AUSENTE.
La evaluación de la disposición de las células epiteliales inmersas en el SP se efectuó recorriendo cada fragmento en su totalidad con una amplificación de 120 aumentos. La observación se consideró como ABUNDANTES, cuando las células epiteliales aparecían en 2 o más campos microscópicos. ESCASAS cuando las células se encontraron en un solo campo microscópico y AUSENTE cuando no se encontraron células en toda la superficie de estudio del corte.
Los datos obtenidos fueron registrados en Tablas y Gráficos confeccionados al efecto, en los que se resumen los resultados de las diferentes variables analizadas. Se realizó la Prueba de Contingencia (chi-cuadrado) para analizar la dependencia e independencia de las variables tratadas conjuntamente (17). El nivel de significación utilizado fue 0.05.
RESULTADOS
El estudio histomorfológico del SP evidenció que esta estructura se encuentra constituida por tejido conectivo fibroso maduro o de aspecto mixoide, en el seno de los cuales aparecen diversos elementos tales como, células epiteliales agrupadas de diferentes formas y calcificaciones de morfología y arquitectura variable.
Cualitativamente las calcificaciones se evidenciaron en dos formas diferentes, estas eran estructuras romboideas de bordes aristados que se disponían en depósito irregular o asumían formas redondeadas, vinculadas en inmediata proximidad con células epiteliales (Figs. 2 y 3).
 Fig. 2 :
Fig. 2 :
Obsérvese el aspecto característico de las calcificaciones descritas como estructuras
de bordes aristados, que se disponen en depósitos irregulares. (H/E 20x).

Fig. 3 :
Calcificación de bordes redondeados en la que se observan líneas y zonas
de basofilia irregular, lo que evidencia un patrón “rítmico” de calcificación. (H/E 100x).
Es de destacar que en diversas observaciones se presentó la sedimentación de una matriz poco calcificada de aspecto cementoide (Fig. 4).
 Fig. 4 :
Fig. 4 :
Micrografía en la que se identifica sedimentación de matriz
calcificada de aspecto cementoide o hueso acelular. (H/E 20x).
Otra observación interesante es que en múltiples calcificaciones la superficie de sección dibujó planos de aposición de material calcificado similares a los anillos de Liesegang descritos en el tumor odontogénico epitelial calcificante (Fig. 5).
 Fig. 5 :
Fig. 5 :
Nido de calcificación cuya superficie reproduce aposición laminar concéntrica
similar a los anillos de Liesegang descritos en el TOEC. (H/E 40x).
Las células epiteliales inmersas en el SP se presentaron generalmente como agrupaciones o cordones de 3 a 4 hileras de células (Fig. 6). Con frecuencia parecieron estructuras de rasgos morfológicos similares a los descritos para las glándulas de Serres (Fig. 7).
 Fig. 6 :
Fig. 6 :
Disposición habitual de restos de epitelio odontogénico inmersos en el estroma del SP. (H/E 40x).
Fig. 7 :
Anillo epitelial con material central eosinófilo. Esta estructura presenta aspecto morfológico similar al dscrito en las glándulas de Serres. (H/E 40x).
Es de destacar que en el procedimiento matemático se observó dependencia entre la variable localización anatómica y las calcificaciones, no observándose similar comportamiento en las variables grupos de edades, sexo, y células epiteliales (Ver Gráficos 1, 2, 3 y 4).
 GRÁFICO 1 Presentación de calcificación y su relación con el sexo |
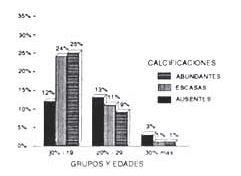 GRÁFICO 2 Presentación de calcificación distribución por edades.
|
 GRÁFICO 3 Presentación de calcificación localización anatomica |
 GRÁFICO 4 Relación entre restos epiteliales y calcificaciones |
DISCUSIÓN
El FD ha sido, en los últimos años, ampliamente estudiado, razón por la cual la información científica registra abundantes artículos al respecto (18-21), sin embargo, contradictoriamente, no sucede lo mismo con el SP, a pesar de sus posibles implicaciones patológicas. Esta paradoja es el resorte fundamental que ha motivado el desarrollo del presente estudio como parte de una línea de investigación.
Los resultados de los estudios sobre los FD en los últimos años han creado, a nuestro juicio, grandes inquietudes y nuevas espectativas, teniendo en cuenta las investigaciones biomoleculares destinadas al aislamiento del Factor de Crecimiento Epidérmico y su Receptor (EGF y EGF-receptor) en el folículo dental, los cuales constituyen un factor aparentemente fundamental para la erupción del diente (22,23).
Lamentablemente existe una gran tendencia a perder los nexos entre los fenómenos de nuestro entorno debido, tal vez, al inmenso caudal de información. El consabido aislamiento y determinación de los mencionados Factores de Crecimiento en esta estructura, debe crear una nueva inquietud sobre su posible permanencia dentro del SP en aquellos en que no ocurra un adecuado proceso de erupción dentaria donde determinados elementos promotores endógenos o exógenos influyen en la sobreexpresión del EGF y EGF-r a través de sus oncogenes codificantes. Este puede ser el punto de partida para el surgimiento de neoformaciones a partir de los SP inmersos por prolongados períodos de tiempo unido, como ya es conocido, a su respectivo diente retenido.
Nuestra alerta es corroborada por la presencia del oncogen C-fos, el que presuntivamente es estimulado por el Factor 1, estimulante de colonias (CSFG-1), decisivo en el proceso de erupción. Este mismo oncogen tiene una activa participación en los procesos de carcinogénesis y el desarrollo de melanomas malignos (24-26).
Elsay (27) y Dhalin (28), señalan la posibilidad de que el tejido conectivo del FD de lugar al componente fibroso de las neoplasias odontógenas, lo que teniendo en cuenta la frecuente asociación de dientes retenidos-tumores odontógenos reportada por otros autores (29, 30), pensamos que el SP posee la capacidad potencial , para que a partir de él se generen una buena parte de las neoformaciones de los tejidos dentarios, presunción que se refuerza por la semejanza morfológica entre los rasgos celulares de dichas neoformaciones y los elementos constituyentes del SP, como es el caso específico de aquellos completamente constituidos por tejidos mixoides. Por otra parte, desde el punto de vista diagnóstico, su aspecto microscópico puede ser confundido con un tumor, principalmente cuando las evaluaciones microscópicas se realizan por los especialistas que no están familiarizados por la variabilidad morfológica del SP (31, 32).
Con la reacción PAS eventualmente las agrupaciones epiteliales presentaron reactividad.
Por la capacidad de estas células para producir glucosaminoglicanos y organizarse como estructuras glanduloides es por lo que consideramos posible que a partir de dichas estructuras epiteliales puedan desarrollarse los tumores odontogénicos adenomatoides, muchas veces involucrando a un diente retenido y sobre cuyo origen y caracterización existe una complicada discusión desde la década de los 60’s (33, 34).
La aparición de calcificaciones solamente presentó dependencia estadística con la localización anatómica, lo que puede constituir un interesante punto de partida para futuras investigaciones (Gráfico 3). Al analizar la distribución de estas estructuras por grupos de edades observamos que se reduce su aparición con la edad, lo cual también puede resultar de gran interés con una casuística ampliada.
La relación calcificaciones- población celular es un terreno de amplio marco teórico para interpretar las calcificaciones como resultados de metaplasias a partir de restos epiteliales, productos de secreción o inclusive de origen distrófico atendiendo a la frecuente presencia de microhemorragias observadas en los cortes histológicos, lo que puede guardar relación con el trauma ocasionado por intentos eruptivos.
Este hallazgo coincide con los informes de Arwill (35) quien refiere una estrecha relación entre la presencia de hemorragias y calcificaciones o cuerpos hialinos atribuibles a una probable degeneración de nidos de epitelio odontogénico. Bergman (36) y Zegarelli (37), con anterioridad, habían planteado este fenómeno como calcificaciones de restos epiteliales. Mincer (38) a partir de un estudio ultraestructural sugiere el origen distrófico de las mismas. En nuestra opinión, atendiendo al origen y características de la población celular inmersa en los SP, puede tratarse de un fenómeno metaplásico a partir de una totipotencialidad de diferenciación particular de su estirpe embriológica.
Al margen de esta discusión, que puede convertirse en un interminable ensayo teórico, resulta evidente que se trata de una línea de investigación que responde a los intereses de aprendizaje y superación del gremio odontológico atendiendo a la escasa información sobre los SP. Estos especímenes son de fácil adquisición por ser el resultado de una de las más frecuentes actividades en los consultorios. Habitualmente, estas muestras, no son enviadas a estudio histológico y hay que reconocer que su destino habitual es “ser archivadas en el basurero de la ciudad”, por lo que podemos denominar a nuestra gestión inicial destinada a la obtención de muestras, en sentido figurado, “un reciclaje científico”, lo que abarata los costos de la investigación.
Es muy probable que la aceptación de postulados, presuntamente ya establecidos en torno al tema, explique el anterior proceder y no se repare en ello. Debemos recordarle a los lectores, ávidos de novedosas concepciones, que no hay asuntos agotados, ni verdades absolutas, ni temas científicos con títulos de propiedad. Lo que existen son pseudocientíficos, desde luego sin obras de sustento, y críticos sin valor personal y cognoscitivo, incapaces de enfrentar el reto que les ha impuesto la vida, llevando consigo en su indefectible decadencia a los jóvenes valores, sometiéndoles a una eterna sombra con la consiguiente inseguridad profesional que esto genera.
CONCLUSIONES
La aparición de calcificaciones resultó dependiente de la localización anatómica (Signif.: 0,0005). No se encontró dependencia de las mismas con las variables grupos de edades y sexo.
No se encontró dependencia estadística entre las calcificaciones y la concentración de restos epiteliales en los SP estudiados.
REFERENCIAS BIBLIOGRÁFICAS
1.- Orban, B.J.: Histología y Embriología Bucales. Instituto Cubano del Libro. La Habana, Editorial Pueblo y Educación, 1973. P. 18.
2.- Ten Cate, A.R.: Oral Histology: Development, Structure and Function. Ed. 3. St. Louis, MO, Mosby, 1989. P. 61.
3.- Stafne, E.C. and J.A. Gibilisco: Oral Roentgnographic Diagnosis. Philadelphia, WB Saunders, 1975. P.149.
4.- Langland, O.E, Langlais, R.P. and C.R. Morris: Principles and Practice of Panoramic Radiology. Philadelphia, Lea & Febiger, 1991. P.255.
5.- Wise, G.E., Lin, F. and W. Fan: Localization of EGF and its receptor in mandibular molars of the rat prior to and prefuntional tooth eruption. Dev Dyn 195: 121, 1992.
6.- Benito, G.Q. and G.E. Wise: Colony-stimulating factor-1 and monocyte chemotactic protein-1 chemotaxis for monocytes in the rat dental follicle. Archs Oral Biol 42:855,1997.
7.- Mallow, R., Spatz, S.S., Zubrow, H. and S. Kline: Odontogenic fibroma with calcification. Oral Surg 22:564, 1966.
8.- Hirshberg, A., Buchner, A. and D. Dayan: The central odntogenic fibroma and hiperplastic dental follicle: study with Picrosirius red and polarizing microscopy. J Oral Pathol 25:125, 1996.
9.- Lukinmaa, P.L., Hietanen, J., Antinen, J. and P. Ahonen: Contiguos enlarged dental follicles with histologic features resemblig the WHO type odontogenic fibroma. Oral Surg Oral Med Oral Pathol 70:313, 1990.
10.- Milkler, C.S. and L.R.Bean: Pericoronal radiolucencies with and without radiopacities. Dent Clin North Am 38:51, 1994.
11.- Kim, J. and G.L. Ellis: Misinterpretation as Odontogenic Tumors. J Oral Maxillofac Surg 51:762, 1993.
12.- WHO Integrated Programe for the prevention and copntrol of noncommunicable diseases. Manila, 1982. P.1.
13.- Bernal Baláez, A.E. y V.H. Montes Campuzano: Situación Actual del Cáncer Bucal en Colombia. Rev. Federación Odontológica Colombiana No. 191 May/Oct, 1997. P.13.
14.- Bernal Baláez, A.E. y V.H. Montes Campuzano: Reflexiones sobre el Cáncer Bucal en Colombia.Rev. Federación Odontológica Colombiana No. 187. Noviembre/95 – Marzo/96. Pág.29.
15.- McManus, J. F. and R. W. Mowry: Técnica histológica. III Ed. Atika. S.A., Madrid, 1968. P. 134.
16.- Christian, B. H.: Histologische technick: leicfaden fur die herstellung mikroskopicher praparate in unterricht and praxis. I Ed., Georthiema verlag. Sttutgart, 1966. P.146.
17. Dixon, W. J. and F. J. Massey: Introducción al Análisis Estadístico. II Ed. Instituto Cubano del Libro. La Habana, 1992. P.217.
18.- Bhavna, S., Kathleen, N. and R. Pileggi: Protease activity in the mouse dental follicle during tooth eruption. Archs oral Biol. 40:331, 1995.
19.- Shroff, B., Pileggi, R., Norris, K., et al: Dynamic variations iln the expression of type I collagen and its molecular chaperone Hsp47 in cells of the mouse dental follicle during tooth eruption. Archs oral Biol. 39:231, 1994.
20.- Larson, E. K., Cahill, D. R., Gorski, J. P., et al: The effect olf removing the true dental follicle on premolar eruption in the dog. Archs oral Biol. 39:271, 1994.
21.- Bidwell, J. P., Fey, E. G. and S. C Marks: Nuclear matrix-intermedite filament proteins of the dental follicle/enamel epithelium and their changes during tooth eruption in dogs. Archs oral Biol. 40:1047, 1995.
22.- Lin, F., Zhao, L. and G. ,E. Wise: In vivo and in vitro effects of epedermal growth factor on its receptor gene expression in rat dental follicle cells. Archs oral Biol. 39:271, 1994.
23.- Shroff, B., Kashner, J. E., Keyser, J. D, Hebert, C. and K. Norris: Epidermal growh factor and epedermal growth factor-receptor expression en the mouse dental follicle during tooth eruption. Archs oral Biol. 41:613, 1996.
24.- Wise. G. E., Marks, S. C. and L. Zhao: Effect of CSF-1 on in vivo expression of c-fos in the dental follicle during tooth eruption. Eur. J. Oral Sci. 106:397, 1998.
25.-Bergman, R., Kerner, H., Manov, L. and R. Friedman-Birnbaum: C-fos protein expression in Spitz nevi, common melanocytic nevi, and malignant melanomas. Am J Dermatopathol 20:262, 1998.
26.- Yuspa, S. H.: The pathogenesis of squamous cell cancer: lessons learned from studies of skin carcinogenesis. J. Dermatol. Sci 17:1, 1998.
27.- Elsay, P. R. , Dutz, W.: Mixomas of paraoral – oral soft tissues. Oral Surg. 45:246, 1978.
28.- Dhalin, D. C.: Tumores oseos. II ed. Ediciones Toray, S. A., Barcelona, 1980. P. 414.
29.- Martinelli, C.: Adenoameloblastoma, histologic and histochemical in one case. Oral Surg. 28: 534, 1974.
30.- López Acevedo, C.: Manual de patología oral. I Ed. Editorial Universitaria. Guatemala, 1975, P. 253.
31.- Gardner. D. G.: The central odontogenic fibroma: an attemp at clarification. Oral Surg Oral Med Oral Pathol. 50:425, 1980.
32.- Gardner. D. G. And B. Radden: Multiple calcifying hyperplastic dental follicles. Oral Surg Oral Med Oral Pathol Oral Radiol Oral Endod. 79:603, 1995.
33.- Abrams, A.: Adenoameloblastoma. A clinical – pathologic study of ten new cases. Cancer 22:175, 1968.
34.- Ebing, H.: Adenoameloblastoma. Oral Surg. 26:674, 1968.
35.- Arwill, T.: Hyaline bodies and odontogenic epithelium in the follicles of unerupted permanent human teeth. Acta Odont Scand 32:15,1974.
36.- Bergman, G., Lysell, L. And J.J. Pindborg: Unilateral dental malformation. Oral Surg 16:48, 1963.
37.- Zegarelli, E.V., Kutscher, A., Applebaun, E., et al: Odontodisplasia. Oral Surg 16: 187,1963.
38.- Mincr, H.H., McGinnis, J.P. and J.B. Wyatt: Ultrastructure os sclerotic cemental masses. Oral Surg 41:10,1977.