Localización del Tumor
Estudio imagenológico
El ultrasonido (U) de la glándula adrenal (g.a)
El U. se utiliza en el adulto para detectar masas adrenales de 3 o más centímetros de tamaño. Nos describe sus características: sólida o quística, mixta u homogénea, discreta o difusa. En otras palabras, es más difícil identificar la g.a. izquierda por ser a menudo obscurecida con el gas del estómago y del colon. El U. no es útil para visualizar hiperplasia y para diferenciar benignidad de malignidad.
El U. será de mayor efectividad en detectar enfermedades adrenales de niños menores. La g.a. puede ser identificada con la ecografía en el feto, en el estado tardío del embarazo. Se ve como una estructura en forma de Y invertida, con una corteza hipoecoica y una médula hiperecoica.
Después del nacimiento la g.a. disminuye de tamaño en el período temprano neonatal. Una g.a. aplanada en el feto y en el neonato significa indirectamente la ausencia de un riñón en el flanco y es un signo sonográfico de agenesia o ectopia renal. En los primeros meses de embarazo emplear el U. Utilizar el TAC en embarazos más avanzados.
La tomografia axial computarizada (TAC).
Basados en la presencia de grasa macroscópica, lípidos intracelulares, hemorragias, cambios quísticos y vasculares, forma, tamaño y evolución del tumor. Un radiólogo experimentado utilizando la moderna tecnología del TAC y la RM puede confirmar el diagnóstico de masas adrenales incluyendo adenomas, hiperplasias, quistes simples y complicados, linfagiomas, mielolipomas, feocromocitomas, hemorragias, carcinoma cortical, neuroblastomas, linfomas y metástasis
Protocolo del TAC
El TAC simple nos marca la densitometría de la masa (grado, medida, señal, promedio de atenuación, intensificación o reforzamiento).
Sí la masa tiene una atenuación de 10 unidades Hounsfield (H.U) o menos, se presume que se trata de un predominante adenoma rico en lípidos y no se requiere de nueva evaluación.
Si la atenuación sobrepasa las 10 H.U, se recurre al TAC helicoidal contrastado con imágenes tomadas al minuto y 10 minutos de inyectado el medio de contrate (galodinium).
En la fase inicial (un minuto) los adenomas ricos o no en lípidos, el grado de atenuación es significativamente más bajo (8 H.U +1 desviación Standard) que los no adenomas (Ca adreno-cortical, feocromocitoma y metástasis), 34 a 44 + 1 (d.s). En el barrido del material de contraste tardío (10-15 minutos), el promedio de atenuación es significativamente más bajo en los adenomas que en los no adenomas. No habiendo diferencia entre estos 3 últimos.
Hoy en día se anuncia la salida al mercado de modernos escanógrafos con múltiples detectores como el TAC 64 y el PET/TAC con emisión de positrones, dando mayor seguridad al diagnóstico.
La resonacia magnética
Tiene una más alta sensibilidad en detectar f.s extradrenales, recurrentes y metastá sicos. La habilidad de la RM para directamente formar imágenes en los planos sagital y coronal. Permite que grandes regiones anatómicas sean retratadas en un corto período de tiempo.
Los f.a. tienen una señal de intensidad más alta que los adenomas adrenales no funcionantes. La RM está siendo usada con mayor frecuencia durante el embarazo para evitar toxicidad de las radiaciones ionizantes de los escanógrafos.
Los modernos resonadores tienen mayor protección, fácil lectura y menor margen de error.
La gamagrafía
Hasta hace poco tiempo la gamagrafia utilizando el compuesto metaiodobenzilguanidina (MIBG) un análogo de la norepinefrina, absorbido por el tejido cromafin meduloadrenal, las estructuras extraadrenales y las metástasis, era un valioso auxiliar en el Dx del F. Este método tenía la ventaja de no producir la peligrosa irradiación que provocaban los escanógrafos antiguos.
La desventaja era su alto costo monetario y muchos centros radiológicos o de medicina nuclear no lo practicaban. Además tenían un margen de error de un 10%. Hoy en día ha caído en desuso por la segura y moderna tecnología imagenológica.
Hallazgos Morfológicos
El peso de los f.a varía de unos pocos gramos a más de 2.000 gramos. Son encapsulados, usualmente lisos y al corte presentan una coloración blanco amarillenta o castaño rojiza. Fijado el tejido en solución de Zenker adquiere el típico color castaño oscuro indicativo de reacción positiva cromafin. Los tumores grandes a menudo contienen áreas de necrosis, hemorragia y formación quística. La glándula adrenal está comprimida o incorporada dentro del tumor.
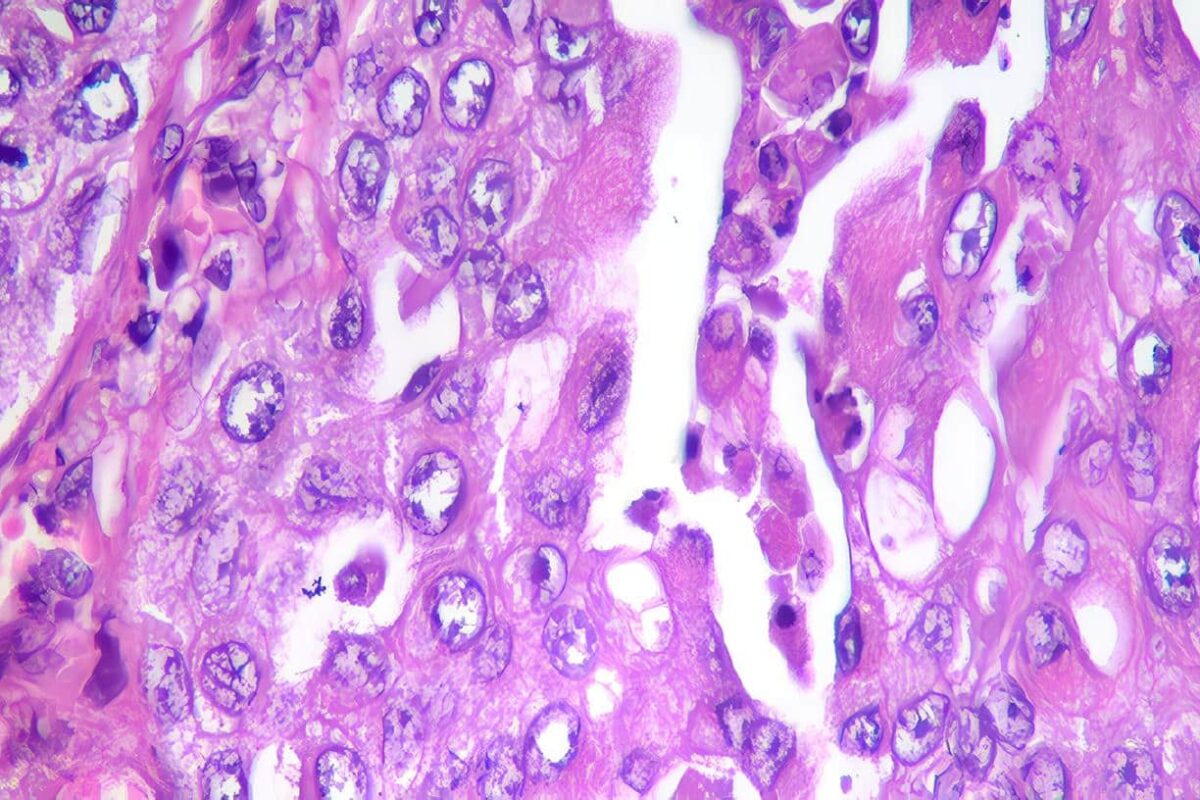
Hallazgos Microscopicos
Con la corriente tinción de hematoxilinaeosina es difícil distinguir una tumoración benigna de una maligna. Las células del F. varían de tamaño y de forma (oval o poliédrica), se dispone en nidos rodeados de un delicado estroma fibro-vascular, el cual puede tener amiloidea. El citoplasma contiene finos gránulos eosinófilicos (neurosecretores).
El núcleo usualmente redondo u oval con uno o dos nucleolos prominentes, puede contener estructura como inclusiones, resultantes de las profundas invaginaciones citoplasmáticas. Los glóbulos hialinos intracitoplasmáticos son comunes. La acumulación de lípidos puede desarrollarse en el citoplasma y llevar a confusión con los tumores cortico-adrenales. El gigantismo nuclear y la hipercromasia son comunes y no son una expresión de malignidad.
Las figuras mitóticas son raras y la invasión vascular no es aparente. Múltiples focos de cuerpos hilianos característicos del F, son demostrados positivamente con la reacción de Schiff del ácido periódico. Ni la invasión capsular ni la invasión vascular significa malignidad.
(Lea También: Nefrectomía para Hematuria Intratable de Etiología Incierta)
Hallazgos Inmunohistoquímicos
Secciones de tejido deparifinizado fijados en solución de Bowin con el método de la peroxidasa-antiperoxidasa, método descrito por Sternberger, se utilizan para practicar las pruebas inmunohistoquímicas.
Las células de f.a. son siempre reactivas para las catecolaminas, enzimas catecolaminosintetisantes, enolasa neurona específica, cromagraninas, inhibina, sinaptofisinas, vicentina y péptidos opioides (leucoencefalinas, betaendorfinas y otros), también pueden mostrar positividad para neuro-filamentos, serotoninas, somatostatina, calcitonina, gastrina, sustancia P,neuroéptido y, galanina,colecistoquinina, renina, péptido intestinal vaso-activo, corticotropina etc.
Kimura y colaboradores encontraron citokeratina y vimentin aproximadamente en un cuarto de pacientes con f.a.. Curiosamente la keratina fue detectada en tumores adrenales pero no en los extradrenales. Sasaki y col encontraron un similar patrón para corticotropinas, factores liberadores de la hormona del crecimiento y para el péptido histidina-metionina.
Ocasionalmente el tumor puede excretar ACTH y resultar en un síndrome de Cushing, o este puede producir hormona paratiroidea y resultar en hipercalcemia.
Tratamiento
El tratamiento óptimo para el f.a. es la pronta extirpación quirúrgica, porque este tumor presenta consecuencias potencialmente letales si no se extrae completamente. Apropiada terapia médica seria ofrecida antes, durante y después de la cirugía. Los pacientes con f.a. hiperfuncionantes requieren tratamiento antihipertensivo antes de la cirugía, alfabloqueadores seguidos de betabloqueadores.
Durante el acto quirúrgico los cirujanos y el anestesiólogo deben estar preparados con la medicación apropiada para controlar cualquier crisis hipo-hipertensiva o arritmias cardiacas que ponen en peligro la vida del paciente. Los tumores no hiperfuncionantes mayores de 5 centímetros son rutinariamente removidos en algunos centros por el riesgo de ser un carcinoma cortico-adrenal.
Los pacientes con tumores malignos no resecables o tumores metastáticos y para aquellos que no son candidatos quirúrgicos adecuados. El manejo médico puede ser efectivo por largos periodos de tiempo.
La terapia de radiación ha sido exitosa para palear síntomas secundarios a metástasis óseas. Combinada con la quimioterapia, al mismo tiempo controla las metástasis de tejidos blandos. Esporádicas respuestas a la ciclofosfamida y doxorubicina han sido reportadas. El f.a que pasa desapercibido durante el embarazo presenta un alto índice de mortalidad materna, en un 48% y fetal 55%.
Por lo tanto, si se diagnostica antes de terminarlo, el porcentaje de mortalidad cae abruptamente. En la segunda mitad del embarazo el tratamiento médico es esencial hasta que el feto obten ga mayor madurez, tiempo en el cual, el tumor es removido.
Los tumores localizados en el polo superior de los riñones
Están más asociados con metástasis adrenales. La adrenalectomia en casos de grandes tumores del polo superior ha revelado el 8% de micrometástasis. Además de eso, La adrenalectomia es reconocida como una parte de la nefrectomía radical y se sugiere rutinariamente eliminar las potenciales micrometástasis presentes en la g.a.. Posiblemente mejorando el porcentaje de curación.
El tiempo de supervivencia de pacientes con histopatológicamente detectadas metástasis a la adrenal del mismo lado es conocido como extremadamente corto. Esto indicaría que la adrenalectomía es solamente de importancia diagnóstica y que el beneficio terapéutico es extremadamente dudoso. Mas aún se puede precipitar a una insuficiencia adrenal si la otra glándula presenta alteraciones.
Bibliografía
- 1. Adrenocortical Carcinomas and Adrenal Pheochromocytomas. Mass and Enhancement loss. Evaluation at delayed contrast-enhanced CT. Radiology R.S.N.A. (The Radiological Society of North America. Pages 479 – 485. 2005).
- 2. Adrenal Masses: MR. Imagin Features with Pathologic Correlation RSNA: Pages 573 – 586. 2004.
- 3. Neurogenic Tumors in the abdomen and Imaging Characteristics. RSNA. Pages 29 – 43.
- 4. Adrenal Masses: Characterization with combined Unenhanced and Delayed Enhanced C.T. R.S.N.A. March 2002. Vol 222 #3.
- 5. Renal Masses: Quantitative Assessment of Enhancement with Dynamic MR Imagin R.S.N.A. September 2002. Vol 224 #3.
- 6. Fundamentos de Medicina Endocrinología. 5° edición, Arturo Orrego M. Medellín, Colombia.
- 7. Adrenal gland and other paraganglia Pathology of Akerman. Page 1136 – 1139.
- 8. Pheochromocytoma. Isaac Francis. Advances in radiology. Radiologic Clinic of North America RCNA II. November 1966.
- 9. The incidental adrenal Mass. Melvgn Korof Kin. M.D. R.C.N.A. Sept 1966.
- 10. Adrenal, Pancreatic, and Scrotal ultrasound in Endocrine Disease. G.A.W Gooding MD R.C.N.A. Sept 1993.
- 11. The Dilemma of bilateral adrenocortical Nodularity in Conn´s and Cushing’s Syndromes J.L. Doppmar, MD R.C.NA, Sept 1993
- 12. Pheochromocytoma in the pediatric age group. The prostate an unusual Location G.E. Voges, J.U. vol 14 November 1990
- 13. The adrenal glands. W.P. SHUMAN. COMPUTED, TOMOGRAPHY OF THE BODY. Edited by Alberth A Moss. 1990.
- 14. An adrenocorticootropic hormone-producing Pheochromocytoma: Diagnostic and inmunohistochemical studies J:U: vol 135 January 1986 R.S. Beaser.
- 15. A new method of identifying Pheochronscytoma and proving that a «Mass» is a Pheo. J:U. vol 134. July.
- 16. Pheochromocytoma with hypercalcemia: case report and review of literature a.m. shanberg. J:U: February 1985. Vol 133.
- 17. Familial Pheochromocytons. E.S tank J:U: vol 128. November 1982.
Enviado para publicación: Noviembre de 2006
Aceptado para publicación: Noviembre de 2006