Resultados del análisis macroscópico:
Como ya se mencionó dos conejos murieron por efecto de la anestesia y se substituyeron de inmediato, no se presentó ninguna otra complicación o exclusión de algún conejo.
Al completar las doce semanas los conejos se sacrificaron, se extrajo el extremo distal del fémur izquierdo, con los siguientes hallazgos:
Llenado completo del defecto en los tratados con glucosamina. Conejos1, 2, 4, 5, 8, 11, 12, 15, 18, 20. Figura 2. Llenado parcial del defecto en los que no recibieron ningún fármaco. Conejos3, 6, 7, 10, 13, 16, 17, 19. Figura 3. Llenado completo del defecto en conejos que no recibieron glucosamina. Conejos9, 1.
 |
 |
| Fig 2. Al analizar macroscópicamente las rodillas tratadas con glucosamina se observa el defecto totalmente cicatrizado o curado. | Fig. 3. Al analizar macroscópicamente las rodillas sin aplicación de glucosamina, persiste el defecto en forma parcial. |
En síntesis todos los conejos que recibieron glucosamina intraarticular presentaron llenado completo del defecto, por el contrario se evidenció persistencia en algún grado del defecto en aquellos que no recibieron glucosamina, excepto en dos conejos que si cicatrizaron.
El porcentaje de cicatrización dado por el análisis macroscópico fue:
| Con glucosamina: Sin glucosamina: |
10/10 = 100% de cicatrización. |
Los resultados expresados en tablas de contingencia fueron:
|
CON |
SIN |
||
| CICATRIZACIÓN NO CICATRIZACIÓN |
10 |
2 |
12 |
De acuerdo al análisis estadístico se aplico el test de Fisher por bajo tamaño de muestra y celdas de bajo número.
Resultado con el test de Fisher: P = 0.00035
Este valor P le da validez estadística al análisis epidemiológico, lo cual confirma que la glucosamina si ayuda a la cicatrización de las lesiones articulares o totales; cicatrizaron mejor las rodillas a las cuales se les aplicó glocosamina al compararlas con aquellas que no recibieron el fármaco.
Resultados del análisis microscópico
Conejos tratados con glucosamina
Se encontró una completa cicatrización del defecto con tejido tipo fibrocartílago maduro, organizado, sin vasos sanguíneos, sin presencia de células inflamatorias o macrófagos (monocitos, linfocitos).
Este tejido neoformado se observó en estrecha relación con el hueso subcondral y el cartílago vecino; en un caso se apreció cartílago hiliano reparando el defecto en forma parcial y fibrocartílago en el área restante.
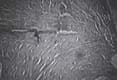
Figura 4. el cartílago sano al cual no se le causó injuria se hipertrofió, la línea de marea se tornó más clara o evidente, lo cual hace pensar en la presencia de un estímulo anabólico al cartílago.
 |
 |
| Fig 4a. Con el examen histológico a 10 aumentos se observa curación total, apreciándose hueso subcondral,cartílago hialino y fibrocartílago muy organizado. | Fig. 4b. Con gran aumento se observa cartílago hialino neoformado. |
Conejos tratados sin glucosamina
Se evidenció una cicatrización parcial del defecto, el tejido que lo reparaba en forma parcial era tejido de granulación inmaduro, siempre parcial era tejido de granulación inmaduro, siempre con u a notoria separación del hueso subcondral, desprendible, con neovasculatura, células inflamatorias tipo monocitos y linfocitos, el fibrocartílago no poseía un orden o disposición.
Figura 5. El cartílago hiliano cercano a la lesión, no se hipertrofió y no se evidencio la línea de marea, lo cual evidencia una ausencia de metabolismo o estímulo al tejido.
 |
 |
| Fig 5a. Sin glucosamina a 10 aumentos se aprecia tejido inflamatorio muy separado del hueso subcondra. | Fig. 5b. Con gran aumento se observa tejido inflamatorio con vasos, polimorfonucleares, linfocitos, fibroblastos, etc. |
El porcentaje de cicatrización dado por el análisis microscópico fue:
| Con glucosamina: Sin glucosamina: |
10/10 = 100% de cicatrización. |
Los resultados expresados en tablas de contingencia fueron:
|
CON |
SIN |
||
| CICATRIZACIÓN NO CICATRIZACIÓN |
10 |
0 |
10 |
Se aplicó también el test de Fisher por el bajo tamaño de la muestra y celdas con bajo número.
Resultado con el test de Fisher: P = 0.0001
Este resultado le da validez estadística lo cual indica que la glucosamina sí favorece la cicatrización de las lesiones articulares totales.
Conclusiones
El uso intraarticular de la glucosamina favorece la cicatrización del cartílago articular.
La glucosamina intraarticular promueve la diferenciación del tejido de granulación hacia fibrocartílago y ocasionalmente cartílago hialino bien diferenciado y maduro.
La glucosamina intraarticular posee actividad anabólica sobre el cartílago articular, lo engrosa o hipertrofia y hace ver fácilmente la línea de marea, lo cual indica actividad metabólica.
La glucosamina promueve un tejido de cicatrización maduro, fibrocartílago, con una unión estrecha entre este y el hueso subcondral.
Por todo lo anterior, se puede recomendar el uso intraarticular de la glucosamina en lesiones traumáticas o degenerativas del cartílago articular.
Bibliografía
- Ambrosio and col. Sulfato de glucosamina: Investigación clínica controlada en artrosis. Pharmaceutica. Vol. 2 No P 8. 1981. Págs. 504-508.
- Aston Jaine y col. Repair of articular surfaces by allografts of articullar and growth plate cartilage. Journal bone and joint surgery. Vol 68B. N 1. January 1986.
- Andersson y col. The influence of basal cartilage calcification on dynamic juxta-articular strees transmission. Clinical orthopaedics and related research. No 286. January 1993.
- Bagi and col. Ultraescturture, tartrate-resistant acid phosphatase activity and calcitonin responsivenes of osteoclasts at sites of demineralized bone matrix inplant induced osteogenesis. Clinical orthopaedics and related research. No 269 August 1991.
- Bentley George. Articular cartilage changes in condromalacia patellae. Journal bone and joint surgery. Vol. 67B. No 5 . November 1985.
- Bollough and col. The significance of the fine structure of articular cartilage. Journal bone and joint surgery. Vol. 50B. No 4. November 1968.
- Calandruccio and col. Proliferatión, regeneratión, and repair of cartilage resurfacing experimental defects in the rabbit knee. Journal bone and joint surgery. Vol. 44A. No 3 1962.
- De Palma. Process of repair of articular cartilage demostrated by histology and ultra-allografy with tritiated thymidine. Clinical orthopaedics and related research No 48. Sep. 1966.
- Drovani and col. Therapeutic activity of oral glucosamine sulfatein osteoartrosis: a placebo controlled double blind investigation. Clinical terapeutics. Vol. 3 No 4. 180.
- Furukama and col. Biomechanical studies on repair cartilage resurfacing experimental defects in the rebbit knee. Journal bone and joint surgery. Vol. 62A No 1. January 1980.
- Gebhardt and col. The course basic in orthopaedics. The harvard combined orthopaedics residency program faculty. 1983.
- Gold Edward and col. Effect os salicylate on the surgical inducement of joint degeneration in rabbits knees. Journal bone and joint surgery. Vol. 58A. No 7 Oct 1976.
- Hans Muller. Sulfato de glucosamina comparado con el ibuprofeno en osteoartritis de la rodilla. Ostheartritis and cartilage. 1994.
- Hummiaga and col. Pericondral grafting for cartilage lesions of the knee. Journal bone and joint surgery. Vol. 72B. No 6. November 1990.
- Hulth Anders. Does osteoarthosis on growth of the mineralized layer of cartilage? Clinical orthopaedics and related research. No 287. 1993.
- Iwata and col. Pharmacologic and clinical aspects of intra-articular inyection of hialuronate. Clinical orthopaedics and related research. No 289. 1993.
- Kato and col. Effect of vanadate on cartilage matrix proteoglycan synthesis in rabbit costal chondrocyte cultures. Journal of cell biology. Vol. 104. 1987.
- Maroudas and col. The permeability of articular cartilage. Journal bone and joint surgery. Vol. 50B. No 1 February 1968.
- Matsusue and col. Case reports. Artroscopic multiple ostheocondral transplantation to the condral defect in the knee associated with anterior cruciate ligament disruption. Arthroscopy. The journal of arthoscopic and related surgery. Vol. 9 . N 3 June 1990.
- Mc Arthur and col. Articular cartilage fibrillation and permeability to light green sy die. Journal bone and joint surgery. Vol 74B. No 5. September 1992.
- Micthell Nelson. The clones of ostearthitic cartilage. Journal bone and joint surgery. Vol 74B. No 1. January 1992.
- Moran and col. Biological resurfacing of full thickness defects in patellar articular cartilage of the rabbit. Journal bone and joint surgery. Vol 74 B. No 5. Sep. 1992.
- Ochoa y col. Efectos del ácido hialorónico en la cicatrización de las lesiones del cartílago articular en la rodilla del conejo. Revista colombiana de ortopedia y traumatologia. Vol. 9 No 3 octubre 1995.
- Owen y col. Fundamentos científicos de ortopedia y traumatología. Editorila Salvat. 1984.
- O driscol and col. The induction of noecondrogenesis in free intra-articular periostal autografts under the influence of continuous passive motio. Journal bone and joint surgery. Vol. 66A No 8 Octuber 1984.
- Reichelta Foster K. Efficacy and safety on intre muscular glucosamine sulfate in osteoarthritis of the knee. University clinic of orthopaedics of freiburg Fed. Rep. of germany .Arzneimittelforschung. January 44. 1994.
- Sakano and col. Collagen and alkaline phosphatase gene expresion during bone morphogenetic protein (bmp) induced cartilage and bone differentiation. Clinical Orthopaedics and related research. No 292 1993.
- Salter and col. The biological effect continuous passive motion on the healing of full thickness defects in articular cartilage. Journal bone and joint surgery. Vol 62 A No 8 December 1980.
- Salter and col. Clinical application of basic research on continuous passive motion for disorders and injuries of sinovial joints: A preliminary report of a feansibility study. Jouranal of orthopaedics research. Vol 1 No 3 1984.
- Salter and col. Healing of intra-articular fractures witn continuous passive motion. Instruccional course.
- Setnikar and col. Pharmacikinetics of glucosamine in man. Arzneimittelforschung. Oct 43 1993.
- Simon. Orthopaedics basic science. American academy of orthopaedics surgerons. 1994.
- Taisuke and col. Experimentally produced fractures of articular cartilage and bone. Journal bone and joint surgery. Vol. 74B No 3 1992.
- Takahashi and col. Autogenos calls osseous grafts for the repair of osteochondral defects. Journal bone and joint surgery. Vol. 77B No 2 March 1995.
- Teshima and col. Structure of the most superficial layer of articular cartilage. Journal bone and joint surgery. Vol. 77B. No 3 .1995.
- Thompson and col. Current concept review. Aticular cartilage matrix metabolis. Journal bone and joint surgery. Vol. 63A. No 2. 1981.
- Tsai and col. Estradiol induced knee osteoarthosis in ovariectomized rabbits. Clinical orthopaedics and related research. No 291. 1993.
- Todd and col. An experimental model of femoral condylar defects leading to osteoarthrosis. Journal of orthopaedics trauma. Vol. 7 No. 5. 1993.
- Viartril.Sulfato de glucosamina. Monografía. 1996.
- Warkitani and col. Repair of rabbits articular surfaces with allografts condrocytes embedded in collagen gel. The british editorial society of bone and joint surgery. Vol. 71B, No. 1 1989.
- Wes and col. Anglogenesis induced by degradation products of hyaluronic acid. Science. Vol. 228. 1986
