Si se desea mantener el equilibrio de energía es necesario aportar el gasto energético. Existen dos métodos básicos para estimar las necesidades calóricas.
Uno es el empleo de la ecuación de Harris-Benedict (o cualquier otra ecuación disponible), el otro es el análisis de los gases aspirados (ver la sección de calorimetría indirecta).
La ecuación de Harris-Benedict se deriva de un análisis de la población y toma en cuenta la edad del paciente, el sexo, la talla y el peso. El número calculado es el gasto energético basal (BEE) el cual es la energía gastada durante el reposo en un estado ausente de estrés luego de una noche de ayuno.
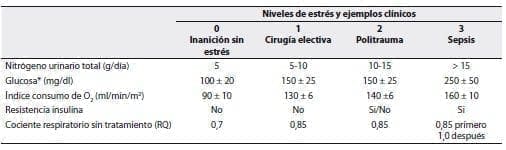
En presencia de estrés metabólico (tabla 9) durante el cual las demandas energéticas se encuentran incrementadas el BEE debe ser multiplicado por un factor de estrés con el fin de conseguir una estimación adecuada de necesidades energéticas (tabla 10).
Las ecuaciones son:
Hombres: BEE = 66 + (13,7 x peso)
+ (5,0 x talla) – (6,8 x edad)
Mujeres: BEE = 655 + (9,6 x peso)
+ (1,7 x talla) – (4,7 x edad)
Peso = Peso en kg.
Talla = Talla en cm.
Edad = Edad en años.
Tabla 9. Clasificación del estrés por categorías.

*En ausencia de diabetes, pancreatitis o terapia con esteroides. Adaptado de Cerra FB. A Pocket Manual of Surgical Nutrition. CV Mosby Co., St. Louis, 1984 p. 43.
Tabla 10. Guía para la determinación de los requerimientos nutricionales con base en el nivel de estrés metabólico.

BEE = Requerimiento energético básico; CNP = Calorías no proteicas; N = Nitrógeno; AA = Aminoácidos; CHO = Carbohidratos.
Adaptado de Cerra FB. A Pocket Manual of Surgical Nutrition. CV Mosby Co., St. Louis, 1984. p. 60.
El BEE es fácil de utilizar, no requiere equipos Técnicos sofisticados y permite que los cálculos se realicen de forma rápida y sin mucho costo.
Sin embargo, no es preciso en presencia de estrés metabólico. El REE es bastante exacto en la mayoría de las situaciones clínicas.
Mide el consumo de oxígeno, el cual puede ser utilizado para determinar el grado de hipermetabolismo y para medir el RQ de tal manera que pueda monitorizarse la combustión y que se pueda evitar la administración de un exceso de calorías y de glucosa.
Esta medición, requiere tecnología avanzada y enorme trabajo, es costosa y no puede utilizarse fácilmente en diversas situaciones clínicas tales como cuando se emplean concentraciones de oxígeno inspirado por encima de cincuenta por ciento en pacientes intubados o cuando la fracción inspiratoria de oxígeno es mayor al 20% en pacientes no intubados.(1,3,7)
En ambos casos los valores son estimativos del gasto energético y permiten un comienzo racional del aporte nutricional. Se deben monitorizar las necesidades con base en la respuesta y los resultados con el fin de confeccionar el régimen adecuado para las necesidades particulares de los pacientes.
Necesidades de glucosa
En los estados de inanición, las calorías no proteicas pueden ser aportadas como glucosa sola o como alguna combinación de glucosa y grasa exógena.
El primer caso se deben aportar lípidos únicamente en las cantidades suficientes para prevenir la deficiencia de ácidos grasos esenciales. En el último caso las grasas se aportan como fuente calórica junto con la glucosa.
Si se aporta glucosa en exceso con respecto a la demanda o si se da un total de calorías en exceso con respecto a la demanda ocurre lipogénesis, el RQ excede 1,0, la ventilación minuto aumenta, se presenta esteatosis hepática y se incrementa la excreción de catecolamina de manera importante.
Existe una relación lineal directa entre la carga de glucosa y la producción de CO2.
Mediante estudios con isótopos la máxima carga de glucosa utilizable parece ser 5 mg/kg/min. En general, un aporte no proteico de 20 a 25 kcal/kg/día constituye un cálculo razonable. La relación de calorías no proteicas por cada gramo de nitrógeno administrado es aproximadamente de 150:1.
En la diabetes se puede sustituir calorías de la glucosa por grasa con una reducción resultante en la intolerancia de la glucosa.(1)
Fracción de gasto energético
En estados de estrés el BEE aumenta y la oxidación total de glucosa también se incrementa pero la fracción de gasto energético total derivado de la glucosa disminuye.
Incluso aunque la producción de glucosa esté incrementada y la captación periférica sea normal la entrada de glucosa al ciclo de Krebs se encuentra reducida y esta es reciclada como lactato y piruvato.
Además, la glucosa exógena no reduce de manera muy eficiente la tasa de gluconeogénesis.
Por esta razón la carga de glucosa debe reducirse y completar la diferencia en calorías mediante lípidos.(1,7)
Requerimientos de grasa
Las preparaciones de lípidos intravenosos actualmente disponibles en los Estados Unidos son emulsiones de triglicéridos y ácidos grasos esenciales.
Se utilizan en la nutrición y en el apoyo metabólico para prevenir o tratar deficiencias de ácidos grasos esenciales.
En los estados de inanición es necesario dar una cierta cantidad de ácidos grasos esenciales para prevenir la deficiencia de ácidos grasos esenciales.
Estos requerimientos también son necesarios como consecuencia de la inhibición de la lipólisis debido a la respuesta insulínica a las elevadas infusiones de glucosa.
En situaciones de estrés se han observado cambios plasmáticos con deficiencia de ácidos grasos esenciales (disminución del ácido araquidónico y aumento del ácido oleico), presentes desde el comienzo del estrés, probablemente como reflejo de cambios en el medio hormonal.
Las emulsiones exógenas de grasa son efectivas para combatir este problema y también son efectivas como fuente calórica. También se ha demostrado que tienen un efecto ahorrador de proteínas equivalente al de la glucosa.
Por lo tanto, los lípidos se pueden utilizar para suplir hasta un 30% de los requerimientos calóricos.
Sin embargo, debido a los efectos inmunosupresores de las dosis elevadas de ácidos grasos poliinsaturados es mejor limitar las emulsiones intravenosas de lípidos a menos de 1 g/kg/día (tabla 10).(1,7)
Requerimientos proteicos
Con el comienzo de la inanición la glucosa se convierte en el principal combustible para la producción de energía. Cuando se depletan rápidamente los depósitos de glucógeno, los aminoácidos se convierten en la fuente primaria de carbono para la producción hepática y renal de glucosa.
La fuente de aminoácidos es el depósito móvil de aminoácidos localizado en el músculo en el tejido conectivo y en las vísceras.
Después de varios días ocurre un proceso de adaptación cuyo principio básico es ahorrar los depósitos de aminoácidos sustituyendo la glucosa por otras fuentes de carbono destinadas por lo cual se disminuye la pérdida de masa corporal magra con una reducción en la excreción urinaria de nitrógeno.
Las fuentes de este carbono residen principalmente en la grasa movilizada y en la producción de cuerpos cetónicos por el hígado. Además se reduce la oxidación de la glucosa y esta es reciclada como lactato mientras el glicerol se transforma en una fuente disponible para la gluconeogénesis.
Durante la inanición tanto la glucosa como la grasa exógena dan lugar a una reducción en la movilización de aminoácidos. Si se suplementan aminoácidos junto con vitaminas, electrolitos, minerales y elementos traza es posible conseguir un balance de nitrógeno positivo y un balance calórico positivo especialmente si estas medidas se asocian con un programa de ejercicio.
Con la activación de los sistemas mediadores la síntesis de proteína corporal:
Disminuye y la síntesis de proteína hepática aumenta como consecuencia de la producción de reactantes de fase aguda. El catabolismo aumenta con un incremento en la oxidación de aminoácidos como fuente de energía y en la movilización de aminoácidos a partir de la periferia.
La tasa de síntesis de proteína corporal total puede aumentarse mediante la administración de aminoácidos exógenos.
Se puede alcanzar con la tasa metabólica fenómeno reflejado al alcanzar un equilibrio en el balance de nitrógeno (2 a 4 g de balance de nitrógeno positivo).
La reducción de la tasa absoluta de catabolismo mediante la administración de aminoácidos exógenos parece ser relativamente ineficaz. El incremento en la carga de aminoácidos más allá de este punto de equilibrio parece incrementar tanto la tasa de anabolismo como de catabolismo sin un cambio significativo en el equilibrio.
La carga de aminoácidos necesaria para suplir las demandas de la producción de energía y de la síntesis de proteínas y para conseguir un equilibrio de nitrógeno aumenta con la cantidad de estrés metabólico presente (tabla 10).(1,7)
Requerimientos de líquidos
Los requerimientos normales de líquidos para los adultos son de 1.500 a 2.500 ml/día. En promedio los pacientes requieren 30 ml/kg de peso corporal. El requerimiento de líquidos de un paciente individual puede ser mayor en presencia de pérdidas extrarrenales de líquidos como las que se presentan en la fiebre, la sudoración excesiva, en las fístulas y en el drenaje de heridas y en el vómito y la diarrea. En estos casos se deben aportar líquidos adicionales bien sea por vía oral, a través de las sondas de nutrición y por infusión intravenosa (tabla 11).(3)
Tabla 11. Requerimientos diarios de líquidos básales para adultos.

Tomado de Randall HT. Fluid, electrolyte, and fluid base balance.
Surg Clin North A 1976; 56: 1019-1058.
Conclusión
Una prueba ideal para la valoración del estado Nutricional debería ser altamente sensible y específica, no debería ser afectada por factores no relacionados con la nutrición y debería correlacionarse adecuadamente con la respuesta a la repleción nutricional.
Dada la carencia de sensibilidad, especificidad e independencia de la mayoría de los parámetros descritos en este artículo, el diseño de un enfoque clínicamente útil con una adecuada relación costo-beneficio para la valoración del estado nutricional constituye todo un desafío.
Definitivamente, se requieren mejores índices del estado nutricional.
Referencias bibliográficas
- 1. Shronts EP, Cerra FB. The rational use of appliec nutrition in the surgical setting. En Paparella M, et al (Eds.). Otolaryngology. WB Saunders, 1990. p. 657-666.
- 2. Strausburg KT. Nutrition/metabolic assessment. En Strausburg KT, Cerra FB, Lehmann S, Shronts EP (Eds.). Handbook for Nutrition Support. Harvey Whitney Publishers, 1992.
- 3. Hopkins B. Assessment of nutritional status. En Gottschlich M, Matarese L, Shronts EP (Eds.). Nutrition Support Dietetics Core Curriculum, 2nd edition. ASPEN 1993.
- 4. Shronts EP. Nutritional assessment in hepatic failure. Nutr Clin Prac. 1988; 3(3): 113-119.
- 5. Ireton-Jones CS, Hasse JM. Comprehensive nutritional assessment: The dietitian’s contribution to the team effort. Nutrition. 1992; 8(2): 75-81.
- 6. Teasley-Strausburg KM, Anderson JD. Assessment, prevalence, and clinical significance of malnutrition. En Dipiro JT, Talbert RL, et al (Eds.). Pharmacotherapy: A Pathophysiologic approach. 2nd ed., Appleton & Lange, Norwalk, CN 1993.
- 7. Shronts EP, Lacy J. Metabolic support. En Gottschlich M, Matarese L, Shronts EP (Eds.). Nutrition Support Dietetics Core Curriculum, 2nd edition ASPEN, 1993.
- 8. Daley BJ, Bistrian BR. Nutritional assessment. En: Zaloga GP (ed.): Nutrition in Critical Care. CV Mosby Publishers, 1994.
- 9. ADA’s definitions for nutrition screening and nutrition assessment. J Am Diet Assoc. 1994; 94(8): 838-39.