Resumen
La trombosis de las venas pulmonares (TVP) es una rara, pero seria complicación del trasplante pulmonar que en muchas ocasiones puede llevar al paciente a la muerte. La aparición de hipoxemia, edema pulmonar e inestabilidad hemodinámica en las horas siguientes al trasplante, unido a la aparición de infiltrados en las Rx de tórax, pueden orientar el diagnóstico. Presentamos tres casos de TVP de evolución fatal (1.5%), sobre un total de 170 trasplantes de pulmón realizados en el Hospital Vall d’Hebrón hasta noviembre de 2000. (Lea también: Aerosolterapia en pacientes con ventilación mecánica)
Palabras Claves: trombosis de las venas pulmonares, transplante pulmonar.
Reyes L, Monforte V, Bravo C, Sole J, Canela M, Román A, Morell F. Trombosis fatal de las venas pulmonares como complicación précoz post trasplante de pulmón.
Descripción de tres casos clínicos. Rev Colomb Neumol 2002;14:39-42.
Leonardo José Reyes, MD*, Victor Monforte, MD*, Carlos Bravo, MD*, Joan Sole, MD*,
Mercedes Canela, MD*, Antonio Román, MD*, Ferran Morell, MD*.
* Servicios de Neumología y Cirugía de Tórax. Hospital Vall d´Hebron, Barcelona, España
Abstract
Pulmonary venous thrombosis (PVT), after lung transplantation is a rare and serious complication, in most occasions the patient dies when PVT occurs. Hypoxemia, severe pulmonary edema and hemodynamic instability in the early postoperative period were comun, with changes in chest-X-ray.
Of 170 lung transplants performed at the Vall d’Hebrón Hospital from August 1990 to November 2000, 3 (1.5%) cases of PVT were diagnosed, in spite of early clinical suspiction and respiratory and hemodinamic support, all patients died.
Key words: Pulmonary venous thrombosis, lung transplant.
Reyes L, Monforte V, Bravo C, Sole J, Canela M, Román A, Morell F. Early and lethal pulmonary vein thrombosis after lung transplantation: Three case reports. Rev Colomb Neumol 2002;14:39-42.
Introducción
La trombosis de las venas pulmonares (TVP), es una complicación rara que puede aparecer tanto en el trasplante cardíaco como en el pulmonar. Cuando esto ocurre, las consecuencias son casi siempre fatales. La aparición de hipoxemia, edema pulmonar severo e inestabilidad hemodinámica son casi siempre los síntomas de presentación de esta entidad.
En 1992 Schmid y colaboradores1 describieron el primer caso clínico documentado de trombosis en la anatomosis de la aurícula izquierda con las venas pulmonares en un paciente quien pocas horas después de un trasplante unipulmonar presentó los síntomas ya descritos.
Posteriormente, se ha demostrado que este tipo de trombosis puede aparecer tanto en las fases precoces, como en períodos más tardíos del trasplante, evolucionando casi siempre como una complicación severa.
Han sido publicados varios casos clínicos de TVP2-3, cuyos síntomas de presentación fueron inicialmente confundidos con entidades clínicas como el rechazo hiperagudo, edema pulmonar de reperfusión, falla cardíaca o infección, la evolución de la mayoría de ellos fue hacia la insuficiencia respiratoria, el “pulmón blanco” el fallo multiorgánico y la muerte4.
La ecografía doppler es el mejor método diagnóstico para diagnosticar rápidamente esta complicación, en especial en la forma de ecografía transesofágica(ETE), al poder visualizar la línea de sutura de las venas pulmonares con la aurícula izquierda5,6, y de esta forma intentar un tratamiento adecuado7.
Se presentan tres casos clínicos de TVP en fase precoz post operatoria, de la serie de pacientes trasplantados de pulmón en nuestro centro, desde agosto de 1991 hasta noviembre de 2000.
Caso 1: trombosis fatal en las venas pulmonares
Paciente de 57 años con fibrosis pulmonar idiopática de 2 años de evolución, en insuficiencia respiratoria y O2 domiciliario, CVF: 1360(39%), VEF1: 1230(46%), fracción de eyección del ventrículo derecho FEVD: 27%, fracción de eyección del ventrículo izquierdo FEVI: 65%.
Se realiza trasplante unipulmonar izquierdo en septiembre de 1994 que cursa con un tiempo de isquemia de 6 horas y tiempo total del procedimiento quirúrgico de 6 horas 45 min. El pulmón donante era de tamaño algo superior al receptor, pero no hubo necesidad de resección quirúrgica del implante.
La cirugía transcurrió con estabilidad hemodinámica y respiratoria. Ingresa a la UCI con apoyo inotrópico con Noradrenalina (NAD) y Dopamina (Dopa), con presiones pulmonares normales, presión capilar pulmonar (PCP): 12 mm Hg e índice cardíaco (IC) de 3.1.
En pocas horas cursa con desestabilización hemodinámica con presión arterial pulmonar (PAP) media de 80 mmHg, PCP: 14, evidencia de edema de pulmón por salida de material serohemático abundante por tubo orotraqueal (TOT) y estertores difusos.
En la Rx de tórax se observan infiltrados alveolares bilaterales. Se practica fibroboncoscopia (FBC) que demuestra integridad de las suturas y abundantes secreciones en pulmón izquierdo. El ecocardiograma transtorácico (ETT) demuestra un buen flujo en arterias pulmonares y aceptable contractilidad cardíaca, no hay derrame pericárdico.
En el transcurso de 24 horas presenta severa insuficiencia respiratoria, bradicardia y asistolia a pesar de múltiples medidas de reanimación. La autopsia demuestra trombosis de la sutura de la aurícula izquierda y las venas pulmonares izquierdas, afectación pulmonar bilateral severa por neumonía con daño alveolar difuso.
Caso 2: trombosis fatal en venas pulmonares
Paciente de 58 años con antecedentes de Artritis Reumatoidea, bronquiectasias conocidas desde los 21 años de edad y colonización por Pseudomona Aeuruginosa. CVF: 1140(37%), FEV1: 520(23%), FEVI: 70%. Ingresa en marzo de 1999 para trasplante bipulmonar, con tiempo de isquemia de pulmón derecho: 3 horas y pulmón izquierdo: 6 horas, 10 min.
Presenta estabilidad hemodinámica durante el procedimiento. Ingresa a UCI con TOT y evidencia de edema pulmonar por salida de abundante material serohemático, la Rx de tórax demuestra infiltrados bilaterales y atelectasia pulmonar izquierda. PCP: 17 cm H2O, PAD: 14, RVS: 1201, RVP: 311, IRVP: 499, e IC: 2.4.
En el transcurso de 24 horas es necesario aumentar apoyo inotrópico y ventilatorio con FIO2 100% y aumento de PEEP hasta 10 mmHg. Una nueva Rx de tórax demuestra persistencia de la opacidad en pulmón izquierdo que respeta la periferia (figura 1).
Al día siguiente se practica FBC que demuestra isquemia moderada de la sutura izquierda y sangrado difuso moderado bilateral. Una TAC de tórax: hemotórax importante izquierdo y condensación parenquimatosa (figura 2).
El ETT demuestra función global conservada sin derrame pericárdico y sin evidencia de trombosis. El paciente cursa posteriormente con necrosis de la cara inferior del corazón, acidosis metabólica y asistolia. La autopsia de la paciente demuestra trombosis de la sutura de la arteria pulmonar izquierda, trombosis de las venas pulmonares e infarto hemorrágico masivo del pulmón izquierdo (figura 3).
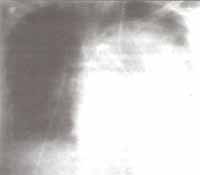
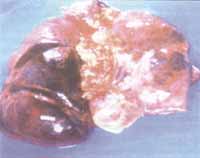
Figura No 1. Rx de tórax, caso clínico No2 Figura No 2. Tac de Tórax, caso clínico No 2
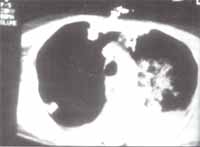
Figura No 3. Autopsia caso clínico No 2: trombosis masiva de venas pulmonares con infarto pulmonar hemorrágico.
Caso 3: trombosis fatal en venas pulmonares
Paciente de 39 años, con diagnóstico de fibrosis pulmonar idiopática de 6 años de evolución en insuficiencia respiratoria crónica con O2, CVF: 1040(29%), VEF1: 1000(36%), FEVI: 67%, FEVD: 42%. En agosto de 1999 se practica trasplante unipulmonar izquierdo con tiempo quirúrgico de 7 horas y tiempo de isquemia de 6 horas 30 min.
Cursó con estabilidad hemodinámica y sin deterioro de la función respiratoria. Ingresa en UCI con evidencia de edema de pulmón por salida por TOT de material sero sanguinolento abundante, oliguria y acidosis metabólica. Rx de tórax demuestra derrame pleural bilateral, patrón alveolar y redistribución vascular de predominio en pulmón izquierdo.
A las 24 horas cursa hacia el shock con componente cardiogénico y posible edema de reperfusión severo, se intenta practicar ETT que no permite visualización de estructuras por obesidad e hiperaireación. En las siguientes 36 horas la paciente evoluciona hacia el fallo multisitémico, bradicardia y asistolia. La autopsia demuestra trombosis de las venas pulmonares izquierdas e infarto hemorrágico del pulmón izquierdo.
Discusión
En esta corta serie se observa que la trombosis de las venas pulmonares (TVP) después del trasplante pulmonar es una complicación seria que en todos nuestros pacientes llevó a la muerte.
Estos resultados concuerdan tanto con la evolución de parte de los pocos casos publicados, como con los resultados de los estudios prospectivos de alteraciones vasculares y trombosis que pueden aparecer en el post operatorio del trasplante11-13.
La trombosis en la línea de sutura auricular con las venas pulmonares, puede ser causada tanto por la exposición endovascular de parte del tejido muscular de la pared auricular, como por la disminución en el diámetro de las venas pulmonares al desacelerar el flujo sanguíneo, al activar la cascada de la coagulación, favoreciendo la aparición de trombos5.
Pinsky y cols9 demostraron experimentalmente que los pulmones que han permanecido en líquido de preservación durante muchas horas presentan vasoconstricción, cambios en la estructura vascular, secuestro de neutrófilos, edema y por último trombosis endovascular.
Por último, la disparidad de tamaño donante-receptor14, puede llevar a compresión de parte del tejido pulmonar, distorsión de los vasos sanguíneos, con la consiguiente lentificación del flujo y la posible formación de trombos.
Métodos diagnósticos
Son varios los métodos descritos que pueden ayudar en el diagnóstico precoz de esta complicación. La ecografía transtorácica (ETT) no es el mejor método diagnóstico, ya que las imágenes obtenidas tanto de la aurícula izquierda como de las venas pulmonares son de mala calidad y difíciles de interpretar. Sin embargo, el ecocardiograma transesofágico (ETE) parece ser un buen método diagnóstico.
Ha sido utilizado de forma continua durante el procedimiento quirúrgico5,11 lo cual permite observar la función cardíaca, e igualmente visualizar las estructuras vasculares en tiempo real. Teóricamente este hecho, permite la corrección de una obstrucción vascular en la misma sala de operaciones.
Igualmente se ha utilizado como exploración rutinaria en el post operatorio inmediato y tardío7,12. Sin embargo, no se ha demostrado el ETE continuo intraoperatorio permita prevenir totalmente la TVP, por lo cual no se considera como obligatoria esta práctica en todos los trasplantes pulmonares.
En los últimos años, los avances tanto en angio tomografía del tórax, como en angio resonancia magnética15,16, no solo permiten visualizar los trombos, sino reconstruir de forma virtual las alteraciones morfológicas de los vasos, permitiendo tomar decisiones sobre el método de tratamiento a seguir, en especial en las estenosis de los vasos pulmonares. No obstante, estos métodos diagnósticos tienen el inconveniente del traslado de un paciente crítico al lugar donde se realizan las exploraciones.
Sea cual sea, el método diagnóstico a realizar, hay que tener en cuenta que la obstrucción completa de las venas pulmonares, lleva a un infarto hemorrágico lobar en 4 a 6 horas4), siendo esencial un diagnóstico temprano, para intentar salvar la mayor cantidad de tejido pulmonar.
Tipos de tratamiento
Son varios los tipos de tratamiento realizados; la aplicación de trombolíticos ya sea de forma sistémica1 como directamente en los vasos pulmonares4, la trombectomía, la correción quirúrgica, incluyendo lobectomías de territorios pulmonares ya infartados y aún el retrasplante7, con resultados bastante dispares.
Por último, Nahar et al17 publicaron recientemente, dos casos clínicos de pacientes a quienes se les diagnosticó TVP en el post operatorio precoz, quienes cursaron además con sangrado intenso de base, por lo cual fue imposible aplicar tratamiento fibrinolítico, realizando un tratamiento conservador, y observaron la disolución espontánea de los trombos sin secuelas clínicas.
Esto demuestra, que el tamaño del trombo (en estos casos menores de 1 cm) y la velocidad del flujo en la región anastomótica, valorada por ETE, pueden ser una buena guía para decidir el manejo clínico a realizar.
Conclusión
En conclusión, la TVP es una complicación muy severa del trasplante pulmonar, que en nuestros casos llevó a la muerte a los pacientes. Es necesario tener en mente esta complicación, para no confundirla con otras situaciones clínicas ya descritas y realizar un procedimiento diagnóstico rápido que permita un tratamiento precoz y adecuado. La práctica de ETE, tanto en el intra como en el post operatorio, parece ser lo más adecuado.
Bibliografía
1. Schmid C, Gulba DC; Heublein B et al. Systemic recombinant tissue plasminogen activator lysis for left atrial thrombus formation after single-lung retransplantation. Ann Thorac Surg 1992; 5353(2): 338-40.
2. Egan TM, Westerman JH, Lambert CJ et al. Isolated lung transplantation for end-stage lung disease: a viable therapy. Ann Thorac Surg 1992; 53(4): 590-5.
3. Rosendale BE, Keenan RJ, Duncan SR et al. Donor cerebral emboli as a cause of acute graft dysfunction in lung transplantation. J Heart Lung Transplant 1992; 11:72-6.
4. Sarsam MA, Yonan NA, Beton D et al. Early pulmonary vein thrombosis after single lung transplantation. J Heart Lung Transplant 1993;12:17-9.
5. Hausmann D, Daniel WG, Mugge A et al. Imaging of pulmonary artery and vein anastomoses by transesophageal echocardiography after lung transplantation. Circulation 1992; 86:II251-8.
6. Pham SM, Armitage JM, Katz WE, Griffith BP. Left atrial thrombus after lung transplantation. Ann Thorac Surgery, 1995; 59(2): 513-5.
7. Shah AS, Michler RE, Downey RJ et al. Management strategies for pulmonary vein thrombosis following single lung transplantation. J Card Surg 1995; 10(2): 169-78.
8. Gorcsan J 3rd, Edwards TD, Ziady GM et al. Transesophageal echocardiography to evaluate patients with severe pulmonary hypertension for lung transplantation. Ann Thorac Surg, 1995 59(3): 717-22.
9. Pinsky DJ. The vascular biology of heart and lung preservation for transplantation. Thromb Haemost 1995; 74(1): 58-65.
10. Stang MR, Hinderliter AL, Gott KK et al. Atrial anastomotic thrombus causes neurologic deficits in a lung transplant recipient. Transplantation 15 1996; 62(5): 693-5.
11. Leibowitz DW, Smith CR, Michler RE et al. Incidence of pulmonary vein complications after lung transplantation: a prospective transesophageal echocardiography study. J Am Coll Cardiol 1994; 24(3): 671-5.
12. Liguori C, Schulman LL, Weslow RG et al. Late pulmonary venous complications after lung transplantation. J Am Soc Echocardiogr 1997;10(7): 763-7.
13. Kroshus TJ, Kshettry VR, Hertz MI et al. Deep venous thrombosis and pulmonary embolism after lung transplantation. J Thorac Cardiovasc Surg 1995; 110(2): 540-4.
14. Reyes L, Roman A, Bravo C, Monforte V y Morell F. Evaluación y selección del pulmón para trasplante en: El donante de órganos y tejidos. Evaluación y manejo, segunda edición. Servei de obtenció d’organs i teixits per a trasplantament. Hospital de la Santa Creu i Sant Pau. En Prensa.
15. Selvidge SD, Gavant ML. Idiopathic pulmonary vein thrombosis: Detection by CT and MR imaging. Am J Roentgenol 1999 ; 172(6): 1639-41.
16. Shoenberg SO, Knopp MV, Grau A, Bischoff H, Bock M, Schlemmer HP, Hawighorst H, Lavb G, Kosmaoglon P, Von Kaick G. Radiologe 1998;38(7): 597-605.
17. Nahar T, Savoia MT, Liguori C et al. Spontaneous resolution of pulmonary venous thrombosis after lung transplantation. J Am Soc Echocardiogr, 1998; 11(2): 209-12.