Las posibles causas independientes que pueden contribuir a la disfunción ventricular izquierda (VI) en pacientes con enfermedad pulmonar son: enfermedades arteriales coronarias o valvulares, hipertensión sistémica, presencia de carboxihemoglobina, hipoxemia y acidosis sistémica, alteraciones marcadas de la presión intratorácica y disfunción del VD.
Si se tiene en cuenta la edad habitual, la historia prolongada de fumador importante y la vida habitualmente sedentaria de los pacientes que van a ser sometidos a cirugía torácica, no es sorprendente que sea la enfermedad arterial coronaria con mucho la causa más probable por sí sola de disfunción del VI. (Lea también: Papilomatosis del árbol traqueobronquial)
Introducción
La isquemia miocárdica que lleva al infarto puede producirse durante el período perioperatorio, aunque se producen picos de incidencia durante la operación y al tercer día después de la operación. El primer pico está producido por los cambios intraoperatorios de la hemodinámia y el segundo pico, por los episodios de hipoxia, administración no uniforme de medicación analgésica y retirada o alteración del tratamiento farmacológico.
Solamente existen dos predictores clínicos pre-operatorios probados de morbilidad cardíaca perioperatoria (definida como aparición de infarto de miocardio (IM), angina inestable, insuficiencia cardiaca congestiva (ICC), arritmias graves o muerte cardíaca durante los periodos intra o postoperatorios en el hospital); estos predictores son el IM reciente (< 6 meses) y una ICC concurrente.
Los predictores históricos clásicos de morbilidad intraoperatoria (cirugía de emergencia, operaciones prolongadas de más de 3 horas y cirugía torácica o abdominal superior) también parecen ser factores independientes de morbilidad perioperatoria, mientras que la elección del anestésico no lo es. Los predictores dinámicos intraoperatorios son la hipotensión y taquicardia intraoperatoria. La hipertensión sigue siendo un predictor controvertido.
Si existe historia de angina de pecho, o el ECG la sugiere, es necesario proceder a una evaluación más profunda de la función de la arteria coronaria (son signos de ello las ondas Q [infarto previo], el bloqueo de rama izquierda, la elevación del segmento ST [isquemia transmural], la depresión del segmento ST [isquemia subendocardica], la inversión de la onda T y las ondas U positivas [enfermedad de la arteria coronaria izquierda principal]).
Evaluación sobre la función de la arteria coronaria
El primer paso debería ser una prueba de esfuerzo no invasiva. En ese momento el ECG y la gammagrafía con talio parecen ser las mejores pruebas. Un estudio de prueba de esfuerzo proporciona información sobre el nivel funcional del paciente. Desgraciadamente, el impacto del ejercicio puede estar limitado por una escasa reserva ventilatoria, así como por una baja reserva cardiaca.
Si el ECG de esfuerzo es normal, podrá llevarse a cabo la cirugía; si el ECG de esfuerzo indica isquemia está indicado hacer una prueba de esfuerzo con talio. Si la prueba con talio es negativa, podrá realizarse la resección pulmonar; si resulta positiva para isquemia, deberá realizarse una angiografía coronaria.
Sin embargo, si existe una alta sospecha que el paciente tiene una angina de pecho significativa a pesar de pruebas de esfuerzo negativas, estará indicada la angiografía coronaria. Deberá pensarse siempre en la angiografía coronaria en pacientes con IM previos comprobados, especialmente si tienen angina en la actualidad. La ecocardiografía cada vez se usa más para estimar la función del VI.
Si existe una enfermedad coronaria significativa, el paciente requerirá de cirugía de bypass coronario antes o en el momento de la resección pulmonar. Para grados inferiores de enfermedad coronaria, la resección pulmonar de un carcinoma de pulmón debe realizarse después de ser iniciado un tratamiento médico adecuado a la insuficiencia coronaria.
Si el paciente requiriese un bypass coronario y fuese posible extirpar el cáncer con una resección pulmonar limitada, podrían llevarse a cabo ambas técnicas con la misma anestesia, aunque el bypass debe realizarse antes de la resección pulmonar. Después de la derivación si el paciente está estable, tiene una buena función miocárdica y no sangra, se puede realizar la resección pulmonar en cuña.
Pacientes que requieren injerto coronario
Para pacientes que requieren injerto coronario y tienen lesiones pulmonares que requieren segmentectomía, lobectomía o neumonectomía, es muy probable que la prolongada duración de las técnicas pulmonares aumente la mortalidad operatoria (y por tanto no deben realizarse), aunque se han publicado un pequeño número de intervenciones combinadas con éxito.
En casos que requieren grandes resecciones en pacientes gravemente enfermos, deberá realizarse antes un bypass coronario y se retrasará la resección pulmonar hasta que el paciente haya ganado peso y masa muscular (normalmente de 4-6 semanas).
El riesgo de la anestesia general para una operación no cardiaca en pacientes con bypass coronario previo, es similar al que existe sin una enfermedad arterial coronaria comprobada.
Aunque no es posible estimar los efectos reales de la resección pulmonar retardada en términos de diseminación tumoral en un paciente posiblemente inmunocomprometido (especialmente después de la anestesia general), parece razonable que en el último grupo (en aquellos que requieren injerto coronario y una resección pulmonar importante) el riesgo operatorio de las técnicas combinadas probablemente supere al riesgo de diseminación tumoral.
Cirugía para cáncer de pulmón cirugía curativa
Predicción mediante pruebas de función pulmonar de probabilidad de complicaciones e invalidez postoperatoria.
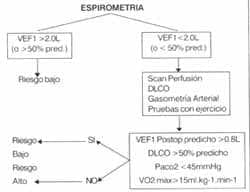
Cálculo de la estimación postoperatoria de la función pulmonar usando scan de perfusión
VEF1 POP = VEF1 PREOP x %Q del remanente pulmonar
-Ejemplo 1: Tumor en bronquio principal derecho que requiere neumonectomía.
EF1 Preop……………………3.0 L
Scan Perfusión…………… 60% Perfusión pulmón izquierdo
………………………………….40% Perfusión pulmón derecho
VEF1 Postop
Estimado = …………………. 60% de 3.0 L = 1.8 L
-Ejemplo 2: Tumor en lóbulo superior derecho que requiere lobectomía superior derecha.
VEF1 Preop. ………………..3.0 L
Scan Perfusión … …………60% Perfusión pulmón izquierdo
……………………….. …………40% Perfusión pulmón derecho
Total número de
Segmentos pulmón d. ……..9
Número de segmentos
a resecar …………………….. .3
Perdida de VEF1
estimada = …………………….3/9×40/100 x 3.0 L = 0.4 L
VEF1 Postop. = ……………… 2.6 L
La pérdida de función pulmonar asociada con resección pulmonar es directamente proporcional a la contribución funcional preoperatoria de ese lóbulo o pulmón5.
Para neumonectomía este puede ser fácilmente calculado por un Scan de perfusión cuantitativo.
El VEF 1 es la medida más simple y de mayor peso para predecir la posibilidad de riesgo de complicaciones en el postoperatorio.
Un VEF 1 postoperatorio estimado > 0.8 L es asociado con un aceptable resultado en la mayoría de los pacientes.
Los pacientes con enfermedad pulmonar intersticial coexistente requieren de mayores investigaciones, incluyendo el DLCO.
Pacientes con VEF 1 menores del 50% del predicho deben tener gases sanguíneos realizados preoperatoriamente, y si presenta PC02 >45mmHg es una contraindicación para neumonectomía.
Cirugía paliativa
Tumores que obstruyen la tráquea o bronquio central son comúnmente inoperables pero con indicación de medidas paliativas. Las curvas de flujo-volumen pueden identificar obstrucciones de la vía aérea superior (OVAS) tanto intratorácicas como extratorácicas y por tanto diferenciar entre una oclusión en la tráquea o bronquio principal.

Cirugía para bula pulmonar
Anormalidades de la función pulmonar incluyen:
1. Disminución del VEF 1 y de la relación VEF1/CVF debido a enfisema con pérdida del retroceso elástico.
2. Hiperinflación con un incremento mayor del VR y de la CRF en comparación con la CPT.
3. El intercambio de gas está usualmente alterado y manifestado mediante una Pao2 baja y una disminución de la DLCO.
Criterios para la resección quirúrgica de bula pulmonar:
1. Grandes bulas (> 1.0 L) calculadas por TAC para estimar el volumen de la bula. Ya que con menores volúmenes en la bula hay una pobre función total debido a un enfisema generalizado.
2. Preservar KCO (DL/VA).
3. Preservación relativa del VEF1 predicho.
Cirugía de reducción de volumen pulmonar
Se realiza en pacientes con enfisema difuso sin evidencia de grandes bulas. La bulectomía y la cirugía de reducción de volumen pulmonar (LVRS)
Tienen como objetivo la disminución del volumen del gas torácico. LVRS implica la identificación de áreas del pulmón que están más afectadas por enfisema para entonces resecarlas en forma bilateral, teniendo como objetivo una reducción del 30% del volumen pulmonar6.
Selección de pacientes
Las pruebas de función pulmonar juegan un papel importante en la selección de pacientes para LVRS. Criterios actuales incluyen:
1. VEF 1 <35% predicho.
2. Enfisema heterogéneo identificado con TAC y Scan de Perfusión de Tórax, idealmente con mayor compromiso de las zonas superiores, pero sin grandes bulas7.
3. VR y CRF > 220% predicho.
4. CPT > 125% predicho.
5. Paco2 <55mmHg.
6. Edad < 75 años.
Transplante pulmonar
1. Transplante combinado corazón-pulmón (HLT), indicado para condiciones pulmonares varias.
2. Transplante pulmonar único (SLT), indicado en pacientes con enfermedad pulmonar fibrosante.
3. Transplante pulmonar secuencial bilateral (BLT)
Selección de pacientes
| CONDICIÓN | CUANDO REFERIR A TRANSPLANTE |
OPERACIÓN |
|
Fibrosis pulmonar Fibrosante criptogénica Fibrosis cistica Enfisema Hipertensión pulmonar |
VC <60% predicho y que no responde a tratamientoinmunosupresivoVEF1 <30% predicho o pérdida acelerada de VEF1 del 30%VEF1 < 25% predichoPresión aurícula der. >10mmhg Índice cardíaco <3.0 l/min/m2 SVO2 <63% |
SLT/BLT HLT |
Bibliografía
- Smetana Gerald W. Preoperative pulmonary evaluation. The New England Journal of medicine 1999; 340:937-944.
- Benumof J, Alfery D. Anestesia en Cirugía torácica. Anestesia Miller Cuarta Edición 1998; 2:1623-1628.
- Melendez J, Fischer M. Preoperative pulmonary evaluation of the thoracic surgical patient. Chest surgery clinics of NA 1997; 7 Number 4.
- Corris P A. Pre-operative evaluation for thoracic surgery. Normal function lung test. Edition 2001:233-244
- Slinger Peter, Michael Johnston. Preoperative assessment for pulmonary resection. Anesthesiology clinics of NA 2001; Vol. 19 Number 3.
- National emphysema treatment trial research group. Patients a high risk of death after lung-volume-reduction-surgery. The New England Journal of medicine 2001; Vol. 345:1075-1083.
- Rogers R, Coxson H, Sciurba F. Preoperative severity of emphysema predictive of improvement after lung-volume-reduction-surgery. Chest 2000; Vol. 118 Number 5.