Tumor Carcinoide Bronquial, Evolución, Tratamiento y Pronóstico
Se sabe que la vía de diseminación de los carcinoides es a través de los linfáticos o a través de la vía hematógena, por lo mismo, tanto el tamaño, como el grado de diferenciación del primario pueden llegar a servir como factor pronóstico del desarrollo de metástasis posteriores (7).
El tratamiento de elección es la cirugía, mediante lobectomía con disección ganglionar, siempre que sea posible (3,14).
El trasplante hepático es una opción cuando la enfermedad tiene componente metastásico en dicho órgano (14).
Debido al componente invasivo y metastásico que diferencia cada uno de los tipos de carcinoide, su evolución, tratamiento y pronóstico son diferentes, por lo que serán revisados de manera independiente (1).
-Tumores carcinoides típicos:
El pronóstico es excelente dado su escaso comportamiento invasivo lo que hace que la escisión quirúrgica sea un tratamiento curativo en la mayor parte de los casos (1, 3, 14). En un estudio realizado por Okike N y cols de 203 pacientes solo 11 tenían metástasis a ganglios regionales (14,13,28). Se habla de una sobrevida cercana a el 71% a los cinco años (13,28) en unas series y de hasta el 90% en otras series (3,5). De igual forma se ha visto que aún con metástasis a distancia, las cuales pueden estar entre el 10 a 28% de los casos (3), los tumores carcinoides típicos pueden tener muchos años de supervivencia debido al crecimiento lento de la lesión, es por esta misma razón que las recidivas metastásicas pueden aparecer varios años después por lo que su seguimiento debe ser a largo plazo (incluso 20 años) (1,3). MJ Goddard y cols describieron el primer caso de metástasis a miocardio de un tumor carcinoide típico a los 8 años de la resección del tumor primario (29), las cuales son descritas en la literatura como inusuales, teniendo una incidencia entre el 1 – 7%, y son descritas a nivel de endocardio y enfermedad valvular, con un mayor compromiso de las cavidades derechas (14,29).
Los pacientes con este tipo de tumor tienen una baja incidencia de enfermedad metastásica, menor a un 15%, siendo las más frecuentes cuando estas se encuentran en los ganglios linfáticos mediastinales, el hígado, el hueso y la piel (5).
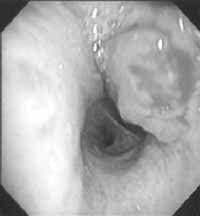
Dada las características benignas en el comportamiento de este tumor, los tratamientos conservadores pueden tener un adecuado control de la enfermedad, dentro de éstos se describen la segmentectomía, resección en manga y tratamiento locales como los realizados con láser del tipo Neodinium-YtriumAluminiumGranate (Nad-YAG) (1,26) o electrofulguración (7, 29, 30), estos dos últimos procedimientos se pueden realizar de manera más segura con ultrasonido endobronquial, una nueva técnica, que ayuda a delimitar más el compromiso extraluminal de las lesiones (29,30) como se puede observar en la Figuras 1 y 2, sin embargo, a pesar de que las resecciones a través de fibrobroncoscopia pueden llegar a lograrse, la recurrencia posterior a estos procedimientos es alta, es por esto que se siguen considerando como un procedimiento paliativo, más que curativo, por lo que no se recomienda como terapia definitiva (5). De igual forma debemos recordar que el tratamiento quirúrgico es el tratamiento de elección y la aproximación primaria a la terapéutica de estos tumores (7, 8).
Figura 10. Fibrobroncoscopia con catéter para ultrasonido endobronquial (29).
De otro lado, no podemos olvidar que se trata de un tumor maligno, y que a pesar de ser los de menor incidencia, algunos carcinoides típicos pueden comportarse de manera agresiva, estando clasificados dentro de estos los que comprometen carina, debido a la inoperabilidad que esto conlleva (1). Se han identificado algunos factores que se han asociado con una mayor probabilidad de tener un comportamiento agresivo como son la historia familiar de cáncer, el tamaño del tumor y la presencia de Síndrome de Cushing, relacionándose estos con peor pronóstico y una mayor tasa de enfermedad metastásica (1). Así mismo, la presencia de anticuerpos en las células tumorales para Antigeno Carcinoembrionario (CEA), el cual se puede encontrar hasta en el 50% de los casos (31), se ha relacionado con una pobre respuesta al tratamiento (1,31).
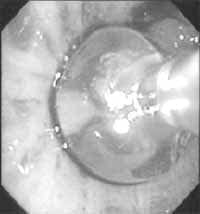
Figura 11. Catéter de endoscopia intrabronquial, con balón inflado con agua como medio de contraste (29).
La radioterapia postquirúrgica puede estar indicada en pacientes con metástasis a ganglios linfáticos
(11), sin embargo, debe ser tenida en cuenta como un evento paliativo (7,14). En una serie de pacientes realizada por Schupak y cols sugirieron que cerca del 80% de los pacientes tratados con radioterapia tenían respuesta parcial o completa a la terapia, pero la curación en enfermedades avanzadas no era lograda (7, 14).
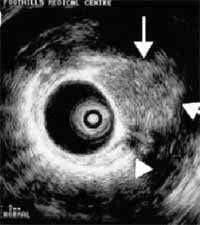
Figura 12. Visión ultrasonográfica endobronquial del tumor carcinoide endobronquial señalado por la flechas (29).
– Tumores carcinoides atípicos:
Al contrario de los anteriores, debido a su atipicidad histológica, su comportamiento es más agresivo y con una alta tasa de enfermedad metastásica (25 – 100%) al momento de la evaluación inicial, correspondiendo en su mayoría a compromiso de los ganglios linfáticos mediastinales, variando entre un 30 – 50% de los casos (3,5). llevando a una pobre tasa de supervivencia a los 5 años (40 – 70%) y del 35% a los 10 años (16), dependiendo del estadio al momento del diagnóstico, con una media de mortalidad relacionada en 30% y unos rangos entre el (27 – 47%) (3,5,8).
La radioterapia es recomendada en el postoperatorio de este tipo de tumores y de manera especial en aquellos con metástasis en los ganglios linfáticos regionales (11). En los casos con metástasis sistémicas puede realizarse tratamiento adyuvante con estreptotozina, 5-fluorouracilo, doxorrubicina, cisplatino o etopósido (3,14). De igual forma la quimioterapia combinada, similar a la usada en los carcinomas de célula pequeña, puede producir resultados positivos hasta en el 50% de los pacientes (11).
Si bien su pronóstico es diferente, los tratamientos no difieren, pero con una menor tasa de curación (1,11).
De otro lado, cuando se trata de tumores metastásicos, el estudio difiere un poco a el de los primarios, es así como la aspiración con aguja fina usualmente no provee una cantidad adecuada de material para estudio, particularmente en pacientes en los que el tumor es pobremente diferenciado (21). La microscopía de luz ayuda a caracterizar la morfología celular y a la diferenciación del tumor, ayudado por el uso tanto de las coloraciones usuales así como de aquellas, como el mucicarmín, Alcian Blue o el PAS, que ayudan en la diferenciación de otros tipos de tumores, sin embargo, con el advenimiento de otras técnicas, como la inmunohistoquímica han venido perdiendo su utilidad (21).
La microscopía electrónica a pesar de su alto costo puede recomendarse en la evaluación de ciertas neoplasias mal diferenciadas (21).
La quimioterapia con un solo agente ha presentado baja tasas de respuesta, las cuales se encuentran por debajo del 10% (14), por lo que no sido considerada como el tratamiento de primera línea.
Bibliografía
1. Fraser R.S., Müller N.L., Colman N, Paré P.D. Neoplasias neuroendocrinas; 4° Edición; Diagnóstico de las Enfermedades del Tórax; Editorial Panamericana; 2002: 1214 – 1234.
2. Hasleton P.F.; Bening lung tumors and their malignant counterparts; Hasleton P.F.; Spencer’s Pathology of the Lung; 5° Edition; Mc Graw-Hill; 1996: 875 – 986.
3. Aranda FI, Alenda C, Peiró FM, Peiró G. Tumores neuroendocrinos pulmonares; Rev Esp Patol; 2003; 36(4):389-404.
4. Travis WD, Colby T, Corrin B, Shimosato Y, Brambilla E. Histological typing of lung and pleural tumours; world Health Organization International Histological Classification of Tumours; 3rd ed.; Berlin: Spriger-Verlag; 1999.
5. Kulke MH, Mayer RJ. Carcinoid tumors. N Engl J Med; 1999; 340(11): 858 – 868.
6. Lips C JM, Lentjes E GWM, Höppener J WM. The spectrum of carcinoid tumours and carcinoid síndromes; Ann Clin Biochem 2003; 40: 612-627.
7. Luce JA. Lymphoma, lymphoproliferative diseases, and other primary malignant tumors; Murray JF, Nadel JA, Mason RJ, Boushey HA Jr; Text Book of Respiratory Medicine; 3° Edition; W.B. Saunders Company; 2000: 1453 – 1468.
8. Travis WD, Linder J, Mackay B. Classification, histology, citology and electron microcopy; Lung Cancer: Principles and Practice; Mitchell JB, Johnson DH, Turrisi AT; Lippincortt-Raven Publishers, 1995: 361 – 395.
9. Öberg K. Carcinoid tumors: current concept in diagnosis and treatment; The Oncologist; 1998; 3: 339 –345.
10. Torres M, Barberis M, Barbieri B, et al. Typycal and atypical bronchial carcinoids; Respir Med; 1989; 83: 305–308.
11. Johnson BE, Chute JP. Extrapulmonary syndromes associated with lung tumors; Fishman AP, Elias JA, Fishman JA, Grippi MA, Kaiser LR, Senior RM; Fishman’s Pulmonary Diseases and Disorders; 3° Edition; Mc Grauw-Hill; 1997; 1833 –1840.
12. Godwin JD II. Carcinoid tumors. an analysis of 2837 cases; Cancer; 1975;36: 560.
13. Giustra PE, Stassa G. The multiple presentation of bronchial adenomas; Radiology; 1969; 93: 1013.
14. Megyesi M, Berta M, Khoor A. Endobronchial large cell neuroendocrine carcinoma; Path Onc Research; 2003; 9(3):198-200.
15. Franklin WA. Diagnosis of lung cancer, pathology of invasive and preinvasive neoplasia; chest 2000; 117: 80S-89S.
16. Pavlidis N, Briasoulis E, Hainswort J, Greco FA. Diagnostic and therapeutic management of cancer of an unknown primary; Eur J Of Cancer; 2003; 39: 1990-2005.
17. Lara JF, Rosen PP. Extramedullary hematopoiesis in a bronchial carcinoid tumor . an unusual complication of angiogenic myeloid metaplasia; Arch Pathol Lab Med; 1990; 114: 1283.
18. Arrigoni MG, Woolner LB, Bernatz PE. Atypical carcinoid tumors of the lung; J Cardiovasc Thorac Surg;1972; 64:413.
19. Okike N, Bernatz PE, Woolner LB. Carcinoid tumors of the lung; Ann Thorac Surg; 1976; 22: 270.
20. Suresh UR, Wilkes S, Hasleton PS, et al. Prealbumin in the diagnosis of bronchopulmonary carcinoid tumours; J Clin Pathol; 1991; 44: 573.
21. Goddard MJ, Atkinson C. Cardiac metastasis from a bronchial carcinoid: report of a case presenting with diffuse thickening of the left ventricular wall; J Clin Pathol; 2004; 57: 778 – 779.
22. Pass HI, Doppman JL, Nieman L, et al. Management of the ectopic acth syndrome due to thoracic carcinoids; Ann Thorac Surg; 1990; 50:52.
23. Scheithauer BW, Carpenter PC, Bloch B, Brazeau P. Ectopic secretion of growth hormone-releasing factor, report of a case of acromegaly with bronchial carcinoid tumor; Ann J Med; 1984; 76: 605.
24. Keller SM, Katariya K. Primary lung tumors other than bronchogenic carcinoma: benign and malignant; Fishman AP, Elias JA, Fishman JA, Grippi MA, Kaiser LR, Senior RM; Fishman’s Pulmonary Diseases and Disorders; 3° Edition; Mc Grauw-Hill; 1997; 1833 –1840.
25. Todd TR, Cooper JDWeissberg D, et al. Bronchial carcinoid tumors: 20 years experience; J Thorac Cardiovasc Surg; 1980; 79: 532.
26. Wang KP; Mehta AC, Turner JF Jr. Flexible bronchoscopy; 2nd Edition; Blackwell Publishing; 2004.
27. Kvols LK, Brown ML, O’Connor MK, et al. Evaluation of radiolabeled somatostatin analog (1 –123 ocreotide) in the detection and localization of carcinoid and islet cell tumors; Radiology 1993; 187: 129.
28. Bishopric GA Jr, Ordonez NG. Cacinoembrionic antigen in primary carcinoid tumor of the lung; Cancer; 1982; 58: 1316.
29. Tremblay A. Endobronchial ultrasonography: extending the reach oo the bronchoscope beyond the airway wall; JAMC; 2003; 6:169.
30. Berge T, Linell F; Carcinoid tumours: frequency in a defined population during a 12-year period. Acta Pathol Microbiol Scand (A); 1976; 84: 322-330.
31. Hasleton PS, al-Saffar N. The histological spectrum of bronchial carcinoid tumours; Appl Pathol; 1989; 7:205.
32. Schupak KD, Wallner KE. The role of radiation therapy in the treatment of locally unresectable or metastasic carcinoid tumors; Int J Radiatr Oncol Biol Phys; 1991; 20: 489 – 485.
CLIC AQUÍ Y DÉJANOS TU COMENTARIO