Timoma y Miastenia Gravis
J. P. VERGNAUD, MD; S. PENAGOS, MD; C. LOPERA, MD; J. VÁSQUEZ, MD.
Palabras clave: Timoma, Miastenia gravis, Tumor mediastinal, Mediastino anterosuperior.
Los timomas son las neoplasias más frecuentes del mediastino anterosuperior. La miastenia gravis ocurre hasta en el 50% de estos pacientes y este porcentaje es menor en al enfermedad benigna. Se presenta un caso de un paciente en la sexta década de la vida con un Timoma benigno, con obstrucción de la vía aérea. Se había diagnosticado miastenia gravis hacia 18 años. Se realizó timectomía y resección del tejido graso del mediastino anterior. Se revisa la literatura, haciendo énfasis en la clasificación y tratamiento de los pacientes con timoma y su asociación con la miastenia gravis.
Introducción
Los timomas son las segundas neoplasias en frecuencia en el mediastino con un 20% del total y las primeras en el mediastino anterosuperior(1). Raramente se presentan en la niñez(2,3) y su pico de incidencia está entre la tercera y quinta décadas. Son usualmente sintomáticos y los síntomas se deben al efecto de masa sobre estructuras mediastinales causando tos, disnea, dolor torácico, hemoptisis y síndrome de vena cava superior. También se asocian a varios síndromes sistémicos inmunológicos. El más frecuente es la miastenia gravis (MG) y le siguen la anemia aplásica y el lupus Eritematoso sistémico. Otros menos comunes son el Síndrome de Cushing. El Síndrome de Good (hipogamaglobulinemia y timoma), hipergamaglobulinemia, dermatomiositis, artritis reumatoide, megaesófago, miocarditis granulomatosa, leucemia linfoblástica aguda de células T, hiperparatiroidismo ectópico puro, encefalitis límbica, linfomas y trastornos de la coagulaicón, entre otros(4-10).
La MG ocurre entre el 10 y el 50% de los pacientes con timoma y su frecuencia es más baja para aquellos con enfermedad benigna(11, 12). La incidencia de la MG en estos pacientes se aumenta con la edad, para los hombres por encima de los 50 años y para las mujeres mayores de 60 años puede alcanzar más del 80%. Esta condición se caracteriza por debilidad muscular que varía desde síntomas menores oculares, faciales o faringopalatinos, hasta severa debilidad generalizada con falla respiratoria. La prueba de Tensilon es diagnóstica, aunque no siempre es positiva. La electromiografía de fibra única es sensible y específica para MG y debe realizarse para documentar el diagnóstico.
La mayoría de los pacientes con MG no tienen timoma. La incidencia varía entre el 10 y el 42%, y los hombres tienen el doble de posibilidades que la mujer de tener timoma. Por esta asociación, a los pacientes con MG se les recomienda TC o MRI de mediastino para determinar la presencia de timoma.
En los pacientes con MG el desarrollo de neoplasias malignas extratímicas es marcadamente mayor en aquellos con timoma y es posible que la timectomía disminuya la aparición de éstas(13), pero la presencia de MG en los pacientes con timoma y dichas malignidades no altera el pronóstico(14).
Los timos de los pacientes con MG contienen linfocitos B con capacidad para producir anticuerpos específicos antireceptor de acetilcolina (AChRab). El origen del autoantígeno miasteniogénico en los pacientes con timoma es complejo. Es posible que el epitelio tímico expresa una proteína que comparta ciertos epitelios peptídicos con la cadena alfa de receptor de acetilcolina (AChR). Esta “auto-imitación molecular” puede ser el disparador de la MG asociada al timoma(15). El AChRab bloquea el receptor de la placa motora del músculo estriado esquelético e interfiere con la transmisión neuromuscular. Con el tiempo los receptores se atrofian y disminuyen en número. El objetivo de la timectomía es disminuir los niveles de AChRab(16).
Estos pacientes también expresan anticuerpos contra otras proteínas del músculo estriado, particularmente contra la titina. Las células epiteliales neoplásicas expresan neurofilamentos de bajo y mediano peso molecular que comparten algunos epítopes con la titina. Esta respuesta aberrante contra epítopes similares a la titina de la célula epitelial tímica sugiere que linfocitos T maduros pueden auto-sensibilizarse y así iniciar la respuesta autoinmune anti-titina en los pacientes con MG y timoma (17). Por otro lado, el evento de auto-sensibilización en la MG puede ser primario con linfocitos contra los AChR de las células mioideas tímicas, o secundario con linfocitos sensibilizados contra los AChR de otros tejidos y atrapados por las células mioideas tímicas. En otros pacientes con timoma es posible que la auto-sensibilización ocurra de manera diferente. El proceso autoinmune puede ser iniciado por las células epiteliales tumorales las cuales expresan una proteína similar al AChR (18).
Pero no en todos los pacientes con timoma y MG la timectomía mejora los síntomas miasténicos. En experimentos con ratones, el trasplante de tejido de timoma o extratímico sin hiperplasia linfofolicular no induce la producción de AChRab, a diferencia del trasplante de tejido tímico con hiperplasia, que sí la induce (19). Además, el “timoma microscópico” es una entidad patológica que se encuentra en timos de pacientes con MG sin evidencia de timoma, en forma de islas epiteliales similares histopatológicamente al timoma (20).
Algunos oncogenes se correlacionan con el crecimiento del timoma y su asociación con la MG. En el estudio de Gilhus, la expresión del receptor del factor de crecimiento epitelial (EGF-R) se encontró en las células epiteliales neoplásicas en todos los timomas y se expresaba más fuertemente en las metástasis y en los pacientes con MG. El antígeno Ki67 también se expresaba especialmente en timomas de mayor tamaño. No demostró la expresión de los oncogenes bcl-2 y p-53 (21).
El tumor puede surgir de elementos epiteliales en el 40% de los casos, de tejido linfoide en el 40% y el 20% restante es de origen mixto o linfoepitelial (22). Del 15 al 65% de los timomas son benignos. La diferenciación entre benigno y maligno la determina la presencia de invasión a estructuras adyacentes, metástasis o evidencia de invasión capsular. Si la terapia se hace temprano en el curso de la MG, se encuentra un mayor porcentaje de timomas benignos (1,16). Marino y Muller-Hermelink y Kirchner et al propusieron una subclasificación morfológica de los timomas basados en la similitud de las células neoplásicas a los subtipos de las células tímicas normales. Definieron 4 categorías de timoma: medular, mixto, organoide y cortical, y dos subgrupos de carcinoma tímico: bien diferenciado y carcinoma de alto grado. Esta clasificación histológica tiene valor pronóstico independiente del estado del tumor. En el estudio de Quintanilla et al, los timomas mixtos y medulares fueron tumores benignos sin riesgo de recurrencia. Los timomas corticales y organoides mostraron riesgos de invasión intermedio y bajo, pero con significante riesgo de recidiva. Los carcinomas bien diferenciados del timo fueron siempre invasores con un riesgo alto de recidiva y mortalidad (23).
El lipotimoma es una variante histológica del timoma, donde se encuentra tejido tímico mezclado con tejido graso. Este se comporta tanto clínica como patológicamente similar al timoma puro y tiene características radiológicas particulares que permiten el diagnóstico preoperatorio (24, 25).
Los carcinomas tímicos son neoplasias raras, de extremado mal pronóstico. Se distingue del timoma invasor por la presencia de una citología maligna, una mayor incidencia de invasión local y émbolos metastásicos (26). Los subtipos histopatológicos incluyen: carcinoma de células escamosas, linfoepitelioma, indiferenciado, de células claras, mucoepidermoide y carcinoide (27). Estos pueden ser de difícil diferenciación histológica de otras neoplasias malignas del mediastino. Los anticuerpos monoclonales contra las citoqueratinas 7 y 13 son positivos en la mayoría de los escamocelulares tímicos y los carcinomas tiroideos con diferenciación similar al timo son positivos para el antígeno CD5, a diferencia de los timomas y otras neoplasias mediastinales (29).
Caso Clínico
Paciente de sexo masculino de 58 años, quien consultó por tos seca de 2 meses de duración. El examen físico era normal. Con antecedente de miastenia gravis diagnosticado a los 40 años, sin tratamiento hacía 4 años. (Restinon 80 mg quid). Los Rx del tórax mostraron una masa en el mediastino anterior (Figuras 1 y 2).
*
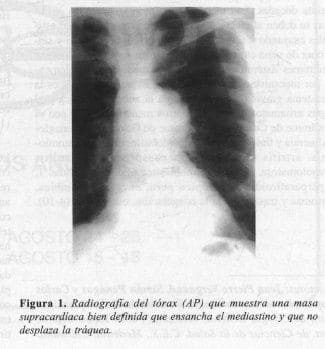 |
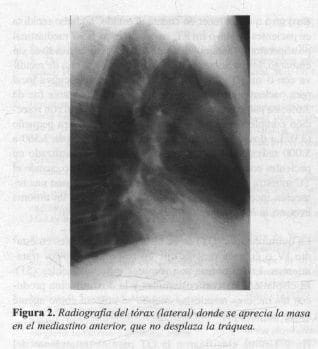 |
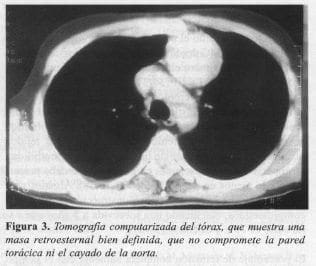
Se realizó biopsia con aguja Fransen guiada por tomografía computarizada (Figura 3). El resultado de inmunohistoquímica reportó positividad para citoquinas de bajo y alto peso molecular, y linfocitos T positivos para el CD3, lo que confirmó el diagnóstico de timoma.
Se llevó a timectomía y resección del tejido linfograso del mediastino anterior, vía esternotomía media, con tratamiento curativo. Se resecó una masa encapsulada que no comprometía tejidos adyacentes. El estudio histopatológico corrobora el diagnóstico de timoma de patrón mixto, sin compromiso macro ni microscópico de la cápsula, de la pleura ni del pericardio.
El paciente fue egresado del hospital al 4° día postoperatorio sin complicación ninguna. A los 16 ,eses no ha presentado síntomas de mistenia gravis. El pronóstico es excelente por cuanto presentaba un tumor de timo de características muy benignas, con un riesgo de recidiva mínimo y con una sobrevida a 5 años mayor del 90%.
Discusión
Es evidente que el timo es clave en la fisiopatología de la MG. La presencia de anomalías tímicas como hiperplasia con aumento de linfocitos B en pacientes jóvenes, timoma en pacientes de más edad y trastornos funcionales, principalmente activación de linfocitos B, T y células epiteliales, además de la mejoría clínica después de la timectomía, corroboran esta asociación.
En las radiografías del tórax las masas del mediastino anterior usualmente son de origen tímico. Como se mencionó previamente, todo paciente con MG requiere una TC de mediastino para descartar timoma. La presencia de un timo aumentado de tamaño o una masa focal en pacientes con MG indican hiperplasia linfoidea o timoma, pero la TC tiene un valor limitado para distinguir entre dicha hiperplasia, un timo normal o un timoma(30). La citología percutánea con aguja fina puede diferenciar entre timoma, tumor de células gremiales, linfoma o enfermedad de Hodgkin. Los dos últimos requieren una biopsia para el diagnóstico definitivo. En un estudio reciente con 33 pacientes, esta técnica tuvo una especificidad de 94% y una sensibilidad de 87% para masas mediastinales anteriores.
Masaoka et al, ha clasificado el timoma basándose en el grado de invasión y lo ha relacionado con el pronóstico. El estado I está completamente encapsulado microscópicamente con una sobrevida a 5 años de 92.6%; el estado II invade macroscópicamente el tejido graso vecino, la pleura mediastinal o invade microscópicamente la cápsula, con una sobrevida a 5 años del 85.7%; en el estado III hay invasión macroscópica a órganos adyacentes con una sobrevida a 5 años de 69.9%; el estado IV-A tiene compromiso pleural o pericárdico difuso metástasis linfática o hematógena con una sobrevida a 5 años menor del 50%(11).
Haniuda et al, proponen una clasificación adicional por factor pleural (p) y factor pericárdico (c) para protocolizar un tratamiento. Se determina con examen histológico después de la cirugía, así: p0/c0 = no adherencia del timoma a la pleura mediastina/pericardio; pl/cl= adherencias fibrosas a la pleura mediastinal/pericardio sin invasión microscópica; p2/c” = invasión microscópica a la pleura mediastinal/pericardio.
Tratamiento
La timectomía ha sido el componente más importante en el tratamiento de la MG desde 1939 con los trabajos de Blalock. La cirugía es la primera elección para el tratamiento de los timomas en estados I a III. La resección quirúrgica debe realizarse por esternotomía media, resecando todo el tejido graso del mediastino anterior, incluyendo el timo, desde el opérculo torácico hasta el receso pericardiofrénico posterior y los nervios frénicos lateralmente. Los tejidos invadidos se deben resecar sin que esto adicione morbilidad postoperatoria. Para pacientes en estadio III se debe preservar por lo menos un nervio frénico (1-16). Algunos grupos recomiendan la resección y reconstrucción de los vasos comprometidos, obteniendo una sobrevida a 5 años que varía entre el 77% y el 100%.
El porcentaje deremisión completa aumenta con el tiempo de seguimiento. Los títulos de AChRab pueden no disminuir en el postoperatorio a pesar de una mejoría total de los síntomas del paciente. Además, algunos pacientes permanecen sintomáticos aún con la remoción total del timo y tejido peritímico.
Para pacients en estado Y la timectomía extensa sin tratamiento adyuvante es suficiente como tratamiento definitivo, sin ninguna o muy pocas recidivas posquirúrgicas. Para pacientes en estados II y III la timectomía extensa y resección completa es un actor de buen pronóstico. Regnard et al, sugieren incluir la extensión de la resección (completa o incompleta) en la clasificación de los pacientes con timoma.
La recidiva local intratorácica o la diseminación pleural, son las causas más importantes de la falla del tratamiento inicial. El 21% de los pacientes en estado II y el 25% en estado III recidivan localmente y el efecto de la irradiación mediastinal en estos pacientes no es evidente cuando se investiga por estado clínico. El timoma es un tumor radiosensible, y la irradiación puede acelerar la tasa de apoptosis de las células neoplásicas. Urgosi et al, demostraron que la radioterapia (RT) adyuvante puede ser útil en algunos pacientes en estadio III. La RT adyuvante mediastinal parece ser la terapia más efectiva para reducir el riesgo de recidiva local y prolongar la sobrevida en los pacientes con enfermedad localmente avanzada.
Una mejor selección de los pacientes para RT adyuvante puede basarse en el factor pleural. En el estudio de Haniuda et al, se demostró que sin tener en cuenta el estado, no hubo recidiva en pacientes p0 con o sin RT; en pacientes p1 la RT mediastinal postoperatoria disminuyó significativamente la recidiva; sin embargo, los pacientes p2 presentaron una alta tasa de recidiva con o sin RT. También se demostró que la recidiva local para pacientes en estados II y III con RT adyuvante fue de 3.6%; en pacientes no irradiados fue de 17.2% aún con resección completa, aunque el número de pacientes era pequeño. La dosis recomendada en RT adyuvante fue de 3.6%; en pacientes no irradiados fue de 17.2% aún con resección completa, aunque el número de pacientes era pequeño. La dosis recomendada en RT adyuvante es de 3.500 a 5.000 rads. Como terapia neoadyuvante se ha utilizado en pacientes un compromiso de vena cava superior o cuando el TC muestra una invasión extensa. Para pacientes con una resección incompleta o después de una biopsia en un timoma invasor, la RT mediastinal está indicada.
La quimioterapia (QT) se ha utilizado en pacientes en estadio IV o en recurrencias que no responden a otros tratamientos. Los timomas son tumores quimiosensibles. El cisplatino, los corticosteroides y la doxorubicina producen las mejores respuestas cuando se utilizan como agente único en pacientes con timoma metastásico (16).
Hu y Levine clasificaron la QT para el tratamiento de timoma en gérmenes que contienen y que no contienen platino; en las que no lo contienen, la combinación de ciclofosfamida, vincristina (Oncovin), prednisona y procarbazina (COPP); ciclofosfamida, vincristina y prednisona (CVP) o ciclofosfamida, doxorubicina, oncovin y prednisona (CHOP), alcanzan una respuesta positiva en el 60% de los pacientes aproximadamente (53,54). Los regímenes que contienen platino parece que mejoran estos resultados; la combinación de cisplatino, doxorubicina, vincristina y ciclofosfamida alcanza una respuesta clínica positiva en el 92% de los pacientes, siendo completa en el 43%. Loehrer et al usando el régimen PAC, cisplatino (platinol), doxorubicina (adriamicina) y ciclofosfamida, alcanzó una respuesta positiva del 70% y una sobrevida de 69 meses. Además, los timomas que responden a la terapia con cisplatino tienen un mejor pronóstico. Park et al recomiendan el uso de QT, un régimen que contenga platino como multiterapia en pacientes en estadio II o mayor.
Abstract
Thymomas represent the most common neoplasm of the anterior and superior mediastinum. Muyasthemia gravis occurs in 50% of patients with thymomas, although this figure is lower with begin obstruction of the airway, and who had had the diagnosis of myasthemia gravis made 18 years previously. Thymectomy concomitant with resection of the fatty tissue of the anterior mediastinum was performed.
We review the literature, with emphasis on the classification and current management of patients with thymoma and associated myasthemia gravis.
Referencias
1. Davis RD Jr, Oldman HN Jr, Sabiston DC Jr: The mediastinum. In: Sabiston DC Jr, Spencer FC (eds). Surgery of the Chest. 6th de. WB Saundrs Company; 1990.p. 498-535.
2. Groisman GM, Ben-Izhak O, Best LA: Thymoma with foci of medullary differentiation in a 11-year-old-boy. Arch Pathol Lab Med 1994; 118(6): 653-5.
3. Niehues T, Harms D, Jurgens H, et al: Treatment of pediatric malignant thymoma long term remision in a 14-year-old-boy with EBV-associated thymic carcinoma by aggresive, combined modality treatment. Med Pediatric Oncol 1996; 26(6): 419-24.
4. Mevorach D, Perrot S, Buchanam NM, et al: Apperance of systemic lupus erithematosus after thymectomy: for case reports and review of the literature. Lupus 1995; 4(1): 33-7.
5. Nishioka R, Nakajima S, Morimoto Y, et al: T-cell acute lymphoblastic leukemia with transient pure red cell aplasia with myasthenia gravis and invasive thymoma. Intern Med 1995; 34(2): 127-30.
6. Yamazaki K, Hasegawa A, et al: Good’s syndrome with a block in the early stage of B cell differetation and complicated bu Campulobacter fetus sepsis. Intern Med 1994; 33(8): 469-500.
7. Enders GC, Sodums MT: Local thrombolytic therapy in superior vena cava syndrom secondary to malignant thymoma: a case report and literature review. Cather Cardiovasc Diagn 1994; 31(3): 215-8 Medline abstract.
8. Rizzoli R, Pache JC, Didierjean L, et al: A thymoma as a cause of true extopic hyperparathyroidism. J Clin Endocrinol Metab 1994; 79(3): 912-5.
9. Cunniham JD, Burt ME: Limbic encephalitis secondary to malignant thymoma. Ann Thorac Surg 1994; 58(1): 250-1.
10. Friedman HD, Inman DA, Hutchinson RE, et al: Concurrent invasive thymoma and T-cell ly,phobalstic leukemia and lymphoma. A case report with necropsy findings and literature review thymoma and associated hematologic neoplasm. Am J clin Pathol 1994; 101(4): 432-7.
11. Masaoka A, Monden Y, Nakahara K, et al: Follow-up study of thymomas with special reference to the clinical stages. Cancer 1981; 48: 2485-99.
12. Wilkins EW, Grillo HC, Scanell JG, et al: Role of staging in prognosis and management of thymoma. Ann Thorac Surg 1990; 55: 534-8.
13. Masaoka A, Yamakawa Y, Niwa H, et al: Thymectomy and malignancy. Eur J Cardiothorac Surg 1994; 8(5): 251-3.
14. Moreno A, Aguayo JL, Parrilla P, et al: Prognostic factors in thymoma. Eur J Surg Oncol 1995; 21(5): 482-5.
15. Holdfeld R, Wekerle H: The thymus in myasthenia gravis. Nuerol Clin 1994; 12(2): 131-42.
16. Goldberg M, Burkes RL: Tumors of the mediastinu. In: Harvey JC, Beattie EJ, editors. Cancer surgery. WB Saunders Company; 1996. P. 258-72.
17. Marx A, Wilisch A, Schultz A, et al: Expression of neurofilaments and of a titin epitope in thymic epithelial tumors: implications for the pathogenesis of myastenia gravis. Am J Pathol 1996; 148(6): 1839-50.
18. Eymard B, Berrih-Aknin S: Role of the thymus in the physiopathology of myasthenia. Rev Neurol Paris 1995; 151: 6-15.
19. Spuler S, Sarropoulus A, Marx A, et al: Thymoma associated myasthenia gravis. Transplantation of thymoma and extrathymomal thymic tissue into SCID mice. Am J Pathol 1996; 148(5): 1359-65.
20. Puglisi F, Finato N, Mariuzzi L, et al: Microscopic thymoma and myasthenia gravis. J Clin pathol 1995; 48(7): 682-3.
21. Gilhus EN, Jones M, Turley, et al: Oncogene proteins and proliferation antigens in thymomas: increased expression of epidermal growth factor receptor and Ki67 antigen. J Clin Pathol 1995; 48(5): 447-55.
22. De la Hoz J: Tumores y quistes mediastinales. Rev Col CIRUGIA 1986; 1(1): 45-54.
23. Quintanilla-Martínez L, Wilkins EW Jr., Choi N, et al: Thymoma: histologic subclassification is a independent prognostic factor. Cancer 1994; 74(2): 606-17.
24. Rosado de Christenson ML, Pugatch RD, Moran CA, et al: Thymolipoma: analysis of 27 cases. Radiology 1994; 193(1): 121-6.
25. McManus KG, Allen MS, Trastek UF, et al: Lipothymoma with red cel aplasia, hypogammaglobulinemia and lichen planus. Ann Thorac Surg 1994; 58(5): 1534-6.
26. Quagliano PV: Thymic carcinoma: case reports and review. J Thorac Imaging 1996; 11(1): 66-74.
27. Hsu CP, Chen CY, Chen CL, et al: Thymic carcinoma. Ten years experience in twenty patints. J. Thorac Cardiovasc Surg 1994; 107(2): 615, 20.
28. Fukai I, Masaoka A, Hashimoto T, et al: Differential diagnosis of thymic carcinoma and lung carcinoma and lung carcinoma with use of antibodies to cytokeratins. J Thorac Cardiovasc Surg 1995; 110(6): 1670-5.
29. Berenowski K, Grimes MM, Gal A, et al: CD5 immunoreactivity of epithelial cells in thymic carcinoma and CASTLE using paraffin embeded tissue. Am J Clin pathol 1996; 106(4): 483-6.
30. Nicolaou S, Muller NL, Li DK, et al: Thymus in myastenia gravis: comparision of CT and pathologic findings and clinical outcome after thymectomy. Radiology 1996; 201(2): 471-4.
Correspondencia:
Doctor J.P. Vergnaud, e-mail: iverg@epm.net.co – Instituto de Ciencias de la Salud, C.E.S. Calle 10A No. 22-04 Medellín, Colombia.
Doctores: Jean Pierre Vergnaud, Simón Penagos y Carlos Lopera, Residentes de CiruRía General; Jesús Vásquez, Profesor de Cirugía General: «Hospital Pablo Tobón Uribe»; lnst. de Ciencias de la Salud. c.E.S., Medellín, Colombia.

CLIC AQUÍ Y DÉJANOS TU COMENTARIO