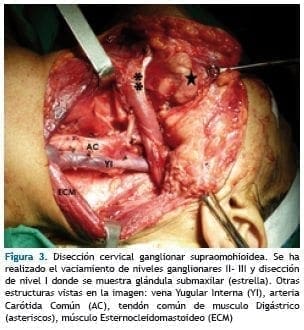
Se identifica nervio Accesorio Espinal y se eleva para disecar el nivel II b. La resección de este nivel se pasa por debajo del nervio accesorio espinal y se continúa disecando inferiormente el tejido medial al ECM completando la resección del nivel III que es llevado hacia la línea media.
Se corta la fascia del musculo omohioideo. Se identifica el plexo cervical superficial, la vaina carotidea y vena yugular interna. Se identifican y ligan ramas de la vena yugular interna. (Figura 3)
En el nivel I, luego de haber preservado la rama marginal del nervio facial, se exponen los vientres anterior y posterior del musculo digástrico. Se identifica los vasos faciales y el nervio hipogloso, los cuales se disecan, clampean, seccionan y se ligan con suturas no absorbibles.
Se expone el músculo milohioideo y se eleva, encontrando el nervio lingual y conducto de Wharton, el cual se clampea, secciona y liga. Se reseca glándula submaxilar. Se diseca región submental con resección de la glándula sublingual y tejido graso adyacente.
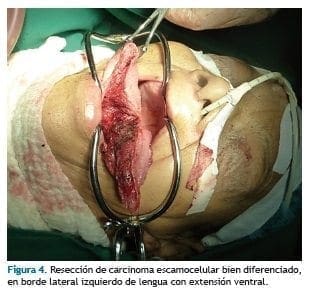
Con abrebocas de Jennings se expone cavidad oral, se fija hemilengua derecha con pinza de campo y se tracciona hacia anterior, se coloca punto de seda en hemilengua izquierda y se tracciona igualmente.
Con cauterio, se realiza incisión lateral a la línea media, en dirección anteroposterior, continuando a la altura de la unión de los 2/3 posteriores de la lengua y a lo largo del piso de la boca, manteniendo márgenes adecuados, hasta que queda libre el espécimen lingual (Figura 4)
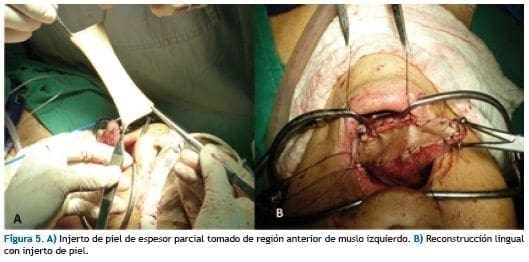
En muslo izquierdo, se toma injerto de piel de 0.018 mm de espesor y se cubre sitio donante con vendaje impregnado en ungüento antibiótico.
Se injerta piel de espesor parcial a bordes de resección y sutura con monofilamento no absorbible 4.0. (Figura 5). Se fija un vendaje capitonado sobre injerto. Se realiza hemostasia y cierre por planos con sutura de Poliglactina 910 y puntos separados en piel con sutura monofilamento no absorbible, previa colocación de drenaje de presión negativa. Se dejó cánula de traqueostomia No. 6.0
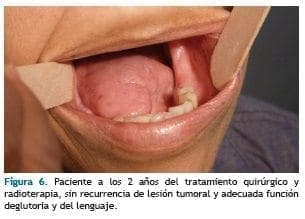
El reporte de patología confirmó carcinoma escamocelular bien diferenciado queratinizante infiltrante con márgenes libres y vaciamiento ganglionar con 2 niveles ganglionares comprometidos por tumor, indicándose a Radioterapia postoperatoria. Dos años después de tratamiento, paciente no ha presentado recurrencia de lesión tumoral. (Figura 6)
Discusion
Pese a los avances en el diagnóstico y tratamiento del CEC de lengua móvil, este continua teniendo mal pronóstico, con una supervivencia de 56% a 5 años (1). Se han reconocido predictores de pobre pronóstico tales como el estadio inicial, estado de los márgenes quirúrgicos, extensión de las metástasis ganglionares, diseminación extracapsular, invasión perineural y linfovascular.(6) (7)
En general, el manejo óptimo debe evaluar el cáncer primario y cualquier enfermedad metastásica. En cuanto más intenso sea el tratamiento, mejor el control locorregional y la supervivencia (6).
Los cánceres de cavidad oral han sido históricamente manejados de manera quirúrgica (8). En la mayoría de CEC de lengua, la glosectomía parcial es la opción quirúrgica para el tumor primario en estadios iniciales o formando parte del tratamiento multimodal en estadios avanzados.
El manejo quirúrgico permite evaluar márgenes, compromiso perineural o invasión linfovascular, además de la profundidad y estadificación del tumor, permitiendo trazar un esquema de manejo (9). Usualmente se prefiere el manejo quirúrgico de cánceres T1/T2 de la cavidad oral para evitar los graves efectos secundarios de la radiación a la boca.
Tumores T3/T4 tradicionalmente han sido tratados con resección del primario, vaciamiento cervical en presencia o no de ganglios y radioterapia postoperatoria. La cirugía también se utiliza para el salvamento en el sitio primario si hay enfermedad residual o recurrente.(9)
La cirugía con intención curativa tiene como objetivo eliminar el tumor primario con márgenes de tejido normal entre 1-2 cm considerados usualmente suficientes para asegurar que toda la enfermedad macroscópica sea erradicada (6), aunque hay controversia sobre el rango de espesor de corte critico de 2 a 10 mm sobre márgenes quirúrgicos, (1) y actualmente no existe un consenso sobre el margen adecuado (10).
Ya que la lengua, en comparación con otros compartimientos, no presenta un tabique en la línea media para restringir la diseminación tumoral, (11) tener márgenes libresen la resección puede ser difícil. El tumor puede tener una infiltración profunda que dificulte decidir en donde debe estar el margen de resección. (12)
La reconstrucción lingual, puede darse por cierre primario del defecto, y colgajos locales, regionales o a distancia. Para defectos pequeños, el cierre primario del defecto con injertos de espesor parcial, pueden mejorar la función deglutoria y del habla (13). El cierre por segunda intención puede servir para defectos pequeños sobre todo en la lengua anterior.
Para pacientes con CEC de vía aerodigestiva superior, el manejo adecuado de los ganglios cervicales es un tópico importante e incluso polémico, que tiene una influencia significativa en la supervivencia.
En general, el manejo agresivo sea quirúrgico o con radioterapia ha contribuido a mejorar el pronóstico (14). El manejo electivo terapéutico de los ganglios cervicales es recomendado para todos los pacientes de cáncer de lengua oral.
En Cuellos N0, el método óptimo de manejo continúa siendo controvertido (15). La incidencia de metástasis ocultas en los ganglios linfáticos regionales por CEC varia de 6 a 46% (16) correlacionándose con el tamaño, grado y profundidad del tumor primario.
Para pacientes con tumores T1 y T2, sin evidencia clínica o radiológica de metástasis cervicales, el control de la enfermedad es de 80-90% mientras la supervivencia a 5 años para pacientes con estadio III o IV es de 18-55% (13).
El tratamiento electivo del cuello N0 puede prevenir el aumento de la morbilidad, recurrencias y la necesidad de más cirugía radical, pero también pueden someter al paciente a una cirugía mayor innecesaria y sus riesgos asociados (17).
El tratamiento de cuello N0 se reduce a 2 opciones: irradiación electiva o disección electiva -que implica la resección quirúrgica de los ganglios linfáticos más implicados en albergar metástasis-.
La irradiación selectiva puede limitar el uso de radioterapia en una segunda estancia, sobre todo en segundos tumores primarios en cabeza y cuello. Cuando ésta ha sido previamente realizada en la región de cabeza y cuello, es raramente factible como opción terapéutica.
Por otro lado, si se desarrolla un segundo tumor primario y previamente hemos usado la cirugía como procedimiento terapéutico, tendremos a la mano la cirugía y la radioterapia como potenciales opciones de manejo en el tratamiento de un segundo primario (15).
Ferlito et al, recomienda tratar el cuello N0 cuando la incidencia de metástasis ocultas sea mayor de 20%. Esta incidencia puede variar con el sitio de localización del primario, su tamaño y características específicas (15).
Myers et al, favorece la disección electiva de cuello más que la conducta de “esperar y ver”. La disección de niveles I a III y posibilidad de nivel IV al mismo tiempo que la extracción del tumor es recomendada para N0 y ciertos casos seleccionados de N+(17).
La disección de cuello supraomohioideo eliminaría la mayoría de los ganglios linfáticos que puedan estar involucrados en metástasis ocultas de la lengua, incurriendo en una menor morbilidad.
Fasunla et al, mostró que la disección cervical electiva reduce el riesgo de muerte específica de la enfermedad en comparación con la observación (18). Una revisión sistemática de Tandon et al, concluye que en pacientes con cuello N0, el nivel a tratar es el nivel II en pacientes con cáncer de cavidad oral. (19)
En pacientes con cuello N+, la disección cervical es efectiva para el tratamiento de pacientes N1 y algunos N2 sin compromiso extracapsular. Condiciones como metástasis cervicales múltiples, compromiso extracapsular, metástasis fijas y compromiso carotideo o invasión perineural requieren radioterapia postoperatoria y/o quimioterapia. La radioterapia postoperatoria ha mostrado reducción en tasas de recurrencia en pacientes que presenten estas condiciones. (20)
Un factor que influye en la selección del tratamiento de cuello, es la modalidad con la que se tratara el tumor primario. Si se emplea radioterapia externa, el cuello es irradiado de manera simultánea. Igualmente, si la cirugía es la elegida como método de tratamiento para la lesión primaria, la disección electiva del cuello es realizada en la misma cirugía.
Por otra parte, la radioterapia ha emergido como un tratamiento viable sola o en combinación con cirugía o quimioterapia. Se usa como manejo definitivo, en el postoperatorio -como terapia adyuvante para pacientes que presentan factores de riesgo elevado o enfermedad avanzada- y como terapia de salvamento (7).
Los pacientes que presentan enfermedad avanzada T3 o T4 o diseminación a ganglios linfáticos cervicales con o sin extensión extracapsular requieren de este tratamiento (21).
Conclusiones
El cáncer de lengua tiene un comportamiento localmente agresivo y su predisposición a metastatizar a ganglios linfáticos cervicales, hace que las medidas a tomar para su manejo sean más intensas para lograr un mejor control locorregional.
Actualmente el cáncer localmente avanzado dista de ser el ideal, aunque una mejor comprensión de los factores pronósticos ayudarán en la elección de terapias que beneficien al paciente.
Al igual que el manejo quirúrgico del tumor primario y las diversas formas de reconstrucción del defecto por la glosectomía, los autores apoyamos la disección electiva supraomohioidea de cuello en pacientes N0, ya que el control de la enfermedad del cuello y la supervivencia pueden mejorar significativamente, si se realiza la disección cervical antes que las metástasis se hagan clínicamente evidentes.
La radioterapia en pacientes de alto riesgo y con factores de mal pronóstico, sigue siendo una herramienta para el manejo agresivo de esta patología, ayudando a lograr la curación y disminución de las recurrencias.
Conflicto de intereses
Ninguno Declarado.
Referencias
1. Suslu N, Hosal AS, Aslan T, Sozeri B, Dolgun A. Carcinoma of the oral tongue: a case series analysis of prognostic factors and surgical outcomes. J Oral Maxillofac Surg. 2013; 71(7):1283-90.
2. Hilly O, Shkedy Y, Hod R, Soudry E, Mizrachi A, Hamzany Y, et al. Carcinoma of the oral tongue in patients younger than 30 years: comparison with patients older than 60 years. Oral Oncol. 2013; 49(10): 987-90.
3. Bachar G, Hod R, Goldstein DP, Irish JC, Gullane PJ, Brown D, et al. Outcome of oral tongue squamous cell carcinoma in patients with and without known risk factors. Oral Oncol. 2011;47(1):45-50.
4. McDowell JD. An overview of epidemiology and common risk factors for oral squamous cell carcinoma. Otolaryngol Clin North Am. 2006; 39(2): 277-94.
5. Robinson PN, Mickelson AR. Early diagnosis of oral cavity cancers. Otolaryngol Clin North Am. 2006; 39(2):295-306.
6. Fan KH, Lin CY, Kang CJ, Huang SF, Wang HM, Chen EY, et al. Combined-modality treatment for advanced oral tongue squamous cell carcinoma. Int J Radiat Oncol Biol Phys. 2007; 67(2):453-61.
7. Bello IO, Soini Y, Salo T. Prognostic evaluation of oral tongue cancer: means, markers and perspectives (II). Oral Oncol. 2010; 46(9):636-43.
8. Hicks WL Jr, North JH Jr, Loree TR, Maamoun S, Mullins A, Orner JB, et al. Surgery as a Single Modality Therapy. Am J Otolaryngol. 1998; 19(1): 24-8.
9. Campana JP, Meyers AD. The surgical management of oral cancer. Otolaryngol Clin North Am. 2006; 39(2):331-48.
10. Chang AM, Kim SW, Duvvuri U, Johnson JT, Myers EN, Ferris RL, et al. Early squamous cell carcinoma of the oral tongue: comparing margins obtained from the glossectomy specimen to margins from the tumor bed. Oral Oncol. 2013; 49(11): 1077-82.
11. Prince S, Bailey P. Squamous carcinoma of the tongue: review. Br J Oral Maxillofac Surg. 1999; 37(3):164-74.
12. Montero PH, Palmer FL, Shuman AG, Patel PD, Boyle JO, Kraus DH, et al. A novel tumor: Specimen index for assessing adequacy of resection in early stage oral tongue cancer. Oral Oncol. 2014; 50(3): 213-20.
13. Sun J, Weng Y, Li J, Wang G, Zhang Z. Analysis of determinants on speech function after glossectomy. J Oral Maxillofac Surg. 2007; 65(10): 1944-50.
14. Ferlito A, Rinaldo A, Robbins KT, Leemans CR, Shah JP, Shaha AR, et al. Changing concepts in the surgical management of the cervical node metastasis. Oral Oncol. 2003; 39(5):429-35.
15. Wei WI, Ferlito A, Rinaldo A, Gourin CG, Lowry J, Ho WK, et al. Management of the N0 neck reference or preference. Oral Oncol. 2006; 42(2):115-22.
16. Ferlito A, Silver CE, Rinaldo A. Elective management of the neck in oral cavity squamous carcinoma: current concepts supported by prospective studies. Br J Oral Maxillofac Surg. 2009; 47(1): 5-9.
17. Cheng A, Schmidt BL. Management of the N0 neck in oral squamous cell carcinoma. Oral Maxillofac Surg Clin North Am. 2008; 20(3):477-97.
18. Fasunla AJ, Greene BH, Timmesfeld N, Wiegand S, Werner JA, Sesterhenn AM. A meta-analysis of the randomized controlled trials on elective neck dissection versus therapeutic neck dissection in oral cavity cancers with clinically nodenegative neck. Oral Oncol. 2011; 47(5): 320-4.
19. Tandon S, Munir N, Roland NJ, Lancaster J, Jackson SR, Jones TM. A systematic review and Number Needed to Treat analysis to guide the management of the neck in patients with squamous cell carcinoma of the head and neck. Auris Nasus Larynx. 2011; 38(6): 702-9.
20. Myers EN, Fagan JJ. Treatment of the N+ neck in squamous cell carcinoma of the upper aerodigestive tract. Otolaryngol Clin North Am. 1998; 31(4):671-86.
21. Ballonoff A, Chen C, Raben D. Current radiation therapy management issues in oral cavity cancer. Otolaryngol Clin North Am. 2006; 39(2): 365-80.