¿Cómo Funcionan?, ¿Cómo se Evalúan?
John Mario González MD. Ph.D., Anilza Bonelo M.Sc
Candidata Ph.D., Myriam Arévalo B.Sc., Candidata Ph.D. y Sócrates Herrera MD.
Los conocimientos generados en el campo de la función y la actividad de los linfocitos T CD8+ al igual que en la caracterización de las moléculas del Complejo Mayor de Histcompatibilidad han sido parte fundamental para determinar los mecanismos inmunes celulares que actúan en el control de procesos infecciosos y tumorales.
Los linfocitos T CD8+ tienen la capacidad de reconocer antígenos presentados por las moléculas del clase I en la superficie de las células.
Una vez el antígeno es reconocido por los linfocitos, se inicia una serie de vías de activación en el linfocito que llevan finalmente a la eliminación de la célula blanco mediante mecanismos como citotoxicidad directa o la inducción de muerte celular programada.
Respuesta celular mediada por los linfocitos T CD8+
En este artículo se revisan los principales aspectos de la respuesta celular mediada por los linfocitos T CD8+ que permiten su identificación mediante técnicas de laboratorio como la prueba de liberación de cromio y la determinación de citocinas mediante ELISPOT.
Introducción
La respuesta inmune adquirida o específica es mediada por dos tipos de moléculas receptoras: las inmunoglobulinas (Ig) en la superficie de los linfocitos B y el receptor de celulas T (RCT) en los linfocitos T. A diferencia de las Ig que reconocen antígenos solubles, el RCT reconoce sólo antígenos presentados en el contexto de las moléculas del Complejo Mayor de Histocompatibilidad (CMH) MACROAUTO ENRef (1).
De esta forma, los linfocitos T (LT) pueden detectar patógenos intracelulares al reconocer fragmentos de antígenos derivados del microorganismo en la superficie de la célula infectada.
Los linfocitos T CD8+ MACROAUTO ENRef
Los patógenos como los virus y algunas bacterias que se replican en el citosol, son reconocidos y eliminados por los linfocitos T CD8+ MACROAUTO ENRef (2). Los patógenos que viven en vesículas como bacterias y parásitos son reconocidos por los linfocitos T CD4+ MACROAUTO ENRef (3).
En este artículo se revisarán los conceptos generales de los principales participantes en la respuesta inmune mediada por los linfocitos citotóxicos (LCT).
Finalmente se revisarán los sistemas de evaluación para la función de la respuesta de LCTs con énfasis en las pruebas basadas en la citotoxicidad y la producción específica de citocinas.
Moléculas de clase I del CMH y presentación de péptidos
El estudio de las moléculas de clase I del CMH por medio de cristalografia de rayos X, ha permitido no sólo hacer aproximaciones a su estructura sino también a conocer aspectos funcionales MACROAUTO ENRef (4, 5).
Las moléculas de clase I están conformadas por una cadena (codificada en el cromosoma 6 humano y por la (2 microglobulina. La cadena (presenta tres dominios funcionales, los dominios (1 y 2) que forman la hendidura donde se une el péptido y el dominio (3 forma la región parecida a la inmunoglobulina MACROAUTO ENRef (1).
La (2 microglobulina se une de forma no covalente a la cadena ( y le brinda estabilidad a la molécula de clase I antes de que se una el péptido antigénico MACRO-AUTO ENRef (6), Figura 1.
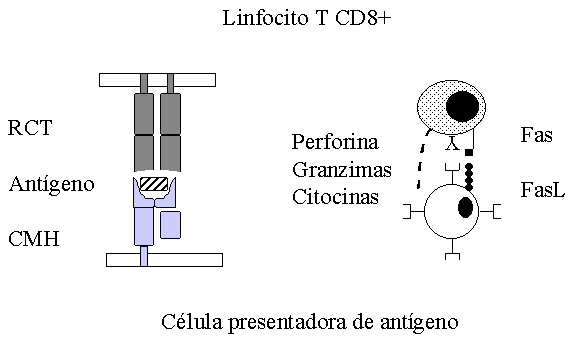
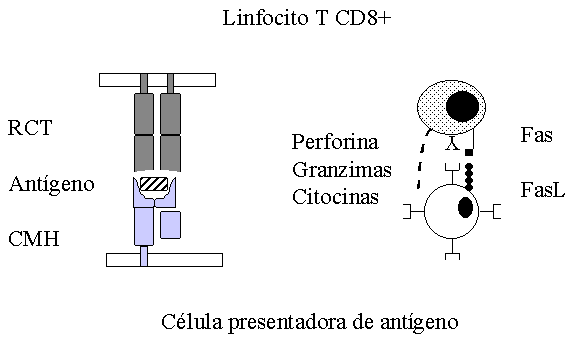
Figura 1. Presentación de antígenos al linfocito T CD8+. La célula presentadora de antígeno, procesa y presenta el antígeno en el contexto de las moléculas de clase I. Una vez reconocido el antígeno se activa el linfocito T y se disparan los mecanismos de acción. RCT: receptor de células T, CMH: complejo mayor de histocompatibilidad, FasL: ligando de la molécula Fas.
Actualmente, es posible determinar las características de los péptidos que potencialmente se unen a ciertas moléculas de clase I.
En las moléculas de clase I, la hendidura de unión al péptido sólo reciben antígenos de 9 a 10 aminoácidos, algunos de estos residuos tienen la capacidad de insertarse en una especie de bolsillos formados en la base de la hendidura del las moléculas del CMH.
Estos residuos que son los realmente encargados de la unión péptido/CMH reciben el nombre de motivos o secuencias de anclaje MACROAUTO ENRef (7-9). La secuencia potencial de unión de los péptidos a la molécula de clase I HLA-A*0201 es mostrada de forma esquemática en la Figura 2.
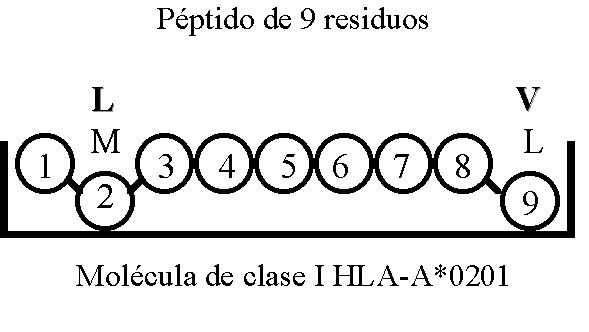
Figura 2. Esquema que representa los residuos del péptido (aminoácidos en posición 2 y posición 9) que se unen a la molécula de clase I HLA-A*0201. Los aminoácidos están re-presentados por el código de una letra: L, Leucina; M, Metionina; V, Valina.
Antes de unirse a las moléculas recién sintetizadas en el retículo endoplásmico, los péptidos de tamaño adecuado son generados en el citosol por medio del denominado “procesamiento antigénico”, tal es el caso de antígenos virales y tumorales MACROAUTO ENRef (10).
Las proteínas en el citosol sufren un procesamiento enzimático por medio de una organela denominada proteasoma MACROAUTO ENRef (11). El proteasoma está compuesto por diversas subunidades, dos de las cuales, denominadas LMP-2 y LMP-7, son codificados por genes localizados en el loci del CMH en el cromosoma 6 MACROAUTO ENRef (12). La expresión de estos genes puede ser inducida por el interferón gama (IFN-().
La incorporación de estas subunidades al proteasoma está asociada con la especificidad del corte en los péptidos gene-rados que se ensamblarán junto con las moléculas de clase I MACROAUTO ENRef (13).
Una vez los péptidos son generados, son transportados del citosol a la luz del retículo endoplásmico. Dos moléculas denominadas transportadores,
TAP-1 y TAP-2, y codificados igualmente en el loci de los genes CMH, funcionan como medio de transporte para los péptidos MACROAUTO ENRef (11, 14).
De forma más reciente, se ha determinado que una nueva molécula, denominada tapaisina, se asocia a las proteínas TAP para ayudar a la traslocación del péptido al retículo MACROAUTO ENRef (15, 16).
Una vez dentro del retículo endoplásmico, la molécula de clase I recién sintetizada estabilizada por chape-ronas y por la (2 microglobulina, recibe el péptido y continúa su ruta hacia la superficie celular MACROAUTO ENRef (11), MACROAUTO ENRef (10).
Los principales pasos de la vía de procesamiento de clase I son representados en la Figura 3.
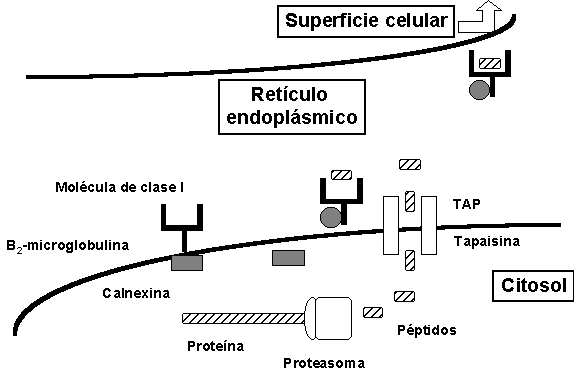
Figura 3. Representación de los principales pasos en la vía de procesamiento de los antígenos presentados por las moléculas de clase I. Una vez el péptido ha sido producido, transportado y ensamblado con la molécula de clase I, el complejo péptido/CMH continúa su ruta hacia la superficie de la célula.
Los linfocitos T CD8+
La inmunidad posee un sistema de reconocimiento específico de antígenos producidos dentro de la célula hospedera como el caso de las infecciones virales, algunas infecciones bacterianas y parasitarias y también en antígenos producto del cambio neoplásico de las células.
Dicho sistema de reconocimiento es mediado por los Linfocitos T CD8+ (LT CD8+) que censan la superficie de la células nucleadas mediante su RCT en busca de antígenos presentados por las moléculas de clase I del CMH.
Los Linfocitos T CD8+ (LT CD8+) vírgenes una vez activados, se diferencian en LCTs. En dicho proceso de activación no solo participa el reconocimiento del antígeno sino también señales coestimulatorias que dependen de la célula blanco de ataque o Célula Presentadoras de Antígeno (CPA) MACROAUTO ENRef (17).
Una vez activado el LCT se generan una serie de mecanismos efectores encaminados a la destrucción de la célula infectada o tumoral MACROAUTO ENRef (18), Figura 1.
El principal mecanismo efector de los LT CD8+ es la citotoxicidad donde mediante exocitosis se liberan sustancias almacenadas en los de gránulos pre-formados.
Estos granulos contienen proteínas como la perforina y las granzimas o fragmentinas MACROAUTO ENRef (19, 20). La perforina, la cual presenta una alta homología y actúa de forma similar al factor C9 del complemento, se polimeriza en la membrana biológica de la célula blanco generando poros que permiten el paso de agua y electrolitos, induciendo lísis osmótica MACROAUTO ENRef (21, 22).
Las granzimas son proteínas pertenecientes a la familia de proteasas de serina.
Estas enzimas, que entran a la célula a través de los poros formados en la membrana por la perforina, tienen la capacidad de inducir la muerte celular mediante la fragmentación del ADN de las células blanco, probablemente induciendo el mecanismo de la apoptosis MACROAUTO ENRef (23).
Otro mecanismo de muerte celular no dependiente de perforina involucra la interacción entre la molécula Fas (CD95) y su ligando del Fas (FasL). Esta última molécula se expresa en la superficie de los LT CD8+.
La interacción Fas/FasL induce en la célula blanco la muerte celular programada mediante la apoptosis MACROAUTO ENRef (18, 22, 24).
Finalmente los LCTs activados producen de forma específica citocinas como IFN-(y el factor de necrosis tumoral alfa (FNT-() MACROAUTO ENRef (25).
Estas citocinas contribuyen al sistema de defensa incrementando la expresión de moléculas del CMH, aumentando el transporte de péptidos que se unen al CMH e induciendo al producción de óxido nítrico MACROAUTO ENRef (1).
Todas estas propiedades del los LCTs pueden ser utilizadas para detectar la presencia de LT específicos de antígeno y para determinar la frecuencia de estos en sangre periférica
Evaluación de la respuesta inmune mediada por los linfocitos T CD8+
Múltiples técnicas han sido utilizadas para la evaluación de los LT CD8+. Dentro de estas técnicas se encuentran:
a) la prueba de citotoxicidad por liberación de cromio MACROAUTO ENRef (26), b) la valoración de citocinas por ELISPOT MACROAUTO ENRef (27), c) la tinción intracelular de citocinas mediante citometría de flujo MACROAUTO ENRef (28), d) la secuenciación del RCT MACROAUTO ENRef (29, 30) y de forma mas reciente e) la producción de tetrámeros solubles de clase I del CMH MACROAUTO ENRef (31, 32).
Esta revisión se enfocará en las dos primeras técnicas descritas las cuales son de uso común en nuestro laboratorio.
1. Prueba de citotoxicidad por liberación de cromio
Esta prueba de citotoxicidad descrita hace ya más de dos décadas ha sido la técnica de mayor uso para la determinación de LT CD8+ específicos de antígeno MACROAUTO ENRef (26).
Sin embargo su limitada sensibilidad y el uso de un isótopo radiactivo como el 51 Cr, han influenciado la búsqueda de nuevos métodos para su remplazo, aunque la prueba sigue siendo de gran utilidad.
El principio básico de la prueba de citotoxicidad radica en la capacidad de los LTCs de lisar la célula blanco mediante la liberación de perforina MACROAUTO ENRef (22).
De un lado, se cuenta con las células efectoras (LT CD8+) que reconocen de forma especifica un antígeno presentado en el contexto de las moléculas de clase I del CMH, y del otro lado se cuenta con la célula blanco que puede estar infectada por un virus o una célula tumoral, en ambos casos los antígenos procesados por la vía de clase I, son expresados en la superficie de esta CPA MACROAUTO ENRef (33).
Sin embargo una CPA puede ser pulsada con péptidos sintéticos que representen la secuencia del antígeno que se quiera estudiar, Figura 4. Con posterioridad la CPA ha sido marcada con 51 Cr, isótopo que se usa como el revelador de la prueba.
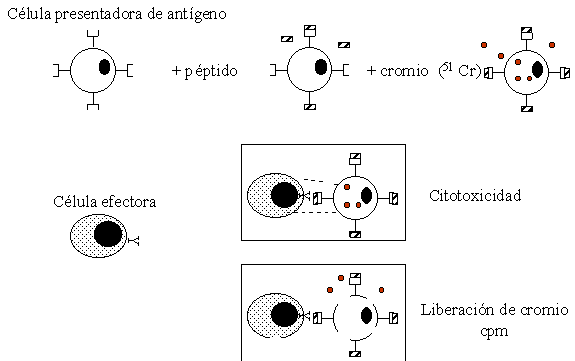
Figura 4. Prueba de liberación de cromio. La célula blanco que a su vez presenta el antígeno esta marcada con cromio. Una vez el complejo peptido/CMH es reconocido por la célula efectora (linfocito T CD8+) se induce la lísis mediada por perforina con la liberación del 51Cr al medio. El sobrenadante es recuperado y leído en un contador gama, el resultado se obtiene en cuentas por minuto (cpm).
Ambos tipos de células, efectora y blanco son incubadas juntas por un periodo de 4 a 6 horas, tiempo en el cual si el LCT reconoce el antígeno se induce la liberación de perforina y la posterior lísis de la célula blanco que permite la salida del 51 Cr, de tal forma que la cantidad de 51 Cr en el sobrenadante es proporcional a la actividad citotóxica presente en el cultivo.
La Figura 5 muestra la curva típica de una prueba de liberación de cromio con células humanas especificas de un péptido sintético proveniente de la proteína de matriz del virus de la influenza (MP flu a.a. 58-66) restringido a la molécula de clase I HLA-A*0201 MACROAUTO ENRef (34).
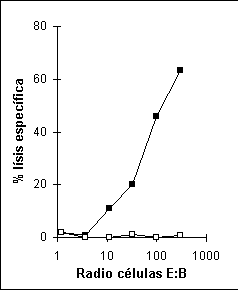
Figura 5. Prueba de liberación de cromio con linfocitos T CD8+ humanos. En el eje Y se encuentra el porcentaje de lísis y en el eje X el radio entre las células efectoras y las células blanco iniciando (1000:1). Células blanco (CPA) pulsadas con el péptido MP flu (() y células no pulsadas con péptido (() utilizadas como el control negativo de la prueba. Radio E:B, relación entre el número de células efectoras y células blanco.Una de las desventajas de la prueba de liberación de cromio es que el resultado obtenido nos indica la presencia de citotoxicidad de una forma cuantitativa.
Si se desea obtener la frecuencia de LCTs específicos de antígeno, se deberá realizar la denominada Prueba de Dilución Limite (LDA en ingles), prueba dispendiosa y de altos costos MACROAUTO ENRef (41).
2. Valoración de citocinas por ELISPOT
Mediante la técnica de ELISPOT (enzyme-linked immunospot) se evalúa la producción de citocinas por parte de una célula activada, lo que permite no sólo su detección sino también contar cada célula, obteniendo así la frecuencia de LT específicos de antígeno MACROAUTO ENRef (27).
El principio básico del ELISPOT es la captura de una citocina mediante dos anticuerpos en un procedimiento similar a la técnica de ELISA. Para tal fin se utilizan placas de 96 pozos con el fondo recubierto con papel de nitrocelulosa en el que se pega el primer anticuerpo monoclonal especifico de la citocina a medir.
Seguidamente se depositan las células (LCTs) frescas o previamente estimuladas in vitro, las cuales producirán citocinas (IFN-(y TNF-() MACROAUTO ENRef (35, 36).
Posteriormente se adiciona un segundo anticuerpo monoclonal marcado con una enzima que permite el revelado de la prueba por medio de la adición de un substrato, Figura 6. Los puntos (del ingles spots) obtenidos, reflejan la producción de citocinas y son las huellas dejadas por los LCTs especifico de antígeno activados.
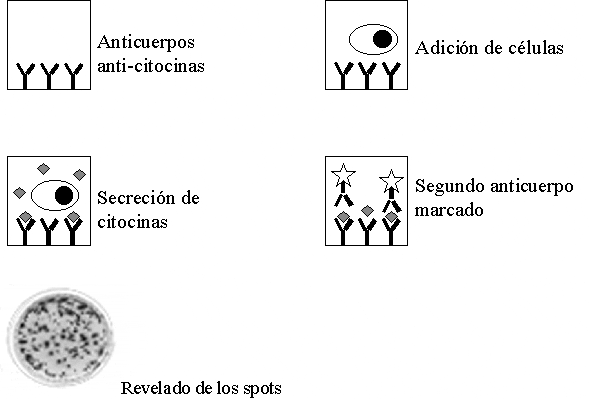
Figura 6. estudiar es capturada en medio de dos anticuerpos Prueba de ELISPOT. La citocina a monoclonales, la presencia de los puntos indica que en ese sitio una célula produjo citocina en respuesta a un estimulo antigénico. En la figura inferior se muestra el resultado de un ELISPOT para IFN-?? en linfocitos T CD8+ específicos del virus de la influenza.
El resultado (número de spots) se obtiene de contar los puntos por medio de un estereoscopio y la frecuencia se obtiene de relacionar el número de ellos con le número de células efectoras incubadas en cada pozo.
Aunque se puede presentar variabilidad en el tamaño y en la intensidad de los puntos, la valoración visual es adecuada. En la actualidad se cuentan con equipos de conteo automático asistidos por vídeo MACROAUTO ENRef (37).
En la parte inferior de la figura 6, se muestra el resultado de un ELISPOT utilizando LT CD8+ purificados mediante selección positiva utilizando perlas magnéticas cubiertas con un monoclonal anti-CD8+. Los linfocitos fueron estimulados en presencia del péptido MP flu.
Esta técnica del ELISPOT ha sido utilizada con éxito en la evaluación de la frecuencia de LCT en enfermedades infecciosas virales como influenza MACROAUTO ENRef (38) y SIDA MACROAUTO ENRef (39, 40) y en enfermedades tumorales como el melanoma MACROAUTO ENRef (36).
Se considera que el ELISPOT es 30 a 100 veces mas sensible que la prueba de liberación de cromio MACROAUTO ENRef (41).
Conclusiones
Nuevas técnicas han sido desarrolladas para la evaluación y el monitoreo de la respuesta inmune mediada por los LC CD8+, sin embargo las técnicas discutidas en este artículo: prueba liberación de cromio y el ELISPOT, son de amplia uso debido a su especificidad y facilidad de aplicación en la investigación básica y clínica realizada en nuestro medio.
Agradecimientos
Los autores agradecen a los doctores J.A. López y G. Corradin del Instituto de Bioquímica de la Universidad de Lausana, Suiza y a G. Quintero M.V. del Instituto de Inmunología del Valle por la corrección del manuscrito. A. Bonelo y M. Arévalo son becarias de COLCIENCIAS.
Referencias
- 1. MACROAUTO ENBib 1. Janeway CJ, Travers P. Immunobio-logy. The immune system in health and disease. London: Current Biology Ltd., 1997.
- 2. Kägi D, Ledermann B, Burki K, Zinkernagel RM, Hengartner H. Molecular mechanisms of lymphocyte-mediated cytotoxicity and their role in immunological protection and pathogenesis in vivo. Annu Rev Immunol 1996; 14: 207-32.
- 3. Sher A, Coffman R. Regulation of immunity to parasites by T cells and T cell-derived cytokines. Ann Rev Immunol 1992; 10: 385-409.
- 4. Bjorkman PJ, Saper MA, Samraoui B, Bennett WS, Strominger JL, Wiley DC. Structure of the human class I histocompatibility antigen, HLA-A2. Nature 1987; 329: 506-12.
- 5. Bjorkman PJ, Parham P. Structure, function, and diversity of class I major histocompatibility complex molecules. Annu Rev Biochem 1990; 59: 253-88.
- 6. Silver ML, Parker KC, Wiley DC. Reconstitution by MHC-restricted peptides of HLA-A2 heavy chain with beta 2-microglobulin, in vitro. Nature 1991; 350: 619-22.
- 7. Falk K, Rotzschke O, Stevanovic S, Jung G, Rammensee HG. Allele-specific motifs revealed by sequencing of self-peptides eluted from MHC molecules. Nature 1991; 351: 290-6.
- 8. Kubo RT, Sette A, Grey HM, et al. Definition of specific peptide motifs for four major HLA-A alleles. J Immunol 1994; 152: 3913-24.
- 9. Madden DR. The three-dimensional structure of peptide-MHC complexes. Annu Rev Immunol 1995; 13: 587-622.
- 10. York IA, Rock KL. Antigen processing and presentation by the class I major histocompatibility complex. Annu Rev Immunol 1996; 14: 369-96.
- 11. Song R, Harding C. Roles of proteasoma, transporter for antigen presentation (TAP), and B2-microglobulin in the processing of bacterial or particulate antigen via an alternate class I MHC processing pathway. J Exp Med 1996; 163: 903.
- 12. Griffin TA, Nandi D, Cruz M, et al. Immunoproteasome assembly: cooperative incorporation of interferon gamma (IFN-gamma)-inducible subunits. J Exp Med 1998; 187: 97-104.
- 13. Monaco JJ. Pathways for the processing and presentation of antigens to T cells. J Leukoc Biol 1995; 57: 543-7.
- 14. Elliott T. How does TAP associate with MHC class I molecules? Immunol Today 1997; 18: 375-9.
- 15. Ortmann B, Copeman J, Lehner PJ, et al. A critical role for tapasin in the assembly and function of multimeric MHC class I-TAP complexes. Science 1997; 277: 1306-9.
- 16. Herberg JA, Beck S, Trowsdale J. TAPASIN, DAXX, RGL2, HKE2 and four new genes (BING 1, 3 to 5) form a dense cluster at the centromeric end of the MHC. J Mol Biol 1998; 277: 839-57.
- 17. Azuma M, Cayabyab M, Buck D, Philips J, Lanier L. CD28 and interaction with B7 co-stimulates primary allogeneic proliferative responses and cytotoxic mediated by small, resting T lymphocytes. J Exp Med 1992; 175+356-360.
- 18. Kägi D, Vignaux F, Ledermann B, et al. Fas and perforin pathways as major mechanisms of T cell-mediated cytotoxicity. Science 1994; 265: 528-30.
- 19. Kägi D, Ledermann B, Burki K, Hengartner H, Zinkernagel RM. CD8+ T cell-mediated protection against an intracellular bacterium by perforin-dependent cytotoxicity. Eur J Immunol 1994; 24: 3068-72.
- 20. Shirver J, Su L, Henkart P. Cytotoxic ity with target DNA breakdown by rat bassophilic leukemia cellsexpressing both cytolysin ans granzyme A. Cell 199; 2: 315-322.
- 21. Lichtenheld MG, Olsen KJ, Lu P, et al. Structure and function of human perforin. Nature 1988; 335: 448-51.
- 22. Lowin B, Hahne M, Mattmann C, Tschopp J. Cytolytic T-cell cytotoxicity is mediated through perforin and Fas lytic pathways. Nature 1994; 370: 650-2.
- 23. MacDonald G, Shi L, Velde CV, Lieberman J, Greenberg AH. Mitochondria-dependent and-independent Regulation of Granzyme B- induced Apoptosis. J Exp Med 1999; 189: 131-144.
- 24. Lowin B, Mattman C, Hahne M, Tschopp J. Comparison of Fas(Apo-1/CD95)- and perforin-mediated cytotoxicity in primary T lymphocytes. Int Immunol 1996; 8: 57-63.
- 25. Boehm U, Klamp T, Groot M, Howard JC. Cellular responses to interferon-gamma. Annu Rev Immunol 1997; 15: 749-95.
- 26. Brunner HT, Mauel J, Cerottini JC, Chapuis B. Quantitative assay of the lytic action of immune lymphoid cells on 51Cr-labelled allogeneic target cells in vitro; inhibition by isoantibody and by drugs. Immunology 1968; 14: 181-196.
- 27. Czerkinsky C, Andersson G, Ekre HP, Nilsson LA, Klareskog L, Ouchterlony O. Reverse ELISPOT assay for clonal analysis of cytokine production. I. Enumeration of gamma-interferon-secreting cells. J Immunol Methods 1988; 110: 29-36.
- 28. Jung T, Schauer U, Heusser C, Neumann C, Rieger C. Detection of intracellular cytokines by flow cytometry. J Immunol Methods 1993; 159: 197-207.
- 29. Casanova J, Maryanski J. Antigen-selected T-cell receptor diversity and self-nonself homology. Immunol Today 1993; 14: 391-394.
- 30. Romero P, Pannetier C, Herman J, Jongeneel CV, Cerottini JC, Coulie PG. Multiple specificities in the repertoire of a melanoma patient’s cytolytic T lymphocytes directed against tumor antigen MAGE-1.A1. J Exp Med 1995; 182: 1019-28.
- 31. Altman JD, Moss PAH, Goulder PJR, et al. Phenotypic analysis of antigen-specific T. Science 1996; 274: 94-6.
- 32. Romero P, Dunbar PR, Valmori D, et al. Ex vivo staining of metastatic lymph nodes by class I major histocompatibility complex tetramers reveals high numbers of antigen- experienced tumor-specific cytolytic T lymphocytes. J Exp Med 1998; 188:1641-50.
- 33. Rock KL, Rothstein L, Gamble S, Fleischacker C. Characteri-zation of antigen-presenting cells that present exogenous antigens in association with class I MHC molecules. J Immunol 1993; 150: 438-46.
- 34. Gao XM, Zheng B, Liew FY, Brett S, Tite J. Primin
- 35. Di Fabio S, Mbawuike IN, Kiyono H, Fujihashi K, Couch RB, McGhee JR. Quantitation of human influenza virus-specific cytotoxic T lymphocytes: correlation of cytotoxicity and increased numbers of IFN-gamma producing CD8+ T cells. Int Immunol 1994; 6: 11-9.
- 36. Herr W, Schneider J, Lohse AW, Meyer zum Buschenfelde KH, Wolfel T. Detection and quantification of blood-derived CD8+ T lymphocytes secreting tumor necrosis factor alpha in response to HLA-A2.1-binding melanoma and viral peptide antigens. J Immunol Methods 1996; 191: 131-42.
- 37. Herr W, Linn B, Leister N, Wandel E, Meyer zum Buschenfelde KH, Wolfel T. The use of computer-assisted video image analysis for the quantification of CD8+ T lymphocytes producing tumor necrosis factor alpha spots in response to peptide antigens. J Immunol Methods 1997; 203: 141-52.
- 38. Scheibenbogen C, Lee KH, Stevanovic S, et al. Analysis of the T cell response to tumor and viral peptide antigens by an IFNgamma-ELISPOT assay. Int J Cancer 1997; 71: 932-6.
- 39. Herr W, Protzer U, Lohse AW, Gerken G, Meyer zum Buschenfelde KH, Wolfel T. Quantification of CD8+ T lymphocytes responsive to human immunodeficiency virus (HIV)peptide antigens in HIV-infected patients and seronegative persons at high risk for recent HIV exposure. J Infect Dis 1998; 178: 260-5.
- 40. Corne P, Huguet MF, Briant L, Segondy M, Reynes J, Vendrell JP. Detection and enumeration of HIV-1-producing cells by ELISPOT (enzyme- linked immunospot) assay. J Acquir Immune Defic Syndr Hum Retrovirol 1999; 20: 442-7.
- 41. Romero P, Cerottini J-C, Waanders G. Novel methods to monitor antigen-specific cytotoxic T-cell responses in cancer immunotherapy. Mol Med Today 1998; 4: 305-312.