Enfermedad ocular en EGB:
Muchos de los signos y síntomas clínicos previamente descritos en las manifestaciones oculares de la EGB (GO) pueden explicarse desde una base “mecánica” por el incremento en el volumen de los tejidos intrauterino, característica de la EGB.
Aunque la mayoría de los pacientes con GO se evidencia un crecimiento anormal de los músculos extraoculares y del tejido adiposo orbitario. Pudiendo existir un crecimiento predominante de uno u otro tejido. En individuos jóvenes tienen mayor presencia de expansión del tejido graso orbitario, mientras que en personas de edad avanzada existe mayor predisposición en el crecimiento de músculos extraorbitarios, sin cambios significativos en el tejido adiposo orbitario.
La inflamación de los tejidos retrobulbares es atribuida a la secreción excesiva de glucosaminoglicanos (GAG), especialmente condroitín sulfato y ácido hialurónico por parte de los fibroblastos de la órbita. Debido a su gran carga polianiónica. Los GAG atraen osmóticamente grandes cantidades de agua, contribuyendo al incremento en el volumen de los tejidos afectados (34,35).
La infiltración linfocítica presente en los tejidos orbitarios denota una predominancia de linfocitos T CD4+ y CD8+, con pocas células B. las células T retrobulbares de pacientes con OG reconocen fibroblastos autólogos. Pero no reconocen los extractos de músculos oculares en una manera restringida al HLA clase I.
La expresión de HLA-DR y moléculas de adhesión en las células endoteliales y fibroblastos de la órbita se realza por citoquinas como Interleuquinas (IL), en especial la IL-1α, Factor de Necrosis Tumoral (TNF) como el TNFα, e Interferón γ. Lo anterior hallevado a plantear que el fibroblasto de la órbita es el blanco del ataque autoinmune.
Como el TSHr se expresa en el ARN mensajero (ARNm) y en títulos altos en las proteínas del tejido conectivo y adiposo de la órbita de pacientes con OG:
Con relación a sujetos sanos, se considera que el TSHr es funcional, como se evidencia por el incremento del AMPc en respuesta a la TSH. De hecho. La diferenciación de preadipocitos de fibroblastos oculares en adipocitos se asocia con un marcado realce en la expresión funcional del TSHr.
El concepto surge de una subpoblación de fibroblastos oculares que pueden ser las células “blanco” en GO llamadas pre-adipocitos- que, si se estimulan para diferenciarse en adipocitos maduros, expresan niveles elevados de TSHr (36,37).
La GO se desencadena por linfocitos T autorreactivos, que reaccionan con uno o más antígenos compartidos por la órbita y la tiroides, una vez se reconoce el antígeno. Una cascada de eventos lleva a la secreción de citoquinas que estimulan la proliferación de fibroblastos. La diferenciación de pre-adipocitos en adipocitos y la secreción de GAG a partir de los fibroblastos, originando retención de agua y edema periocular (ver figura 2).
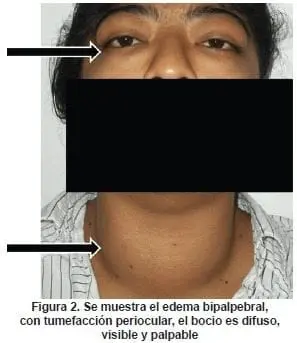
El incremento del contenido orbitario explica mecánicamente la mayor parte de las manifestaciones clínicas de la GO (38).
Durante el curso de la GO:
La enfermedad pasa por varias fases. Desde un comienzo, se puede documentar un empeoramiento de los signos y síntomas en la fase inflamatoria. Las fases del empeoramiento gradual en el proceso inflamatorio pueden progresar hasta originar anomalías permanentes en la función y en la apariencia.
La “actividad” de la enfermedad ocular se refiere a la presencia de inflamación, mientras que “severidad” describe el grado de déficit funcional o cosmético en cualquier grado. Es importante determinar la fase presente en GO para poder determinar el tratamiento apropiado, ya que la terapia inmunomoduladora puede ser efectiva mientras exista inflamación activa (27,39). Existen varias clasificaciones y puntajes que intentan clasificar adecuadamente la “actividad” y la “severidad” de la enfermedad ocular en EGB.
La mayoría evalúa varios aspectos y se conoce con el epónimo VISA:
Visión (cuyo objetivo principal es excluir la presencia de neuropatía óptica).
Inflamación (incluye aspectos como dolor, enrojecimiento, hinchazón, y compromiso de la función visual).
Estrabismo: (Por la presencia de diplopía.)
Apariencia/exposición: (La apariencia evalúa la presencia de retracción palpebral, proptosis, piel redundante y prolapso de grasa. La exposición evalúa la presencia de opacificación y ulceración corneal).
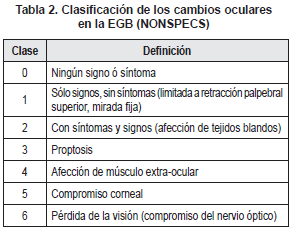
Los signos oculares de la EGB se han descrito por medio de una clasificación conocida con el epónimo NONSPECS. La cual describe la extensión de la enfermedad ocular, basada en la presencia específica de signos y síntomas oculares, pero no es útil para vigilar el proceso de la enfermedad, puesto que, una clase en particular no necesariamente progresa hacia la siguiente. Es decir, asume unas categorías en sus características clínicas que no siempre están presentes (Ver tabla 2).
La historia natural de la GO es la de un deterioro rápido, seguido de una mejoría gradual en el tiempo.
La fase activa se describe de buena manera por medio del puntaje ó Score de Actividad Clínica (CAS), el cual se genera por la adición de un punto por cada una de las características clínicas presentes (descritas en la tabla 3).
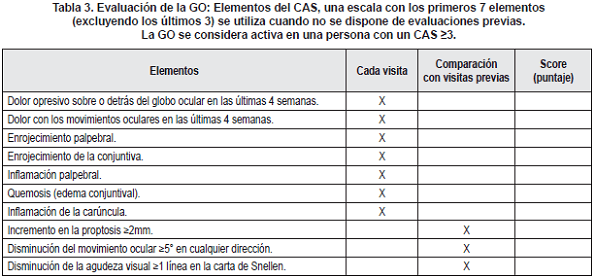
El score va de un rango de 0 a 10 y predice la respuesta a las terapias anti-inflamatorias. Una escala de siete puntos obvia los últimos tres elementos del score original, y se utiliza cuando no hay disponibilidad de evaluaciones previas.
De esta forma, la GO se considera activa cuando existe un puntaje ≥3. Por lo que, aquellos pacientes hipertiroideos que se manifiestan únicamente con retracción palpebral, o en conjunto con eritema conjuntival leve y edema palpebral, no son considerados con GO activa (40,41).
La severidad de la enfermedad se evalúa mejor utilizando parámetros objetivos y cuantificables, los cuales son útiles para direccionar la terapia:
Los elementos a tener en cuenta al evaluar la severidad se resume en el Consenso del Grupo Europeo de Orbitopatía de Graves (EUGOGO), ver tabla 4.
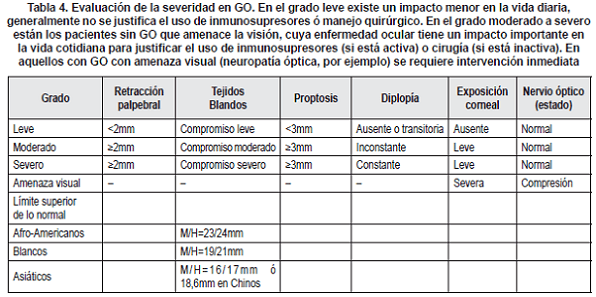
Las imágenes diagnósticas en la OG se centran en la Ultrasonografía, la Tomografía Axial Computadorizada (TAC) y la Resonancia Nuclear Magnética (RNM). La ultrasonografía es un método no invasivo válido para descartar la presencia de tumores orbitarios y para evaluar la ecogenicidad interna de los músculos extra oculares y la grasa orbitarias. Puede detectarse un engrosamiento en la parte ventral del músculo, mientras que la inserción escleral apenas se modifica.
La principal ventaja de la ultrasonografía modo- A es que es una técnica no invasiva y accesible. No obstante, no es tan efectiva como la TAC en la evaluación del tercio posterior de la órbita, por la pérdida de respuesta ecogénica que se va produciendo a través de los tejidos (atenuación), así como su difícil acceso para evaluar el músculo recto inferior (el más frecuentemente afectado) y por su escasa reproducibilidad.
Las imágenes ultrasonográficas de la OG con componente muscular muestran un engrosamiento marcado de los músculos rectos inferiores, internos y superiores y del elevador del párpado, y con menor frecuencia la de los músculos oblicuos y rectos laterales (42,43).
La TAC y la ecografía son técnicas complementarias, al considerarse la TAC hay que tener en cuenta que la grasa orbitaria tiene densidad negativa, mientras que los músculos y el nervio óptico tienen densidad positiva. Por lo tanto, no es necesario utilizar habitualmente medios de contraste en la exploración de la OG, ya que la aplicación del mismo sólo será capaz de mostrar hipervascularización muscular.
Los hallazgos característicos en la TAC en OG son:
Exoftalmos, engrosamiento del vientre muscular, compresión del nervio óptico a nivel del vértice orbitario por músculos engrosados que originan neuropatía, abombamiento óseo de las paredes etmoidales, imágenes pseudotumorales en el tercio posterior de la órbita producidas por el músculo recto inferior engrosado. En los cortes axiales puede encontrarse un incremento en el volumen de la grasa e imágenes de atrofia dentro del músculo.
Las indicaciones de solicitud de TAC en OG dependen del juicio clínico, de la actividad y de la severidad de la enfermedad, así como en el proceso de toma de decisiones para el manejo farmacológico y/o quirúrgico.
Las imágenes de Resonancia Nuclear Magnética (RNM) no presentan ventajas importantes frente a la TAC para el diagnóstico de OG, aunque permite diferenciar entre edema y fibrosis, debido al alto contenido de agua de los tejidos que se diferencian de mejor manera en la RNM. Se considera, asimismo, que la RMN presenta mayor sensibilidad para el diagnóstico en las fases inactivas de la enfermedad. Entre sus ventajas están la ausencia de radiación ionizante y la capacidad para delimitar estructuras orbitarias.
Sus principales desventajas son el elevado coste, así como una menor disponibilidad y la mala calidad de imágenes para el estudio de la pared ósea etmoidal, ya que la RNM no define de buena forma el hueso (43,44).
Las aproximaciones terapéuticas actuales para GO incluyen, medidas locales, glucocorticoides, radiación a la órbita y cirugía. Independiente de las opciones de manejo, el mayor esfuerzo debe dirigirse en lo posible, a la prevención y a evitar el deterioro progresivo de la enfermedad.
Los principales factores de riesgo para GO son:
Uso previo de yodo radioactivo (como terapia para hipertiroidismo), tabaquismo, títulos elevados de anti-TSHr, títulos elevados de T3 previos al tratamiento e hipotiroidismo descontrolado posterior al manejo con yodo radioactivo.
Siempre debe mantenerse el estado “eutiroideo” en todo paciente con EGB y GO o con factores de riesgo para presentar GO.
En aquellos pacientes con EGB que no tienen GO clínicamente aparente, el manejo de su hipertiroidismo de base puede realizarse con cualquiera de las modalidades universales de manejo para EGB previamente descritas.
Debe tenerse en cuenta que, el tabaquismo es el factor de riesgo modificable más importante para el desarrollo de GO, por lo que se prohíbe la exposición al mismo desde el momento del diagnóstico.
Aquellos pacientes que se manifiestan con GO con actividad leve, sin otros factores de riesgo, en los que se ha determinado que el tratamiento de su hipertiroidismo de base se realizará con yodo radioactivo, debe considerarse el uso de glucocorticoides. De igual forma. Aquellos con GO leve y tabaquismo u otros factores de riesgo asociados, también debe considerarse el uso concomitante de glucocorticoides si van a recibir manejo con yodo radioactivo.
Aquellos pacientes con EGB y GO moderada-severa, el hipertiroidismo debe ser manejado con MTZ o cirugía. Ahora bien, en personas con oftalmopatía inactiva el manejo del hipertiroidismo puede realizarse con Tionamidas, yodo radioactivo ó cirugía, sin necesidad de adicionar glucocorticoides (27,45).
El tratamiento del hipertiroidismo con Tionamidas tiene un efecto neutro sobre la progresión de la GO, aunque tiene un efecto indirecto positivo sobre la disminución gradual del anti-TSHr.
Por otra parte:
El yodo radioactivo se asocia con el empeoramiento y la progresión de la GO, mientras que la cirugía tiene un efecto neutro o de mejoría leve sobre la progresión de la GO.
Aquellos pacientes con GO activa leve, se recomienda una estrategia de “observar-esperar” en donde el uso sistemático de glucocorticoides no es aceptado, excepto para aquellos pacientes que serán sometidos a manejo con yodo radioactivo.
En la GO inactiva leve, la cirugía de rehabilitación con un propósito cosmético o por razones funcionales (descompresión de la órbita por exoftalmos, retracción palpebral) puede ser requerida.
En este estado el uso de glucocorticoides no está indicado, ya que no son efectivos, de hecho. La profilaxis con tales medicamentos no está indicada si no existen otros factores de riesgo para el desarrollo de GO inducida por el uso de yodo radioactivo.
En la GO moderada-severa, la elección del tratamiento puede ser controversial, dichos pacientes deben recibir manejo inmediato para su GO. Los glucocorticoides son los medicamentos de elección, preferiblemente por vía endovenosa, con o sin radioterapia dirigida a la órbita.
Todos los pacientes en esta categoría deben estar en estado eutiroideo como requisito para su evolución favorable en el manejo de la GO.
En los pacientes con GO moderada-severa inactiva, el tratamiento de base de su hipertiroidismo se establece de acuerdo a los criterios individuales del paciente comprometido.
Si se decide el uso de yodo radioactivo, el manejo con glucocorticoides sólo debe iniciarse ante la presencia de factores de riesgo para GO, particularmente en los que tienen antecedentes de tabaquismo.
En aquellas personas con GO que amenaza la visión:
Deben enfocarse como una emergencia endocrina, y se debe iniciar de manera urgente glucocorticoides por vía endovenosa en dosis altas, con descompresión orbitaria subsecuente si la respuesta a los glucocorticoides es pobre (42,46).
Varios esquemas con dosis variables de glucocorticoides endovenosos han sido utilizados, la tasa de respuesta puede ser del 63-77% y existe mayor eficacia con el uso del glucocorticoide endovenoso (metilprednisolona) respecto al fármaco por vía oral. La dosis acumulativa del glucocorticoide endovenoso no debe ser mayor a 6-8 gramos en un lapso de tiempo de 6-16 semanas.
El uso de Ciclosporina, de bloqueadores del TNF-α (Etanercept) y de inmunoglobulina endovenosa, al igual que el uso de anticuerpos monoclonales anti-CD20 como el Rituximab. Pueden afectar positivamente los mecanismos patogénicos de la GO, al modular la gran carga inmunológica de la enfermedad. Sin embargo, hasta el momento no existen recomendaciones definitivas para su uso en GO (35,42).
La radioterapia retrobulbar puede ser una alternativa al manejo de la GO moderada-severa, con beneficio significativo sobre la movilidad ocular y la diplopía.
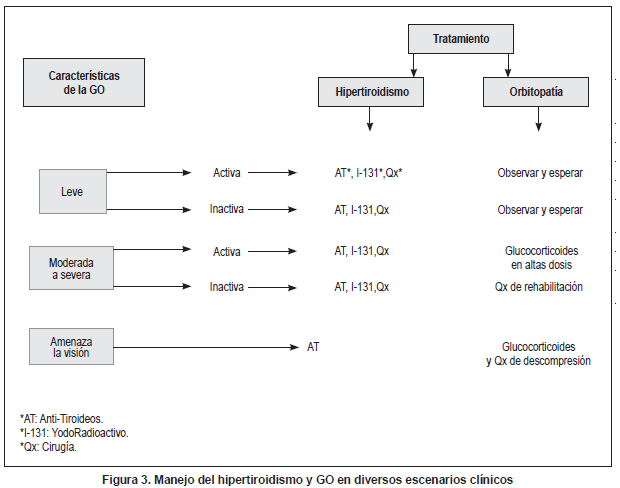
Usualmente se utilizan dosis bajas como 1 Gy por semana (comparada con 1 ó 2 Gy día) las cuales muestran igual eficacia en pacientes con GO moderada-severa. Aquellos con diabetes mellitus e hipertensión arterial, tienencontraindicación relativa a tal procedimiento por el alto riesgo de retinopatía posradioterapia (47,48). Una aproximación al manejo del hipertiroidismo y GO en diferentes escenarios clínicos se muestra en la figura 3.
Mixedema pretibial:
El mixedema localizado, o dermopatía tiroidea (DT), es una manifestación infrecuente de la EGB, su característica clínica principal es el engrosamiento localizado de la piel, localizado especialmente en el área pretibial –de ahí que sea más conocido como mixedema pretibial–.
La característica histológica principal es la acumulación de GAG en la dermis reticular, con una exagerada concentración de ácido hialurónico, lo cual ocurre como consecuencia de la estimulación de fibroblastos, aunque el motivo de su estimulación y su origen autoinmune no es totalmente entendido, en especial el por qué afecta casi predominantemente el área pretibial, quizás por la estasis venosa y la mayor probabilidad de micro traumas en miembros inferiores induce un mayor depósito de mucina, o bien porque los fibroblastos de la economía corporal tienen diversos patrones de mecanismos de regulación, otra opción es el edema local, que puede aumentar la secreción de citoquinas que empeoran la concentración de GAG (49).
Varias modalidades terapéuticas han sido empleadas, desde vendas compresivas y aplicaciones tópicas de esteroides hasta terapia sistémica con esteroides y aplicaciones intradérmicas.
La DT puede tener característicamente cuatro formas de presentación:
- La forma edematosa, indurada, sin fóvea, que se acompaña con cambios en la coloración de la piel.
- La forma de presentación en “placas”.
- La forma nodular.
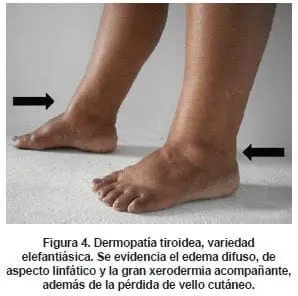
- La forma elefantiásica.
El tratamiento de la DT es sintomático; en general, la forma edematosa y en placas puede serleve y no molesta para el paciente, la mayor partede las veces no requiere tratamiento, pero cuando se decide manejo específico, el uso de esteroides tópicos es suficiente (50,51).
Las formas nodular y elefantiásica responden al manejo con vendas compresivas nocturnas (en sitios de afección en el área del tobillo o rodilla, las vendas deportivas, con una presión de compresión de 20-40 mm Hg pueden ser útiles (ver figura 4); en otras áreas de presentación, el uso de vendas de compresión media ayudan al manejo) y los esteroides tópicos (por ejemplo, acetato de triamcinolona al 0.05-0,1% en crema (52,53).

El acetónido de fluocinolona y el propionato de clobetasol:
También se han utilizado en algunos protocolos) con una frecuencia de aplicación de tres veces al día, acompañado de un vendaje suave con papel plástico en el área afectada, en protocolos de seguimiento entre 4-8 semanas tienen buena respuesta, con mejoría notoria en los hallazgos cutáneos de la DT (en casos selectos, la terapia con dicho protocolo puede mantenerse durante otras semanas, incluso meses, teniendo en cuenta que, al prolongar la terapia se corre el riesgo de presentar telangiectasias, equimosis y atrofia cutánea).
El uso de esteroides intralesión puede causar degeneración nodular de la piel debido a la atrofia del tejido graso cuando se utilizan agujas estándar, aunque es probable que el uso de agujas de menor calibre (como las utilizadas en “mesoterapia”) no origine los resultados desfavorables descritos con las agujas normales; en general, el uso de esteroides intra-lesión y los sistémicos van perdiendo más adeptos cada día, tanto por los resultados desfavorables, como por el impacto local y sistémico de los mismos; el uso de terapias inmunomoduladoras como octreótide,azatioprina y ciclosporina, entre otros, no tienen aún una evidencia real que apoye su utilización.
La cirugía para DT es poco utilizada, de hecho el trauma quirúrgico predispone a la recurrencia de la misma, por lo que sólo para casos con presentaciones estéticamente “inaceptables” podría estar indicada, junto al uso de terapia tópica con esteroides (54,55).
Como decíamos, los temas de fisiopatología y diagnóstico han sido materia de otro artículo (56).
Referencias
- 1. Cooper DS. Antithyroid Drugs. N Engl J Med. 2005; 352:905-917.
- 2. Nygaard B. Hyperthyroidism (primary). ClinEvid (Online). 2010 Jul 19; 2010. pii: 0611.
- 3. Abraham P, Acharya S. Current and emerging treatment options for Graves’ Hyperthyroidism. Therap Clin Risk Manag. 2010; 6:29-40.
- 4. Bartalena L, Tanda ML, Bogazzi F, Piantanida E, Lai A, Martino E. An update on the pharmacological management of hyperthyroidism due to Graves’ disease. Expert Opin Pharmacother. 2005; 6:851-861.
- 5. Abraham P, Avenell A, McGeoch SC, Clark LF, Bevan JS. Antithyroid drug regimen for treating Graves’ hyperthyroidism. Cochrane Database of Systematic Reviews 2010, Issue 1. Art. No.: CD003420. DOI: 10.1002/14651858.CD003420.pub4.
- 6. Iagaru A, McDougall IR. Treatment of Thyrotoxicosis. J Nucl Med. 2007; 48:379-389.
- 7. Andre`s E, Maloisel F, Zimmer J. The role of haematopoietic growth factors granulocyte colony-stimulating factor and granulocyte-macrophage colony-stimulating factor in the management of drug-induced agranulocytosis. Brit J Haematol. 2010; 150:3-8.
- 8. Watanabe N,Narimatsu H, Noh JY, Yamaguchi T, Kobayashi K, Kami M, Kunii Y,Mukasa K, Ito K, Ito K. Antithyroid Drug-Induced Hematopoietic Damage: A Retrospective Cohort Study of Agranulocytosis and Pancytopenia Involving 50,385 Patients with Graves’ Disease. J Clin Endocrinol Metab. 2012; 97:E49-E53.
- 9. Sun MT, Tsai CH, Shih KC. Antithyroid drug-induced agranulocytosis. J Chin Med Assoc. 2009; 72:438-441.
- 10. Nwatsock JF, Taieb D, Tessonnier L, Mancini J, Dong- A-Zok F, Mundler O. Radioiodine thyroid ablation in Grave’s Hyperthyroidism: Merits and pitfalls. World J Nucl Med. 2012; 11:7-11.
Otras Referencias
- 11. Ross DS. Radioiodine Therapy for Hyperthyroidism. N Engl J Med 2011; 364:542-550.
- 12. Jarløv AE, Hegedüs L, Kristensen LO, Nygaard B, Hansen JM. Is calculation of the dose in radioiodine therapy of hyperthyroidism worthwhile? Clin Endocrinol (Oxf). 1995; 43:325-329.
- 13. Van Isselt JW, de Klerk JMH, Lips CJM. Radioiodine treatment of hyperthyroidism: fixed or calculated doses; intelligent design or science? Eur J Nucl Med Mol Imaging. 2007; 34:1883-1884.
- 14. Howarth D, Epstein M, Lan L, Tan P, Booker J. Determination of the optimal minimum radioiodine dose in patients with Graves’ disease: a clinical outcome study. Eur J Nucl Med 2001; 28:1489-1495.
- 15. Grosso M, Traino A, Boni G, Banti E, Della Porta M, Manca G, et al. Comparison of different thyroid committed doses in radioiodine therapy for Graves’ hyperthyroidism. Cancer Biother Radiopharm. 2005; 20:218-223.
- 16. Oszukowska L, Knapska-Kucharska M, Lewiski A. Effects of drugs on the efficacy of radioiodine (131I) therapy in hyperthyroid patients. Arch Med Sci. 2010; 6(1):4-10.
- 17. deRooij A, Vandenbroucke JP, Smit JWA, Stokkel MPM, Dekkers OM. Clinical outcomes after estimated versus calculated activity of radioiodine for the treatment of hyperthyroidism: systematic review and meta-analysis. European Journal of Endocrinology. 2009; 161:771-777.
- 18. Bonnema SJ, Hegedüs L. Radioiodine therapy in benign thyroid diseases: effects, side effects, and factors affecting therapeutic outcome. Endocr Rev. 2012; 33(6):920-980.
- 19. Metso S, Auvinen A, Huhtala H, Salmi J, Oksala H, Jaatinen P. Increased Cancer Incidence After Radioiodine Treatment for Hyperthyroidism.CANCER. 2007;109(10):1972-1979.
- 20. Angusti T, Codegone A, Pellerito R, Favero A. Thyroid cancer prevalence after radioiodine treatment of hyperthyroidism. J Nucl Med.2000; 41:1006-1009.
Bibliografías
- 21. Thyroid Function after Subtotal Thyroidectomy in Patients with Graves’ Hyperthyroidism. E. J. Limonard EJ, Bisschop PH, Fliers E, Nieveen van Dijkum EJ. Scient World J. Volume 2012, Article ID 548796, doi:10.1100/2012/548796.
- 22. Palit TK, Miller CC 3rd, Miltenburg DM. The efficacy of thyroidectomy for Graves’ disease: A meta-analysis. J Surg Res. 2000; 90:161-165.
- 23. Kaplan EL, Angelos P. Surgery of the Thyroid Gland. Thyroid Disease Manager. Available at: www.thyroidmanager. org/Chapter21/21-frame.htm.
- 24. Stalberg P, Svensson A, Hessman O, Akerstrom GA, Hellman P, “Surgical treatment of Graves’ disease: evidence based approach,” World J Surg.2008;32(7):1269-1277.
- 25. Sugino K, Ito K, Nagahama M, Kitagawa W, ShibuyaH, Ito K. “Surgical management of Graves’ disease— 10-year prospective trial at a single institution,” Endocrine Journal. 2008; 55(1):161-167.
- 26. Lal G, Ituarte P, Kebebew E, Siperstein A, Duh QY, Clark OH, “Should total thyroidectomy become the preferred procedure for surgical management of Graves’ Disease?” Thyroid.2005; 15(6):569-574.
- 27. Bahn RS, Burch HB, Cooper DS, Garber JR, Greenlee MC, Klein I, et al. “Hyperthyroidism and other causes of thyrotoxicosis: management guidelines of the American Thyroid Association and American Association of Clinical Endocrinologists”. Thyroid.2011; 21(6):593-646.
- 28. Genovese BM, Noureldine SI, Gleeson EM, TufanoRP, Kandil E. What is the best definitive treatment for Graves’ disease? A systematic review of the existing literature. Ann Surg Oncol. 2012 DOI 10.1245/ s10434-012-2606-x.
- 29. Marx H, Amin P, Lazarus JH. PREGNANCY PLUS. Hyperthyroidism and pregnancy. Brit Med J. 2008; 336: 663-667.
- 30. Laurberg P, Bournaud C, Karmisholt J, Orgiazzi J. Management of Graves’ hyperthyroidism in pregnancy: focus on both maternal and foetal thyroid function, and caution against surgical thyroidectomy in pregnancy. Europ J Endocrinol. 2009;160:1-8.
Otras Bibliografías
- 31. Abalovich M, Amino N, Barbour LA, Cobin RH, DeGroot LJ, Glinoer D, et al. Management of thyroid dysfunction during pregnancy and postpartum: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab.2007; 92(8) Suppl: S1-47.
- 32. Chan GW, Mandel SJ. Therapy insight: management of Graves’ disease during pregnancy. Nat Clin Pract Endocrinol Metab.2007; 3:470-478.
- 33. Luton D, Le Gac I, Vuillard E, Castanet M, Guibourdenche J, Noel M, et al. Management of Graves’ Disease during Pregnancy: The Key Role of Fetal Thyroid Gland Monitoring. J Clin Endocrinol Metab.2005; 90:6093-6098.
- 34. Bahn RS. Graves’ ophthalmopathy. New Engl J Med.2010; 362:726-738.
- 35. Soeters MR, van Zeijl CJJ, BoelenA, Kloos R, Saeed P, Vriesendorp TM, Mourits P. Optimal management of Graves’s orbitopathy: a multidisciplinary approach. Netherl J Med. 2011; 69(7/8):302-308.
- 36. Regensburg NI, Wiersinga WM, Berendschot TT, Potgieser P, Mourits MP. Do subtypes of Graves’ orbitopathy exist? Ophthalmol. 2011; 118(1):191-196.
- 37. Khalilzadeh O, Noshad S, Rashidi A, Amirzargar A. Graves’ ophthalmopathy: a review of immunogenetics. Curr Genomics. 2011; 12(8):564-575.
- 38. Maheshwari R, Weis E. Thyroid associated orbitopathy. Indian J Ophthalmol. 2012; 60(2):87-93.
- 39. Bartalena L, Pinchera A, Marcocci C. Management of Graves’ ophthalmopathy: Reality and perspectives. Endocr Rev. 2000; 21:168-199.
- 40. Bartalena L. Prevention of Graves’ ophthalmopathy. Best Pract Res Clin Endocrinol Metab. 2012; 26(3):371-379.
Lecturas Recomendadas
- 41. Hegedüs L, Bonnema SJ, Smith TJ, Brix TH. Treating the thyroid in the presence of Graves’ ophthalmopathy. Best Pract Res Clin Endocrinol Metab. 2012 26(3):313-324.
- 42. Marcocci C, Marinò M. Treatment of mild, moderateto- severe and very severe Graves’ orbitopathy. Best Pract Res Clin Endocrinol Metab. 2012; 26(3):325-337.
- 43. Müller-Forell W, Kahaly GJ. Neuroimaging of Graves’ orbitopathy. Best Pract Res Clin Endocrinol Metab. 2012; 26(3):259-271.
- 44. Kirsch E, Hammer B, von Arx G. Graves’ orbitopathy: current imaging procedures.Swiss Med Wkly. 2009; 139(43/44):618-623.
- 45. Yang M, PerrosP. Management plan and delivery of care in Graves’ ophthalmopathy patients. Best Pract Res Clin Endocrinol Metab. 2012; 26(3):303-311.
- 46. Dolman PJ. Evaluating Graves’ orbitopathy. Best Pract Res Clin Endocrinol Metab. 2012 Jun; 26(3):229-248.
- 47. Rajendram R, Bunce C, Lee RW, Morley AM. Orbital radiotherapy for adult thyroid eye disease. Cochrane Database Syst Rev. 2012 Jul 11; 7:CD007114. doi: 10.1002/14651858.CD007114.pub2.
- 48. Sabih DE, Inayatullah M. Managing thyroid dysfunction in selected special situations. Thyroid Res. 2013; 6:2 doi: 10.1186/1756-6614-6-2.
- 49. Li H, Want T. The autoimmunity in Graves’disease. Front Biosci.2013; 1(18):782-787.
Otras Lecturas Recomendadas
- 50. Fatourechi V, Pajouhi M, Fransway AF. Dermopathy of Graves disease (pretibial myxedema). Review of 150 cases. Medicine (Baltimore) 1994; 73:1-7.
- 51. Fatourechi V. Thyroid dermopathy and acropachy. Best Pract Res Clin Endocrinol Metab. 2012; 26(4):553-565.
- 52. Fatourechi V. options. Am J Clin Dermatol. 2005; 6(5):295-309.
- 53. Reddy SV, Gupta SK, Jain M. Dermopathy of Graves’ disease: Clinico-pathological correlation. Indian Med J 2012; 16(3):460-462.
- 54. Vannucchi G, Campi I, Covelli D, Forzenigo L, Beck- Peccoz P, Salvi M. Treatment of pretibial myxedema with dexamethasone injected subcutaneously by mesotherapy needles. Thyroid. 2013 Feb 11. [Epubahead of print].
- 55. Schwartz KM, Fatourechi V, Ahmed DD, Pond GR. Dermopathy of Graves’ disease (Pretibial myxedema): Long-term outcome. J Clin Endocrinol Metab. 2002; 87:438-446.
- 56. Vargas-Uricoechea H, Sierra-Torres CH, Meza-Cabrera I: Enfermedad de Graves Basedow, Fisiopatología y Diagnóstico. Medicina 2013; 35(1): 41-66.
Dirección para correspondencia:
Hernando Vargas U.
hernandovargasu10@yahoo.com