Matriz Extracelular
La matriz extracelular (MEC) actúa como un andamio físico para las células y como un repositorio para los factores de crecimiento. La MEC tiene propiedades físico-químicas que transmiten información precisa a las células que influyen profundamente en su biología, por interacciones con receptores de superficie celular denominados integrinas (47).
Durante la angiogénesis, la MEC perivascular desempeña un papel crítico en la determinación de las respuestas proliferativas, invasivas y la supervivencia de las células vasculares, guiada por los factores de crecimiento angiogénicos.
La interacción dinámica entre el citoesqueleto y la MEC, por contactos focales iniciados por la ligación de integrinas. Permiten que las vías de señalización reciban todos los factores de crecimiento necesarios para iniciar cascadas de procesos proliferativos y de supervivencia de las células vasculares (47).
Los complejos de unión permiten que las plaquetas circulantes tengan acceso directo a la lámina subyacente para estimular las células endoteliales (47).
La plaqueta se une a los sustratos del proceso que permiten activarla:
Para que conduzca la descarga de contenidos de sus gránulos alfa que incluyen una variedad de efectores moleculares que varían de proteasa / lipasas a componentes de la MEC y numerosos factores de angiogénesis como por ejemplo: el VEGF y el PDGF (factor de crecimiento derivado de plaquetas) o el S1P (esfingosina-1 fosfato) que se encargan de regular la MEC (48, 49).
La actividad de señalización de la angiogénesis por medio de receptores de tirosina quinasa específicos de angiogénesis depende de la participación de integrinas en la MEC (47). El repertorio de receptores en las células vasculares angiogénicas permite cambios durante la angiogénesis para mantener la interacción celular apropiada con la remodelación de la MEC.
Las primeras interacciones ocurren a través de integrinas preexistentes, tales como α vβ5, que se activan corriente abajo por factores de crecimiento y proceden a través de quinasas de la familia Src y Rho quinasa, que facilitan la retracción de las células endoteliales del proceso angiogénico con la liberación de complejos de unión (48, 49).
Los mecanismos de reparación de heridas cutáneas y VEGF
Los mecanismos de reparación de heridas cutáneas se ponen en funcionamiento tras una lesión que altera la continuidad de la superficie. En el proceso, se han identificado tres fases: la inflamatoria, la proliferativa y la de remodelación tisular.
Para resaltar al VEGF, se resumirá en el paso de la remodelación tisular que corresponde a la última fase. Cuando se desarrolla un tejido estable, similar al existente previo a la lesión, conocido como cicatriz (50).
Las primeras señales para el reclutamiento de los fibroblastos provienen de productos derivados de las plaquetas:
El factor de crecimiento derivado de las plaquetas (PDGF), el factor de crecimiento insulinoide (IGF-1) y el factor de crecimiento transformante beta TGF-β.
Los monocitos aparacen debido a la atracción que ejercen la fibronectina, la elastina, las quimiocinas, los factores de crecimiento, el IGF-1. El factor de crecimiento nervioso (NGF), TGF-β, la proteína quimio atrayente de macrófagos (MIP)-1α y el VEGF.
Los monocitos, con la anterior estimulación en los tejidos, se transforman en macrófagos y actúan removiendo detritus, partículas extrañas y bacterias al igual que los neutrófilos (50, 51).
El mantenimiento de los fibroblastos dentro de la herida se logra a través de señales paracrinas y autocrinas (50). Los macrófagos y los fibroblastos liberan numerosos factores de crecimiento y citocinas que contribuyen a la migración fibroblástica, como por ejemplo: el factor de crecimiento fibroblástico (FGF), IGF-1, (VEGF), IL-1, IL-2, IL-8, PDGF, TGF-a, TGF-b y TNF-a (51).
Su presencia predomina entre las 48 a 72 horas después y permanecen por semanas. Asimismo, participan de la última parte de la fase inflamatoria, regulando la llegada de otros monocitos y fibroblastos, liberando factores angiogénicos (proceso favorecido por la hipoxia local) y de crecimiento ((PDGF, FGF, VEGF), TGF-α y β). Los cuales son importantes para la migración y proliferación celular y la formación de la matriz extracelular (50).
Los fibroblastos que emigran desde el tejido circundante hasta los bordes de la herida son activados por el PDGF y el factor de crecimiento endotelial (EGF), proliferan y empiezan a sintetizar colágeno (51, 52).
El factor de crecimiento endotelial vascular (VEGF) permite generar la permeabilidad vascular para que los fibroblastos tengan las sustancias necesarias para sintetizar los componentes de la MEC (por ejemplo los colágenos).
Luego, la concentración de VEGF disminuye cuando no se necesita más vasos y la MEC se encuentra constituyendo un tejido de cicatrización estable (52, 53).
En la Figura 3, se observan:
- Los mecanismos de reparación de heridas cutáneas se ponen en funcionamiento tras una lesión que altera la continuidad de la superficie y se manifiesta en la fase inflamatoria. Para la curación de una herida, se requiere de nuevos vasos de forma que se logre la migración de células y nutrientes que efectúen la reparación.
- La fase proliferativa y la de remodelación tisular, involucran el proceso según el cual el VEGF promueve la angiogénesis en los procesos de inflamación crónica durante la cicatrización. Siendo secretado por muchas células del mesénquima y del estroma.
- La fase de remodelación tisular, involucra la conformación de tejido de cicatrización estable.
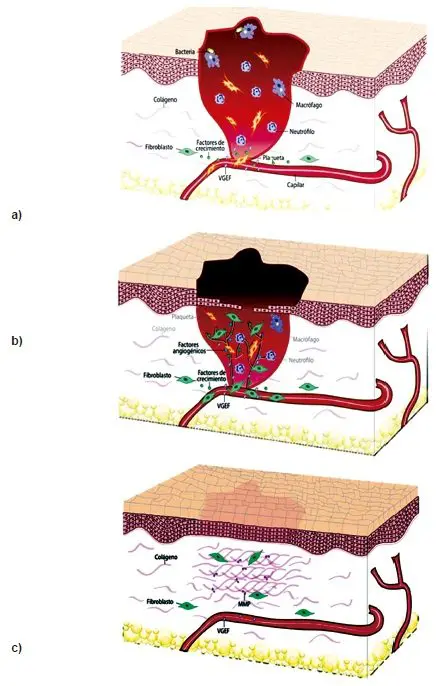
Figura 3. Fases de la cicatrización.
Las MMPs en el proceso de angiogénesis del crecimiento tumoral
Las células del tumor inducen angiogénesis en un proceso similar al de angiogénesis normal. El VEGF, Ang2, y FGF se encuentran implicados en la angiogénesis del tumor, pero en concentraciones más altas que en la angiogénesis de tejido normal.
También actúan otros factores que normalmente no están involucrados, como por ejemplo la interleuquina-8 (IL-8), que es una citoquina proinflamatoria. La sobrexpresión de IL-8 en el tumor estimula la producción de metaloproteinasas de matriz 2 (MMP- 2), que degradan la membrana basal, remodelan la matriz extracelular y facilitan la angiogénesis del tumor.
La presencia en el torrente sanguíneo de precursores de la célula endotelial CD34+ y de monocitos en áreas de angiogénesis en heridas y tumores. Sugiere la hipótesis de que estos precursores hematopoyéticos circulantes podrían contribuir en parte a la regulación de la angiogénesis (1).
En la Figura 4, se muestra cómo la matriz extracelular es degrada por metaloproteinasas que, liberadas y activadas por el tumor:
Tienen como objetivo propiciar el crecimiento tumoral, haciendo que las células liberen VEGF y otros factores de crecimiento angiogénico para que migren a las células endoteliales de los vasos más cercanos y que se expresen proteínas necesarias para la formación de nuevos vasos.
Eso facilita que luego se regenere la matriz extracelular para nutrir y sostener a los vasos nuevos que permitirán hacer metástasis y aumentar la malignidad del tumor.
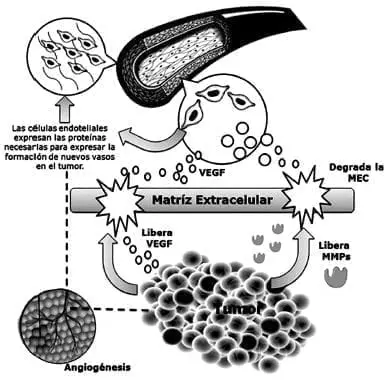 Figura 4. VEGF – en la angiogénesis tumoral.
Figura 4. VEGF – en la angiogénesis tumoral.
Las MMPs representan las principales mediadoras en las alteraciones observadas en el microambiente tumoral durante la progresión del cáncer (54).
Durante el crecimiento tumoral, desempeñan un rol fundamental que consiste en la degradación del tejido conectivo y los componentes de la membrana basal, además de activar los factores de crecimiento. Los receptores de superficie para moléculas de adhesión y las quimiocinas (55).
Esta interacción con los componentes de la MEC altera la respuesta celular al microambiente, eso permite que las células tumorales se tornen menos adherentes. Y, por lo tanto, expresan mayor probabilidad de migrar y producir metástasis (56).
Durante la carcinogénesis, las células tumorales interaccionan con factores de crecimiento, citoquinas y distintas células, como las células endoteliales, los fibroblastos, macrófagos, mastocitos y pericitos presentes en el microambiente tumoral (57).
La capacidad que tienen las células tumorales de migrar, invadir, metastatizar y formar sus propios vasos sanguíneos depende de estas interacciones (58).
La Figura 5 muestra los componentes de una típica cascada de señalización del VEGF.
Los mecanismos de la angiogénesis en el tumor, requieren de vasos adicionales para nutrir y permitir la metástasis, con un aumento en la liberación de proteínas y factores de crecimiento endotelial.
Los factores de crecimiento pueden ser hormonas o proteínas específicas (VEGF y entre otros factores de crecimiento), que son recibidos por células es pecíficas que interpretan las señales, las cuales a su vez simulan la proliferación celular.
Las vías de señalización patológica de la angiogénesis requieren de un receptor para VEGF y la producción de VEGF aumentada (el tumor libera diversos factores de crecimiento vascular incluyendo VEGF).
Cuando la proteína de VEGF se une al receptor (VEGF – 1), activan la vía por medio del uso de la MAP Kinasa que permite la expresión a nivel nuclear de MMP, interleuquinas y factores de crecimiento (el factor de transcripción está conformado por proteínas que se unen al ADN y facilitan la expresión de las moléculas implicadas en la proliferación celular). Para luego ser exportados a la matriz extracelular y desencadenar un procesos lítico con MMP.
Eso permite abrir el paso a los nuevos vasos y la migración de células precursoras endoteliales hasta el tumor, creando un aumento de intercambio de señales y sustancias para la conexión de los nuevos vasos.
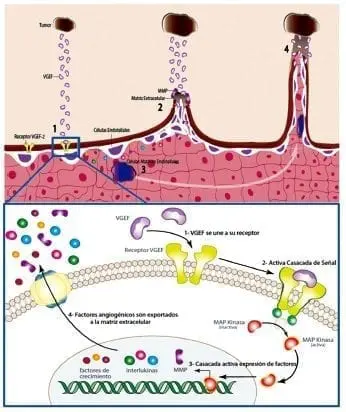 Figura 5. Componentes de una típica cascada de señalización del VEGF
Figura 5. Componentes de una típica cascada de señalización del VEGF
El VEGF controla la señalización y creación de las proteínas necesarias que deben liberar las células precursoras endoteliales al tumor para crear los nuevos vasos:
Aunque cabe recordar que el VEGF permite inhibir la acción de apoptosis en las células para no interrumpir la angiogénesis que requiere de tiempo y energía a nivel celular. Los nuevos vasos, cuando ya se han comunicado se integran al tumor y posibilitan la expansión tumoral (mitosis descontrolada).
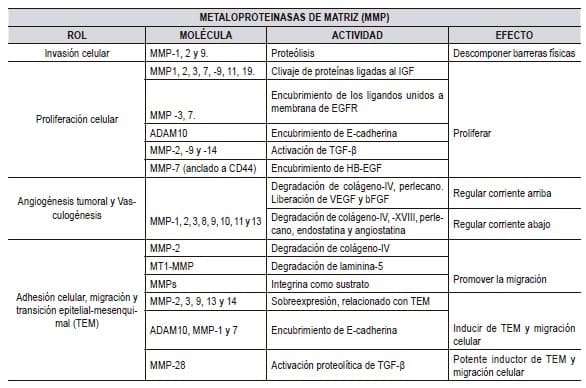
Las MMPs pueden asumir distintos papeles durante la progresión del cáncer dependiendo del estadio del tumor. La Tabla 2 refleja los estadios tempranos, la proteólisis mediada por MMP-3 y -7 de las proteínas específicas que involucran los factores de crecimiento contribuye a la proliferación celular. Posteriormente, el clivaje de las moléculas de adhesión E-cadherina y CD44 activa la motilidad de las células tumorales y facilita las metástasis (58).
El MMP-8, en cambio, ejerce un efecto protector disminuyendo el potencial metastásico de las células del cáncer de mama (59). La sobrexpresión de MMP-2 y -9 indica un pronóstico desfavorable al degradar el colágeno tipo IV localizado en las membranas basales e inducir la expresión de factores angiogénicos (60,61).
Las MMPs cumplen un rol complejo en la angiogénesis, promoviendo la migración de células endoteliales, liberando VEGF y otros factores proangiogénicos de la MEC como FGF-2 y TGFβ, que también estimulan la proliferación y migración de células endoteliales (62).
En modelos animales, se ha demostrado que las MMPs regulan la formación y maduración de nuevos vasos sanguíneos:
A través del control que ejercen sobre los factores de crecimiento y citoquinas que actúan en el reclutamiento de pericitos (63).
Sin embargo, algunas MMPs pueden tener un efecto inhibidor sobre la angiogénesis, por ejemplo, la hidrólisis del plasminógeno genera fragmentos de angiostatina (64) y la proteólisis del colágeno XVIII da origen a la endostatina (65).
Las MMPs no solo degradan la MEC y las membranas basales. Sus acciones son múltiples: modulan la angiogénesis, regulan el curso del proceso inflamatorio y facilitan el reclutamiento de células inflamatorias a través de su acción sobre quimiocinas y citoquinas (66).
Tabla 2. Las MMPs durante la progresión del cáncer