Factor de permeabilidad vascular (VPF)
El VEGF, también conocido como factor de permeabilidad vascular (VPF), es producido por muchos tipos de células incluyendo las células tumorales, los macrófagos, las plaquetas, los queratinocitos y las células mesangiales.
Desempeña un papel fundamental en las funciones fisiológicas normales, como la formación de hueso, la hematopoyesis, la cicatrización de heridas y el desarrollo de nuevos vasos (11, 12). Asimismo, estimula la supervivencia de las células endoteliales, su proliferación y motilidad, iniciando la gemación de nuevos capilares.
Miembros de la familia VEGF
Los miembros de la familia VEGF incluyen proteínas homodiméricas VEGF-A, VEGF-B, VEGF-C, VEGF-D. Realizan su función en las células diana a través de tres receptores con actividad tirosina kinasa intrínseca: VEGFR-1, VEGFR-2 y VEGFR-3, localizados en células endoteliales y en otros tipos celulares (19).
Adicionalmente, el VEGF-A regula la angiogénesis y la permeabilidad vascular mediante la activación de dos receptores el VEGFR- 1 y VEGFR- 2. Ambos poseen siete dominios de inmunoglobulinas como dominios extracelulares, una región transmembrana y una secuencia tirosina quinasa que se interrumpe por una quinasa insertada en el dominio (6, 20).
En la misma línea, el VEGFR-1 se expresa preferentemente dentro de la placenta, los trofoblastos situados entre el sistema de los vasos sanguíneos fetales y los maternos.
Por lo tanto, se podría considerar como una barrera bioquímica entre la circulación fetal y materna en la placenta mediante la supresión del exceso de la angiogénesis y la permeabilidad vascular anormal (6).
Mientras que, el VEGFR-2, más frecuente, participa de manera crucial en la angiogénesis durante el desarrollo y la hematopoyesis. Actuando como el mayor mediador de los efectos mitogénicos, angiogénicos y de aumento de la permeabilidad del VEGF (21). El VEGFR- 2 se somete a la dimerización y fosforilación de tirosina dependiente del ligando en células intactas y los resultados en una señal mitogénica, quimiotaxis y pro-supervivencia (20).
Finalmente, el VEGFR- 3 pertenece a la misma familia de las RTK (Receptor tirosina quinasa) y al receptor del VEGF-C y el VEGF-D. Se expresa en células endoteliales linfáticas y estimula el receptor de la linfangiogénesis (6, 20). (Véase la Figura 2).
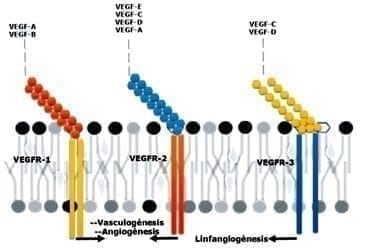 Figura 2. Esquema de compatibilidad de unión entre factores de crecimiento y sus receptores.
Figura 2. Esquema de compatibilidad de unión entre factores de crecimiento y sus receptores.
Efectores relacionados con el VEGF y la angiogénesis
Esta proteína desempeña un papel importante en la angiogénesis; entre los muchos factores implicados, el VEGF se ha identificado como uno de los más potentes y predominantes (18) (22). Como su nombre indica, estimula el crecimiento vascular endotelial celular, la supervivencia y la proliferación.
En los modelos preclínicos, el VEGF ha demostrado facilitar la supervivencia de los vasos existentes. Debido a que contribuye al desarrollo de anomalías vasculares (por ejemplo, tortuosidad e hiperpermeabilidad) que pueden impedir la entrega eficaz de compuestos antitumorales.
Se cree que los efectos angiogénicos de la familia VEGF son mediados principalmente a través de la interacción del VEGF con el VEGFR-2 (23).
También, estimula la permeabilidad vascular en los vasos sanguíneos pequeños (18), promoviendo la fuga vascular con mecanismos de fosforilación de la tirosina de la E-cadherina y β-catenina (24, 25). Las uniones intercelulares, permiten la interacción directa con la célula endotelial vascular, por medio de la unión de complejos de proteínas.
Ese proceso permite crear una barrera que es regulada en parte por la estabilidad de adherencias celulares tales como la E-cadherina, β-catenina, p120-catenina y la α-catenina. Sustancias que se encuentran implicadas críticamente en el control de la permeabilidad vascular (26).
En la misma línea, el VEGF también promueve la pérdida de esta barrera por la compleja interacción entre los receptores:
Para los factores de crecimiento angiogénicos que integran las integrinas y las cadherinas permitiendo la fuga de proteínas plasmáticas y la formación de un gel de fibrina extravascular. Esto proporciona un ambiente adecuado para el crecimiento de las células endoteliales.
De ese modo, en los tumores, la presencia de altos niveles de VEGF genera que los vasos sean excesivamente permeables y porosos. Hecho que aumenta la presión intersticial dentro del tumor y la entrega irregular de nutrientes y oxígeno a este (25, 27).
Por otra parte, el VEGF también representa un factor de supervivencia para las células endoteliales, tanto in vitro como in vivo (23, 28). In vitro, el VEGF previene la apoptosis endotelial inducida por la privación de suero. Además, el VEGF produce la expresión de las proteínas antiapoptóticas Bcl-2 (el protooncogén Bcl-2 (B-cell lymphoma 2), A1, XIAP y survivina en las células endoteliales. In vivo, los efectos pro-supervivencia de VEGF se encuentran regulados por el desarrollo (23).
Adicionalmente, la tensión de oxígeno desempeña un papel importante en la regulación de la expresión de una variedad de genes (29). La expresión de VEGF es inducida por la exposición baja de presión de O2 en una variedad de circunstancias fisiopatológicas (23). Así pues, la hipoxia constituye el principal factor desencadenante de la angiogénesis.
Ésta induce un incremento del factor inducible por la hipoxia (HIF-1) en la célula, que en el núcleo promueve la transcripción de diversos genes. Entre los que se encuentran dos potentes factores angiogénicos como: el (VEGF) y el factor de crecimiento endotelial derivado de las plaquetas (PD-ECGF). La unión de estos factores a los receptores de las células endoteliales estimula la fosforilación de distintas proteínas, activándose así las señales de supervivencia para estas células (30).
No obstante, aunque la hipoxia regula la expresión de muchos genes, los mecanismos implicados son poco conocidos.
El estudio sobre la actividad del HIF-1 ha demostrado que aumenta la expresión de eritropoyetina (EPO) en respuesta a la hipoxia. Y, más recientemente, los sitios de unión de HIF-1 se han identificado en los genes que codifican una serie de enzimas glucolíticas. Sin embargo, los mecanismos moleculares por los que la hipoxia regula la expresión de VEGF aún se desconocen (31- 33).
En ese contexto, se sabe que el VEGF se halla presente en todo el ciclo de vida del tumor. A medida que se desarrolla, puede empezar a activar las vías angiogénicas secundarias por medio de la fosforilación de receptores tipo tirosina quinasa.
La producción de VEGF se estimula mediante la aparición de flujos de señales externas e internas (en la membrana celular o nuclear), señales ambientales, factores de crecimiento, oncogenes, citoquinas y hormonas.
Este proceso es incitado por moléculas como el factor de crecimiento de fibroblastos básico (bFGF), (TGFβ). El factor de crecimiento placentario (PlGF), y el factor de crecimiento de las células endoteliales derivado de plaquetas (PD- ECGF). Como estas vías secundarias emergen, el VEGF continúa siendo expresado, por lo que se reconoce como uno de los mediadores críticos de la angiogénesis (22, 34, 35).
Finalmente, el factor de necrosis tumoral alfa (TNF-a) constituye una citocina inflamatoria con un amplio espectro de actividad biológica. Incluyendo la angiogénesis e influye en la formación de nuevos vasos indirectamente. Por otra parte, se ha demostrado que el TNF-α también aumenta la transcripción del gen VEGFR-2 en células endoteliales (36, 37).
Los procesos de señalización intracelular por estimulación con VEGF
Las propiedades citoprotectoras del VEGF exógeno sobre las células endoteliales (CE) descritas hasta ahora incluyen la expresión de las proteínas antiapoptóticas Bcl-2 y survivina, la prostaciclina, la producción de óxido nítrico (NO) y el papel de la vía PIK3K/Akt.
La proteína antiapoptótica (B-cell lymphoma 2) Bcl-2 regula la apertura del poro mitocondrial de permeabilidad transitoria inhibiendo la salida del citocromo C al citosol.
La proteína Akt inhibe la apoptosis a través de su interacción con las caspasas, el Akt ejerce la regulación del NFKB (nuclear factor-kappa B) y la actividad inhibitoria del p38MAPK (modulador del programa proapoptótico en células endoteliales) permite que las células tumorales expresen inmortalidad para lograr cumplir su objetivo de desarrollar la metástasis, al hacer procesos de expansión por medio de la angiogénesis.
A su vez, el Akt es el responsable, en parte, de la producción de NO por VEGF, a través de la fosforilación en Ser/Tre de la NO sintasa endotelial (eNOS) (38, 39).
Adicionalmente, la Fosfoinositol 3-quinasa (PI3k) genera una fosforilación del Akt. El Akt tiene una distribución citoplásmica, pero su fosforilación provoca un reclutamiento hacia la membrana celular. De esta forma, queda expuesto un dominio quinasa que se encontraba oculto en su forma inactiva.
Este dominio quinasa de Akt en la membrana se activa mediante dos proteinquinasas de membranas que son la PDK 1 y 2 (40).
De este modo, el Akt vuelve al citoplasma en su forma activa y ejerce la fosforilación de distintos efectores relacionados con la supervivencia celular, el aumento del metabolismo de la glucosa y la síntesis de las proteínas (38, 40).
La activación del Akt también puede producirse por una segunda vía, donde participan las integrinas que se conectan a los ligandos de la matriz extracelular.
Esto produce la activación de las quinasas, asociadas a las adhesiones focales (FAK) y, estas últimas, actúan sobre el Akt (19, 38).
Las adhesiones focales constituyen regiones concretas de la superficie celular en las que se concentran moléculas de adhesión al sustrato (sobre todo integrinas) y numerosas proteínas que conectan estas moléculas al citoesqueleto (19).
La participación de las angiopoyetinas en procesos de angiogénesis
La angiogénesis se encuentra regulada por el VEGF y por las angiopoyetinas que se unen a receptores específicos de las células endoteliales (41). Algunos estudios han determinado la ocurrencia de dos eventos que contribuyen a la adquisición de un fenotipo angiogénico en fases iniciales de la progresión tumoral: la hipoxia y el aumento en la expresión de la angiopoyetina-2 y -1.
La hipoxia representa uno de los reguladores fundamentales de los factores que controlan la angiogénesis (42- 44). En esa línea, la angiopoyetina-1 constituye un factor paracrino producido por células de soporte vascular (pericitos), que optimizan la interacción e integración entre estas células y el endotelio.
Adicionalmente, permite la formación de vasos poco permeables. Se une de forma específica a un receptor endotelial, el receptor Tie-2 (Tirosina quinasa y dominios homólogos a EGF), y promueve la supervivencia del endotelio y la estabilidad de los vasos.
Otro tipo de angiopoyetina, la angiopoyetina-2, puede activar o inhibir la Tie-2 y su expresión se restringe a zonas de remodelación vascular (43, 44). Así pues, es antiangiogénica en ausencia de VEGF y angiogénica en su presencia (45, 46).
En las fases iniciales del desarrollo de los tumores, cuando estos todavía no han alcanzado un tamaño macroscópico, las células tumorales pueden sustraer vasos de los territorios vecinos, pero son incapaces de inducir angiogénesis.
Una gran cantidad de angiopoyetina-2, en ausencia de VEGF:
Mantiene los vasos quiescentes. Sin que se conozca la causa, en una determinada fase del desarrollo del tumor, se expresan concomitantemente la angiopoyetina-2 y el VEGF, lo que dispara la angiogénesis y el crecimiento del tumor.
La angiopoyetina-2 también se expresa en los tejidos que experimentan remodelación vascular como la placenta, el útero, el ovario, el testículo inmaduro y el testículo en regresión (41).
Entre los factores reguladores de la angiogénesis, cabe destacar la hipoxia y los estrógenos. Como se ha dicho anteriormente, la hipoxia se reconoce como un factor importante en la inducción de angiogénesis. La falta de oxígeno en el tejido estimula la síntesis del HIF-1α y, a su vez, activa citoquinas proangiogénicas como VEGF y bFGF.
Dichos factores promueven la proliferación endotelial y dirigen un gradiente de crecimiento vascular a favor del tumor (14, 41). Por su parte, los estrógenos aumentan la angiogénesis induciendo la expresión de VEGF y del receptor Tie-2.
Este receptor, en presencia de angiopoyetina-1, promueve la supervivencia del endotelio vascular. Aunque la unión de la angiopoyetina-2 al receptor Tie-2 provoca apoptosis en ausencia de VEGF, en presencia del factor de crecimiento, aumenta la angiogénesis (41).