(Tibú, Norte de Santander)
F. GuhU, L. Hudson2, F. Serpa3, N. de SánchezI, D. Bridge2, C. JaramilloI y A. Young2
Resumen
Dos grupos de pacientes fueron examinados para la presencia de anticuerpos anti-Trypanosoma cruzi por inmunofluorescencia y ELISA, (i) habitantes de la población y del área rural circundante de Tibú, Norte de Santander (n = 327) Y(ii) empleados de la Empresa Colombiana de Petróleos (ECOPETROL n = 849).
El segundo grupo presentaba una rata menor de serología positiva (12% comparado con 29%), pero las distribuciones de los títulos de anticuerpos fueron muy similares en los dos grupos. Un total de 119 muestras séricas (37 de la población y 82 de ECOPETROL, incluyendo 25 controles seronegativos) fueron analizados en su capacidad de inmunoprecipitar los 7 polipéptidos mayores de tripomastigotes de T. cruzi de Mr mayor de 72 kDa.
Aunque 10 sueros de pacientes positivos no mostraron inmunoprecipitación, todos los sueros positivos restantes contenían anticuerpos que reaccionaban con los polipéptidos de 150, 90 y 85 kDa.
Cuando los sueros positivos para T. cruzi en inmunofluorescencia y negativos por inmunoprecipitación se probaron por ELISA usando GP90, todos fueron negativos, sugiriendo que los pacientes habían tenido una infección por T. rangeli que había sido erróneamente diagnosticada.
El nuevo diagnóstico fue confirmado por inmunofluorescencia y ELISA con epimastigotes de T. rangeli. Se realizaron estudios longitudinales en 19 pacientes del grupo de ECOPETROL durante 3.5 años.
Cinco pacientes seropositivos mostraron un cambio en sus perfiles de inmunoprecipitación anti-tripomastigote en este período; uno por pérdida de la precipitación de una banda de alto peso molecular previamente reconocida y otros cuatro por conversión de un perfil negativo a uno positivo de inmunoprecipitación.
Estos últimos pacientes presentaron inicialmente una infección no complicada de T. rangeli pero luego adquirieron una superinfección por T. cruzi. Estos pacientes representan el núcleo de un grupo en que los estudios prospectivos identificarán el efecto de la infección por T. rangeli en el curso de la Enfermedad de Chagas. (Lea: Medicina, Sida- Tuberculosis La Epidemia del Siglo XXI)
Introducción
El patógeno humanoTrypanosoma cruzi es el agente causal de la Enfermedad de Chagas a través de Centro y Sur América. Aunque se considera que forma una única especie y produce un patrón relativamente uniforme de infección, existe una notable variación en la presentación de la enfermedad, tanto en su sintomatología como en su severidad.
La evidencia corriente sugiere que la variación interaislado de la expresión de antígenos parasitarios (Plata, Pon s & Eisen, 1984), está relacionada con el zymodeme (Miles, 1983) y su interacción con la respuesta inmune del huésped pueden combinarse para producir una inmunopatogénesis con un resultado variable en la enfermedad (Hudson & Britten, 1985).
Aun más, Segura y sus colaboradores (Ruiz, Estera, Cabeza Meckert, Laguens & Segura, 1985) han mostrado que el conocimiento inmune de diferentes subconjunto de antígenos internos del parásito, en la ausencia de infección, altera el tejido blanco (diana) para la patogénesis, sugiriendo que la respuesta inmune, y la naturaleza de los antígenos reconocidos, no sólo controla el curso de la infección (Scott & Goss-Sampson, 1984) pero también puede determinar los parámetros cualitativos y cuantitativos de la enfermedad.
La corroboración clínica de esta noción viene de los estudios que muestran que mientras la respuesta mitogénica a los antígenos de superficie de T. cruzi no mostraban correlación con el status de la enfermedad, los antígenos internos producían una respuesta mitogénica mayor en pacientes con manifestaciones digestivas, comparados con pacientes asintomáticos (Gusmao, Rassi, Rezende &Neva, 1984).
Hasta ahora, varios estudios detallados han sido realizados para determinar la variedad de polipép tidos de epimastigotes reconocidos por la respuesta inmune de pacientes de diferentes áreas geográficas e infectados con diferentes zymodemes de T. cruzi (por ejemplo, Zingales, Abuin, Romanha, Chiari & Colli, 1984; Nogueira, Unkeless & Cohn, 1982) pero han fallado en identificar cualquier heterogeneidad en el patrón de reactividad inmune.
Sin embargo, cuando estudios similares se llevaron a cabo con polipéptidos de tripomastigotes, se observó una variación significativa en el rango de los polipéptidos precipitados (Martins, Hudson, Krettli, Can’rado & Brener, 1985) y fue particularmente informativo en el caso de un paciente del que se disponían muestras seriadas.
En el presente manuscrito reportamos los hallazgos iniciales de un estudio prospectivo iniciado en Norte de Santander, Colombia, en un grupo central de 82 pacientes, 19 de los cuales han sido seguidos hasta por 3.5 años.
El análisis de inmunoprecipitación mostró cambios marcados en los polipéptidos precipitados y permitió identificar algunos de los pacientes chagásicos seropositivos como un diagnóstico errado, debido a infección por T. rangeli a una infección con T. cruzi en el curso de este estudio.
Material y Métodos
Muestras de suero fueron obtenidas de dos categorías de pacientes que habitan en un área de alta endemicidad para T. cruzi en los alrededores de Tibú, Norte de Santander, Colombia: (i) habitantes generales de la población, colectados durante una visita que coincidió con los trabajadores de la Campaña Nacional de Vacunación (n = 327) Y(ii) empleados de la Empresa Colombiana de Petróleos (ECOPETROL) (n = 849).
Los dos grupos representaban marcadas diferencias en el grado de asistencia médica y condiciones socioeconómicas, pero los dos estaban sometidos a los ciclos de transmisión clásicos de T. cruzi, a través de su contacto con Rhodnius prolixus.
El grupo de ECOPETROL era lo suficientemente estable para facilitar visitas de seguimiento a lo largo de 3.5 años cuando la recolección de suero fue apoyada con el xenodiagnóstico con consentimiento del paciente, y electrocardiograma (ECG) y exámenes clínicos como parte de al asistencia médica proveí da en el hospital de la compañía.
El xenodiagnóstico se realizó usando 10 insectos en cada una de 4 cajitas recubiertas de tul. Después de la aplicación en la piel para permitir su alimentación por 30 min, los insectos retornaron al laboratorio y fueron sacrificados a los 30, 60 y 90 días para la detección de T. cruzi por examen microscópico.
Parásitos y Serodiagnóstico
Tripomastigotes de T. cruzi de la cepa Y fueron producidos en cultivos in vitro usando células VERO como fue descrito por Martins et al. (1985) y los epimastigotes para inmunofluorescencia, se hicieron crecer por cultivo monofásico en medio de Warren (Warren, 1960). La cepa San Agustín de T. rangeli fue cultivada en medio RPMI 1640 conteniendo 20% de suero fetal bovino, sin antibióticos, como se describió recientemente (Takle, 1988).
Placas de ensayo con micropozos fueron cubiertas con sonicados de T. cruzi o T. rangeli (50 ullpozo de una concentración de proteína total de 50 ug/m1) o con GP 90 deT. cruzi purificada por afinidad (50 ul/ pozo de 10 ul/ml de proteína) y se usaron para detectar anticuerpos séricos por ELISA, como se describió previamente (Guhl, Hudson, Marinkelle, Jaramillo & Bridge, 1987).
El análisis de inmunofluorescencia fue realizado haciendo reaccionar epimastigotes fijados con formaldehído con diluciones seriadas de las muestras de suelo por 30 min a temperatura ambiente. Después de lavado exhaustivo en solución salina tamponada con fosfatos, el anticuerpo ligado se visualizó con IgG de conejo anti-inmunoglobulina humana conjugada a isotiocianato de fluoresceína usando un microscopio de luz u.v. con epi-iluminación.
Los datos se anotaron como el título más alto que daba una fluorescencia positiva distinguible sobre el fondo definido por sueros controles de individuos no infectados. Los sueros control no mostraron unión a los epimastigotes de ninguno de los parásitos de diluciones mayores o iguales a 1:20.
Análisis de Inmunoprecipitaciòn
Las técnicas para análisis de inmunoprecipitación y electroforesis en geles de poliacrilamida con sodiododecilsulfato (SDS-PAGE) han sido descritos en detalle en otras publicaciones (Wong, Hudson & Hindmarsh, 1986) y se variaron sólo en el uso de geles de acrilamida de 7.5% en paralelo con geles del 10% para algunos sueros, para obtener mejor resolución y estimación del tamaño sobre un peso molecular relativo aparente (Mr) de 100 kDa.
Cuando 1.0 x 10 tripomastigotes marcados extrínseca e intrínsecamente fueron solubilizados en una solución 1% (PN), del detergente no-iónico Renex 30 (Atlas Chemical Company, Leatherhead, R.U.), se encontraron los siguientes cpm asociadas con el material precipitable con Acido Tricloroacético frío: 12513.2± 1.5 x 106 cpm (promedio +/- error standard de 5 determinaciones, en cada caso) y3583.4 +/- 2.1 x 106 cpm.
Estas cuentas eran el 69 +/- 3.3% de la incorporación total para el marcaje con 1251y 88 +/ – 7.1% para el marcaje con 35S.
Exámenes Clínicos y Electrocardiogramas (ECG)
Los exámenes y el ECG fueron realizados por el personal médico del Hospital de ECOPETROL en Tibú.
Resultados
La encuesta serológica de los habitantes de la población de Tibú mostró que el 29% de ellos eran positivos para anticuerpos anti -T. cruzi, y más de la mitad del grupo positivo tenía títulos por inmunofluorescencia mayor a 1:80.
Aunque la prevalencia de la serología positiva era mucho menor en el personal de ECOPETROL (12%), la distribución de los títulos de inmunofluorescencia era similar a la vista en los habitantes de la población. Las bandas polipépticas mayores de Mr 72- 166 kDa usadas en el análisis se muestran en la Fig. 1.

El doblete mayor en los 94 kDa (rango 101-80 kDa) consta de dos glicoproteínas principales GP 85 Y GP 90 (8nary, 1985). Generalmente las dos fueron reconocidas con igual intensidad por sueros de pacientes infectados y no se obtuvo resolución en los geles dado el intenso marcaje.
La variación en las distribuciones· de tamaño de polipéptidos precipitados se ilustra en la autorradiografía de dos geles\al10% 8D8-PAGE en la Fig. 2. Análisis previo a la decodificación de las muestras, mostró que la mayoría de los pacientes reconocía los polipéptidos de Mr 150 kDa y un doblete intenso en 95 kDa (rango 101-80 kDa).
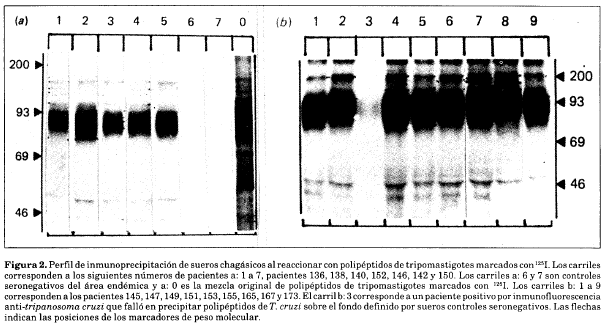
Los pacientes individualmente mostraban una variación cuantitativa en las otras bandas analizadas, por ejemplo en el suero el paciente 138 (Fig. 2 carril a: 2) precipitaba un polipéptido de Mr 72 kDa; en tanto que sueros de otros pacientes corridos en el mismo gel no lo hicieron.
De manera similar el suero del paciente 165 (Fig. 2, carril b: 7) ‘reaccionó con dos polipéptidos grandes de Mr 137 y 127 kDa y sobre todo, mostró un patrón de bandas más complejo que sueros de otros pacientes en el mismo gel. La frecuencia con que las bandas individuales fueron reconocidas por las muestras de suero se muestran en la Tabla 1.

Tres pacientes no mostraban patrones de inmunoprecipitación reconocibles: los pacientes 142 y 150 (Fig. 2, carriles a: 6 y a: 7, respectivamente) eran controles negativos, mientras que el paciente 149 (Fig. 2, carrilb: 3) tenía un título anti-T. cruzi por inmunofluorescencia de 1:40. Una búsqueda intensa se condujo en el grupo de pacientes para identificar los seropositivos que no precipitaban los polipéptidos marcados con 125I.
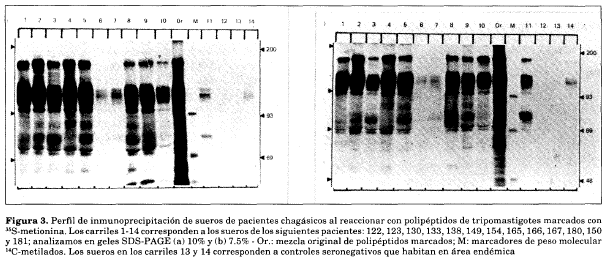
Para asegurar que la ausencia de reactividad no era simplemente un artefacto del método de marcación de superficie, los pacientes también se analizaron contra polipéptidos de tripomastigotes marcados con (358)metionina, como se ilustra en la Figura 3, por ejemplo.
Análisis paralelo en geles del 7.5 y 10% revelaron precisamente el mismo patrón de polipéptidos de alto peso molecular. La mayoría de las muestras de suero de pacientes seropositivos reconocían polipéptidos de 150,94 Y72 kDa. Aunque la resolución de las bandas polipeptídicas de alto peso molecular Mr mayor de 90 kDa fue mejor en el gel de bajo porcentaje, no hubo diferencias cualitativas entre los patrones de bandeo observados.
Dos de los sueros de los pacientes seropositivos (149 y 154) no mostraron precipitación sobre el fondo definido por tres controles seronegativos (184, 150 Y 181). En total, 10 pacientes con títulos de anticuerpos anti-T. cruzi entre 1:40 y 1:80 (números 3, 4, 5, 6, 12,32, 108, 149, 152 Y180) fallaron en precipitar antígenos de tripomastigotes de T. cruzi en pruebas repetidas ya fuera con polipéptidos marcados con 1251(como en la Fig. 2) o con 35S_ metionina (como en la Fig. 3).
En vista de los hallazgos anteriores todos los sueros fueron probados por las técnicas de inmunofluorescencia y ELISA para re actividad contra antígenos de T. rangeli: 37% de los pacientes que eran seropositivos para T. cruzi también tenían anticuerpos contra T. rangeli.
El paciente 184 (Fig. 3, carril 12 en los geles a y b), quien había sido considerado como un control negativo por la carencia de anticuerpos anti-T. cruzi se encontró que tenía un título de 1:20 por inmunofluorescencia y una reacción positiva de ELISA contra T. rangeli.
Tuvimos la oportunidad de hacer estudios de seguimiento en 19 de los 82 pacientes empleados originales de ECOPETROL. Se encontraron insectos positivos en dos de los 9 pacientes que accedieron a tomar parte en el xenodiagnóstico y se detectaron anormalidades en el ECG de 5 de los 19 pacientes (Tabla 2).
En general, el título anti-T. cruzi medido por inmunofluorescencia (Tabla 2) o ELISA (datos no mostrados), tendían a declinar durante el período de estudio. Sin embargo, en 4 casos (pacientes 3, 4,12 Y163, Tabla 2) el título se hizo completamente negativo. Este fue un hallazgo sorprendente.
El análisis de inmunoprecipitación de muestras séricas secuenciales mostró que los pacientes ten dían a mantener un patrón estable de inmunoprecipitación a lo largo del período de estudio de 3.5 años. El patrón de bandeo mostrado por la mayoría de pacientes se ilustra en la Fig. 4 por el paciente 2 (carriles 3 y 4) o el paciente 9 (carriles 10y 11). Los sueros de estos pacientes inicialmente reconocían 6 de las 7 bandas polipeptídicas incluidas en el análisis y no variaban en intensidad o número de bandas durante los 3.5 años.

Sin embargo, el suero del paciente 18 (Fig. 4 carriles 1 y 2) mostró una reacción inusual con el doblete polipeptídico mayor en 94 kDa; de manera contraria a la mayoría de los sueros probados, el suero de este paciente reaccionaba principalmente con el componente 85 kDa.
Las muestras secuenciales de 4 pacientes seropositivos fallaron en reaccionar con polipéptidos de T. cruzi: estos eran 3, 4, 12 y 163 (el suero del paciente 3 se muestra en la Figura 4 carriles 8 y 9). Significativamente, estos eran precisamente los mismos pacientes quienes empezaron con reactividad aparente anti-T. cruzi pero que se hicieron negativos en el curso del estudio (Tabla 2).

El suero del paciente 24 demostró una variación cualitativa interesante en los polipéptidos de alto peso molecular en 137 y 127 kDa: los dos fueron inmunoprecipitados por dos muestras séricas secuenciales con dife rencia de 6 meses (Fig. 4 carriles 5 y 6) pero solamente la banda de 127 kDa fue reconocida por una muestra de suero tomada 2.5 años después (Fig. 4 carril 7).
El suero del paciente 6 ilustra una clara conversión de una reacción negativa de inmunoprecipitación a una positiva (Fig. 4 carriles 12 y 13), aunque su re actividad anti-T. cruzi permaneció constante a través del período del estudio (Título por inmunofluorescencia 1:40 para los tres tiempos, Tabla 2). Las muestras séricas de tres pacientes (números 6, 55 Y99) se convirtieron de la misma manera.
Discusión
Nuestro conocimiento de la secuencia detallada de la respuesta inmune siguiente a la infección clínica con T. cruzi es relativamente limitado. Hasta ahora no se han publicado estudios prospectivos que traten de relacionar los cambios en el patrón de reactividad antigénica con variaciones en el curso de la infección y enfermedad, aunque la evidencia experimental sugiere que la calidad de la respuesta inmune puede influir profundamente el potencial para la expresión de la enfermedad (revisado por Hudson, 1985).
Los datos reportados aquí son los hallazgos iniciales de un proyecto a largo plazo para documentar los cambios humorales y celulares en un grupo de empleados petroleros que están en riesgo de contraer la infección por T. cruzi, durante su trabajo en el campo.
La edad promedio de nuestro grupo de estudio es 38, sus miembros son predominantemente del sexo masculino y por lo tanto mayor la probabilidad de desarrollar enfermedad cardíaca. Socioeconómicamente hablando, son relativamente privilegiados y por lo tanto no presentan complicaciones inmunológicas derivadas de desnutrición crónica.
Ellos reciben exámenes clínicos regulares como parte de un esquema de seguridad industrial y tienen disponibles para ellos quimioterapia contra el espectro normal de infecciones humanas, exceptuando T. cruzi. Es importante anotar que el record de empleo del grupo ha sido estable, facilitando así estudios seriados de seguimiento.
La selección de esta área de Colombia para el estudio tiene la ventaja combinada de una similaridad fenotípica entre los principales stocks selváticos y domiciliarios de T. cruzi (mucho más cercana que las extensas diferencias entre zymodemes selváticos y domésticos observados en Brasil y Chile), (Saravia, Holguín, Cibulskis y D’Alessandro, 1987) y un perfil de la enfermedad relativamente simple ya que los síndromes digestivos no ocurren y la enfermedad cardíaca, aunque relativamente leve, ocurre en un número significativo de pacientes (en nuestro caso 12 de 59 seropositivos hasta ahora; datos completos a ser publicados).
Por la selección de este grupo, creemos que las asociaciones paciente, parásito y enfermedad se han podido reducir cercanamente al mínimo de complejidad.
La encuesta serológica inicial de los dos grupos definidos en Tibú, la población y ECOPETROL, confirma que el último grupo tenía ratas de prevalencia mucho menores para anticuerpos anti- T. cruzi, pero ninguna diferencia en la distribución de títulos de inmunofluorescencia o valores de ELISA, sugiriendo que la menor rata de prevalencia era el resultado de un contacto menos frecuente con el vector, en lugar de ser una reactividad inmune aberrante.
Más del 70% de los habitantes de la población identificaron a Rhodnius prolixus como parte de la fauna peri-doméstica de sus hogares.
La inspección de geles de SDS-PAGE independientes en los que polipéptidos marcados con 1251habían sido fraccionados por tamaño mostraron que era posible reconocer 7 polipéptidos de alto peso molecular (Mr 166, 150, 137, 127,94 y 72 kDa) que era un característica constante del perfil de iodinación de tripomastigotes deT. cruzi catalizada por lactoperoxidasa.
Estos polipéptidos era muy grandes para ser artefactos de iodinación debido a la absorción de lactoperoxidasa marcada (Plessman Camargo, Barbieri & Jankevicius, 1982) y por lo menos 4 de ellos (150, 160, 90, 85, Y72 kDa) han mostrado ser glicoproteínas mayores de superficie celular derivadas del parásito (Snary, 1985).
El patrón de polipéptidos mayores inmunoprecipitados reconocidos por la mayoría de los pacientes corresponde cercanamente con lo que ya se publicó para pacientes infectados con T. cruzi en Choachí a 560 km de Tibú (Guhl et al., 1987) y es virtualmente idéntico a patrones publicados en estudios más limitados de pacientes de dos regiones diferentes de Minas Gerais, Brasil (Zingales et al., 1984; Martins et al., 1985).
En cada caso la respuesta inmune contra las glicoproteínas mayores de Mr 150 (correspondiente a la banda de 160 kDa de Martins et al., 1985) 90 Y85 kDa de tripomastigotes de T. cruzi estaba altamente conservada. Cuando las muestras de un sólo tiempo fueron analizadas no había una relación discernible entre las variaciones en los perfiles de polipéptidos reconocidos y las correlaciones examinadas a saber: (i) título anti-T. cruzi por inmunofluorescencia (ii) agrupamiento socio-económico y la probable frecuencia de exposición y (iii) si el paciente presentaba anormalidades en el ECG.
Una excepción notable a esta carencia de correlación fue la temprana identificación de un paciente claramente seropositivo con antígenos de T. cruzi en inmunofluorescencia pero negativo por inmunoprecipitación de polipéptidos marcados con 1251.
Esta observación nos hizo recordar las observaciones hechas en la región Ubaque de Choachí (Guhl et al., 1987) donde varios casos de infección clínica de T. rangeli habían sido identificados con este mismo perfil inmunológico.
La nueva prueba de los sueros con antígenos de T. rangeli mostró una rata de prevalencia aparente de 37% de anticuerpos anti-T. rangeli. Aunque esto es similar a las ratas descritas para áreas libres de T. cruzi en Venezuela (29% Avila, Rojas, Velázquez- Avila & Rieber, 1987), no es posible determinar la verdadera rata de prevalencia por esta técnica ya que se ha mostrado que T. cruzi y T. rangeli comparten más del 60% de sus antígenos solubles (Mchain, LeRay, Fruit & Capron, 1974).
Sin embargo, la existencia de infección clínica por T. rangeli en esta área no está abierta a discusión ya que dos pacientes, previamente clasificados en el grupo control seronegativo para T. cruzi, se encontró que sólo tenían anticuerpos anti-T. rangeli y otros 10 más reaccionaron con T. cruzi y T. rangeli en inmunofluorescencia pero no reaccionaron con GP 90 en ELISA (Schechnter, Luquetti, Rezende & Miles, 1985) o polipéptidos de tripomastigotes en imunoprecipitación.
La infección clínica con T. rangeli no ha sido descrita previamente en el departamento de Norte de Santander, Colombia. Significativamente, en cuatro de estos pacientes se hicieron negativos los anticuerpos de reacción cruzada anti-T. rangeli y/o T. cruzi sugiriendo que la infección por T. rangeli es terminada por una respuesta inmune efectiva. Esto será en contraste directo con la infección T. cruzi, donde tanto la infección y la respuesta inmune asociada es de por vida en el paciente inmunocompetente.
Los estudios de seguimiento en 19 pacientes, en algunos casos por 3.5 años han mostrado cambios interesantes en su respuesta inmune y estado de la infección. La mayoría de los pacientes mostró un patrón estable de polipéptidos derivados deT. Cruzi precipitados, una vez que el estadio crónico es alcanzado.
Sin embargo, dos pacientes tenían una re actividad interesante para T. cruzi: el paciente 18 tenía anticuerpos que reaccionaban predominantemente con el polipéptido de 85 kDa, en contraste con todos los otros sueros positivos examinados que reconocían igualmente bien los polipéptidos de 85 y 90 kDa.
El paciente 24 mostró la pérdida selectiva de reconocimiento de una banda polipeptídica en 2.5 años, aunque el paciente había desarrollado anormalidades en el ECG, no es posible aún sacar conclusiones, estos dos ejemplos solamente ilustran cambios inmunológicos que identifican estos pacientes para investigación especial.
Los registros de empleo de los pacientes de ECOPETROL mostraron que todos habían pasado por un examen médico inmediatamente antes de ser empleados. Este chequeo incluía un ECG para excluir los individuos con enfermedad cardíaca potencial.
El hallazgo de 5 individuos seropositivos con anormalidades en el ECG en el grupo de seguimiento es, por lo tanto, de interés y significado considerables. Aunque se reconoce que los cambios anotados en la tabla 2 no son necesariamente una indicación de enfermedad cardíaca orgánica, la incidencia de anormalidad en el ECG es mayor de lo que se esperaría en los grupos controles seronegativos.
Un paciente en este grupo (número 157 Tabla 2) tenía cambios sugestivos de isquemia en el ECG, un título anti-T. cruzi de 1:40 pero falló en reaccionar con GP 90 en ELISA (datos no mostrados) y en precipitar polipéptido de tripomastigotes de acuerdo con una infección mal diagnosticada por T. rangeli.
Aún debe ser establecido si la isquemia fue debida a los efectos no específicos de la inmunidad contra la fracción microsomal de tripasomatidos no patógenos (Cabeza, Meckert, Cazzulo, Segura, Estera, Ruiz, Gelpi Languens; 1984) o una ocurrencia no relacionada.
Aunque todos los pacientes que mostraban anormalidades en el ECG (Tabla 2, pacientes 6, 17, 24, 25 Y157) presentaban características en sus perfiles de precipitación que servían para distinguirlos de la gran mayoría de pacientes. El tamaño de la muestra aún es muy pequeño y muy heterogéneo para sacar conclusiones.
La identificación de cuatro pacientes que se convirtieron de un perfil negativo de inmunoprecipitación con serología positiva anti-T. cruzi indicadores de una infección por T. rangeli que producía reactividad cruzada, a un perfil de inmunoprecipitación completo anti-T. cruzi y reactividad anti-GP 90, fue interesante.
Estos pacientes y potros detectados durante el curso del estudio, proveen una excelente oportunidad para un estudio prospectivo de la interacción de estos dos parásitos, uno con otro y con la respuesta inmune.
En una publicación previa (Guhl et al., 1987) sugerimos que la infección inicial con el tripanosoma no patógeno pero con reacción cruzada serológica, el T. rangeli, puede no sólo alterar el curso de la infección subsecuente por T. cruzi, pero también puede moderar la severidad de la enfermedad subsecuente. Ahora tenemos el núcleo de un grupo de pacientes en el que estudios prospectivos pueden ser realizados para probar esta intrigante posibilidad.
Bibliografía
- AFCHAIN, D. LERAY, D., FRUIT, J. & CAPRON, A (1979). Antigenic makeup ofTrypanosoma cruzi culture forms: identification of a specific component. Journal of Parasitology 65, 507-14.
- AVILA, J. L., M., VELASQUEZ-AVILA, G. & RIEBER, M. (1987). Antibodies to laminin in Trypanosoma rangeliinfected subjects. Parasitology Research 73, 178-9.
- CABEZAMECKERT, P., CAZZULO, J. J., SEGURA, E. L., ESTERA, M., RUIZ, A., GELPI, K & LAGUENS, K (1984). Induction ofheart alterations by immunization with subcellular fractions of Crithidia fasciculata. Experientia 40, 171-3.
- GUHL, F., HUDSON, L., MARINKELLE, C. J., JARAMILLO, CA & BRIDGE, D. (1987). Clinical Trypanosoma rangeli infection as a complication of Chagas disease. Parasitology 94, 475-84.
- GUSMAO, KA., RASSI, A., REZENDE, J. M. & NEVA, F. (1984). Specific and non-es pecific lymphocyte blastogenic responses in individuals infected with Trypanosoma cruzi. American Journal ofTropical Medicine and Hygiene 33, 827-34.
- HUDSON, L. (1985). Autoinmune phenomena in chronic chagasic cardiopathy. Parasitology Today 1, 6-9.
- HUDSON, L. & BRITTEN, V. (1985). Inmune response to South American trypanosomiasis and its relationship to Chagas disease. British Medical Bulletin 41,175-80.
- MARTINS, S., HUDSON, L., KRETTLI, AU., CANCADO, J. K & BRENER, Z. (1985). Human and mouse sera recognise the same polypeptide associted with immunological resistance to Trypanosoma cruzi infection. Clinical and Experimental Inmunology 61, 343-50.
- MILES, M.A (1983). The epidemiology ofSouth American trypanosomiasis, biochemical and immunochemical approaches and their relevance to control. Transactions of the Royal Society of Tropical Medicine and Hygiene 77, 5-23.
- NOGUEIRA, N., UNKELESS, J. & COHN, Z. (1982). Specific glycoproteins on the surface of insect and mammalian stages of Trypanosoma cruzi. Proceedings of the National Academy of Sciencies, USA 79, 129-3.
- PLATA, F., PONS, G. F. & EISEN, H. (1984). Antigenic polymorphism of Trypanosoma cruzi: clonal analysis of trypomastigote surface antigens. European Journal of Inmunology 14, 392-9.
- PLESSMAN CAMARGO, E., BARBIERI, C. L. & JANKEVICmS, J. V. (1982). Possible artifacts in the radioiodination of surface proteins oftrypanosomatids. Journal of Inmunological Methods 52, 245-53.
- RUIZ, A. M., ESTERA, M., CABEZA MECKERT, P., LAGUENS, K P. & SEGURA, E. L. (1985). Protective inmunity and pathology induced by innoculation of mi ce with different subcellular fractions of Trypanosoma cruzi. Acta Tropica 42, 299-309.
- SARAVIA, N.G., HOLGUIN, A. F., CIBULSKIS, K E., & D’ALESSANDRO, A. (1987). Divergent isoenzyme profiles of sylvatic and domiciliary Trypanosoma cruzi in the eastern plains, Piedmont and highlands of Colombia. American Journal ofTropical Medicine and Hygiene 36, 59-69.
- SCHECHTER, M., LUQUETTI, A O., REZENDE, J. M., RASSI, A & MILES, M. A (1985). Further evaluation of lectin affinity purified glycoprotein (GP90) in the enzyme linked immunosorbent assay (ELISA) for diagnosis ofTrypanosoma cruzi infection. Transactions of the Royal Society of Tropical Medicine and Hygiene 79,637-40.
- SCOTT, M. T. & GOSS-SAMPSON, M. (1984). Restricted IgG isotype profiles in T. eruzi infected mice and Chagas disease patients. Clinical and Experimental Immunology 58, 372-9.
- SNARY, D. (1985). The cell surfaee of Trypanosoma eruzi. Current Topies in Microbiology and Immunology 117, 75-9.
- TAKLE, G. (1988). A simple, well-defined culture medium for the growth of Trypanosoma rangeli. Transactions of the Royal Society of Tropical Medicine and Hygiene (in the Press).
- WARREN, L. G. (1960). Metabolism of Schizotrypanum eruzi Chagas. 1. Effects of culture age and substrate concentration on the respiratory rateo Journal of Parasitology 46, 529-39.
- WONG, R. C. K., HUDSON, L. & HINDMARSH, P. J. E. (1986). Immune precipitation and immunoblotting for the detection of Trypanosoma eruzi antigens. Transactions of the Royal Society of Tropical Medicine and Hygiene 80, 275-81.
- ZINGALES, B., ABUIN, G., ROMANHA, A. J., CHIARI, E. & COLLI, W. (1984). Surface antigens ofstocks and clones of Trypanosoma eruzi isolated from humans. Acta Tropica 41, 5-16.
1. Centro de Investigaciones en Microbiología y Parasitología Tropical. Universidad de los Andes. A.A. 4976, Santafé de Bogotá.
2. Departamento de Inmunología, Universidad de Londres.
3. División Médíca, Empresa Colombiana de Petróleos.

