HISTORIA
- 1908: Descubrimiento del Toxoplasma gondii por Nicolle y Monceaux, cuando aislaron un parásito intra-celular en el hígado y el bazo del roedor salvaje tunecino Ctenodactylus gondii
- 1909: Le pusieron su actual nombre por su forma arqueada (del griego toxon: arcos) y por el nombre del roedor en que fue hallado. Carini demostró su reproducción experimental en conejos y Mello informó el primer caso de toxoplasmosis canina en Turín.
- 1913: Catellani describió la toxoplasmosis en humanos.
- 1913-1916: Carini y Maciel identificaron el toxoplasma en perros, palomas y cobayos
- 1916. Se relaciona la toxoplasmosis canina con la humana
- 1918. Se establecen las pruebas de inmunidad cruzada.
- 1923: Janku describió la corio-retinitis toxoplásmica en un paciente afectado de meningo-encefalitis aguda.
- 1929: Lépine y otros relacionaron el toxoplasma con el embarazo.
- 1937: Sabin y Olitsky inocularon el toxoplasma en animales de laboratorio y descubrieron los anticuerpos protectores.
- 1939: Wolf y Cowen lograron la transmisión experimental.1939
- 1942: Olafson y Monlux describieron por primera vez la toxoplasmosis en los gatos y se refirieron a la transmisión por consumo de carne mal cocida.
- 1942: Springer y Johnson describieron epizootias extensas en cerdos, conejos, palomas y otros animales y explicaron el contagio humano).
- 1948: Frenkel propuso la prueba de la toxoplasmina
- 1952: Bamatter describió la toxoplasmosis congénita.
- 1956: Groulade destacó a los gatos como reservorio doméstico.
- 1957: Golman y Kellen aplicaron la prueba de inmuno-fluorescencia indirecta.
- 1957: Jones describió el cuadro clínico y anatomopatológico.
- 1965: Hutchison y otros describieron el ciclo biológico y el de transmisión.
- 1972: Prakash señaló que los resultados de la prueba del complemento son de gran utilidad para diferenciar el estado agudo del crónico
- 1974: Anderson y Remington demostraron el papel de los macrófagos.
- 1975: Bout y Voller propusieron el método ELISA.
- 1981. Se consideró a T. gondii como causa importante de abortos y de mortalidad perinatal en ovinos en Australia, Nueva Zelandia y Gran Bretaña
- 1983: Brady estudió la neuro-toxoplasmosis en pacientes con SIDA.
- 1989: Burgs y otros utilizaron la reacción en cadena de la polimerasa para el diagnóstico.
- 1997: Bowie y otros realizaron un estudio sobre la probable contaminación del agua de consumo por toxoplasma.
* Extractado de la completa reseña histórica de Annie Pantoja, de la Universidad Agraria Fructuoso Rodríguez, de La Habana.
VÍAS DE TRANSMISIÓN
 Al Toxoplasma gondii le gusta el círculo natural. Los gatos comen ratones que contienen los quistes, los ratones comen verduras contaminadas con heces del felino doméstico; otros animales comen frutas o vegetales contaminados.
Al Toxoplasma gondii le gusta el círculo natural. Los gatos comen ratones que contienen los quistes, los ratones comen verduras contaminadas con heces del felino doméstico; otros animales comen frutas o vegetales contaminados.
La infección humana se produce cuando se come carne cruda o a medio cocer, o contaminada con heces de gatos, o se consumen verduras, frutas o ensaladas contaminadas. Si se produce una infección de novo durante el embarazo, la placenta se infecta y por esta vía se produce la contaminación del feto y la toxoplasmosis congénita. (** Dibujo de Alex Trojovski –de la Universidad de Gras- con autorización).
PREVALENCIA
Existe una amplia variación de la prevalencia de serología positiva en diferentes animales de acuerdo a las regiones estudiadas. Una muestra en Brasil mostró que tenían serología positiva para toxoplasmosis el 29% de las cabras, el 19% de las ovejas, y el 1% del ganado vacuno, mientras que un trabajo similar realizado en otra región como Vietnam mostraba que el 10% del ganado vacuno era positivo. Otra muestra realizada en Serbia encontró un 87% del ganado vacuno positivo, un 85% de ovejas y sólo un 15% en cerdos. También ha sido demostrada la presencia de Toxoplasma gondii en carne lista para ser consumida. La utilización de la reacción en cadena de la polimerasa (PCR) ha dado resultados positivos para T. gondii en el 1,5% de las muestras en un estudio y en el 38% de las muestras en otra serie. Además de la carne de diferentes animales, las frutas y verduras pueden actuar como vectores para llevar el parásito hasta el hombre y provocar el contagio de la enfermedad.
Los ooquistes presentes en el suelo, pueden también ser inhalados y está descrita una epidemia de toxoplasmosis en un establo donde se presume, de acuerdo a estudios realizados por el Center for Disease Control (CDC), que fue producida por inhalación de ooquistes, donde 37 personas adquirieron la enfermedad en forma aguda, de las cuales una sola (2,7%) desarrolló toxoplasmosis ocular en un período de seguimiento de cuatro años. Mil millones de personas se encuentran infectadas con el parásito.
EL PARÁSITO
El Toxoplasma gondii cumple su ciclo celular completo en su huésped definitivo que es el gato. Su morfología varía de acuerdo al hábitat y al estadio evolutivo, adquiriendo diferentes formas durante su ciclo.
 |
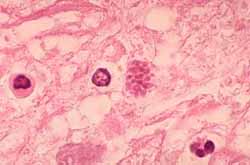 |
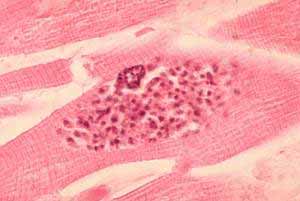
Arriba. Toxoplasmosis miocárdica en un paciente con Sida; en un pseudo-quiste se ven muchos taquizoítos. Al lado: El mismo cuadro histopatológico pero en tejido cerebral. Cortesía del CDC/Dr. Edwin P. Ewing, Jr.
El taquizoíto tiene la capacidad de multiplicarse en forma rápida dentro del citoplasma celular y es la forma proliferativa que se encuentra presente durante la fase aguda de la infección y es susceptible a los jugos gástricos y a una diversidad de drogas antiparasitarias.
El bradizoíto es la forma crónica que se localiza en la retina y en otros tejidos como el cerebro, músculo esquelético y corazón tras la primo-infección. Se denomina de esta manera por su lenta multiplicación y su capacidad de permanecer inactivo por largos períodos de tiempo. Cada bradizoíto puede contener más de 3000 organismos en su interior y debido a que forman una cápsula, son muy resistentes y pueden persistir por años en los tejidos.
El ooquiste es la forma que libera el gato por la materia fecal. Es altamente resistente al medio ambiente y es el responsable de contaminar a otros animales incluyendo al hombre a través de diferentes vectores.
El genotipo de la mayoría de las cepas de T. gondii corresponde a tres clones (tipos I, II, III); el tipo I se ha asociado con enfermedad severa en animales y humanos.
EPIDEMIOLOGÍA
Han sido descritas zonas endémicas y dos grandes epidemias de toxoplasmosis provocadas por la contaminación de agua potable. En British Columbia (Canadá), de cien personas entre los seis y ochenta y tres años, diecinueve tuvieron retinitis y cincuenta y una linfadenopatía. Los demás presentaron, bien síntomas inespecíficos o bien fueron asintomáticos. La fuente estaba en un reservorio de agua municipal no filtrada que había adquirido un aspecto turbio como consecuencia de un exceso de lluvias. En Santa Isabel do Ivaí en Brasil ocurrió una epidemia en 2001. Más de seiscientas personas tuvieron fiebre, dolores musculares, astenia, ganglios, lesiones cutáneas y amigdalitis. La fuente de infección fue un reservorio de agua que abastecía la ciudad, donde se pudo aislar al Toxoplasma gondii. Al igual que en el caso de Canadá, esto ocurrió después de un período de lluvias intensas. De quinientos sesenta y un pacientes seguidos por más de dos años, el 13,2% tuvieron manifestaciones oculares: un 6,8% lesiones de retinitis típicas de toxoplasmosis y el resto de los pacientes lesiones blanquecinas retinales evanescentes, vasculitis, uveítis anterior y vitreítis.
Con el uso de la PCR cuantitativa se vio que cuanto más precoz en la edad gestacional había sido el contagio mayor era la carga parasitaria y cuanto mayor la carga parasitaria, eran mayores las manifestaciones de toxoplasmosis congénita. Los transplantes de órganos y la leche no pasteurizada también han sido referidos como causa de contagio de la toxoplasmosis ocular.
COMO EVITAR LA INFECCIÓN
- Evite que los gatos se infecten comiendo alimentos crudos o cazando
- Cambie frecuentemente la caja donde el gato defeca.
- Protéjase cuando realice labores de jardinería donde frecuentan los gatos, use guantes.
- Si está embarazada o si padece alguna inmunodeficiencia, evite hacer estas labores.
- No olvide el lavado frecuente de las manos, especialmente después de esas actividades, así como después de manipular frutas, vegetales y carnes potencialmente contaminados.
- Cocine bien los alimentos, especialmente las carnes.
- Lave bien los implementos de cocina que hayan estado en contacto con carne cruda.
- Si tiene gatos, manténgalos en las casas, evite que vagabundeen o frecuenten áreas donde jueguen los niños.
- Al alimentarlos, hágalo con alimentos cocinados. Tampoco los expulse a la calle si están enfermos; ante cualquier síntoma, llévelos al veterinario.
FORMAS CLÍNICAS
Toxoplasmosis congénita
Se produce cuando la infección materna ocurre durante el embarazo. La incidencia de infección congénita es menor en el primer trimestre, pero suele ser más severa. Si la infección es adquirida durante el tercer trimestre, la transmisión al feto ocurre casi en el 60% de los casos, probablemente debido a una mayor vascularización de la placenta. La retino-coroiditis es la manifestación más común. Es bilateral en el 85% de los pacientes, y afecta la mácula en el 58% de ellos. Las lesiones oculares no necesariamente están presentes en el momento del nacimiento ya que pueden ir apareciendo en los meses posteriores.
 Hidrocéfalo (Cortesía de Álex Trojovsky)
Hidrocéfalo (Cortesía de Álex Trojovsky)

Calcificaciones intra-cerebrales (Cortesía de Álex Trojovsky)
Es por eso que en algunos países se realiza tratamiento antibiótico durante el primer año de vida, aunque su beneficio real aún no ha sido definitivamente demostrado. La infección del feto puede producir un aborto, tener una variedad sub-clínica con síntomas tardíos o permanecer asintomático, o presentar la triada de corio-retinitis, hidrocefalia y calcificaciones cerebrales. Otras lesiones que pueden asociarse a la toxoplasmosis congénita son microcefalia, convulsiones, órgano megalia, rash y fiebre (Ver ecografías).
Toxoplasmosis recurrente
Es la forma clínica ocular más común que se presenta como un foco de retinitis adyacente a una cicatriz corio-retiniana que se produjo como resultado de una infección adquirida previamente . Afecta a adultos jóvenes de ambos sexos, generalmente en forma unilateral, a pesar que ambos ojos pueden tener cicatrices corio-retinianas. Los títulos de anticuerpos suelen ser bajos debido al lapso transcurrido entre la primoinfección adquirida tempranamente en la vida y la retino-coroiditis que se manifiesta tardíamente (75% entre los 10 y 35 años de edad).
Toxoplasmosis adquirida
Se produce por la ingestión de quistes maduros a partir de alimentos contaminados con las heces de gato o la ingestión de quistes del parásito por consumo de carne cruda o insuficientemente cocinada.
Otras formas de infección:
- Auto-inoculación accidental en los laboratorios
- Transmisión por transfusiones de sangre o por otros tipos de transplantes.
Aunque el 90% de los pacientes son asintomáticos, el cuadro clínico se puede manifestar en la forma ganglionar –la más frecuente- que recuerda a la mononucleosis infecciosa, caracterizada por adenomegalias pequeñas, móviles y no dolorosas, localizadas fundamentalmente a nivel de las cadenas cervicales y axilares. En un pequeño número de casos se acompañan de signos menores como astenia, fiebre ligera, mialgias y más raramente exantemas fugaces; es muy raro que sea necesario tratar estos síntomas. No es infrecuente encontrar un síndrome monucleósico con resultados negativos en la reacción de Paul-Bunnell. Otras formas de presentación menos frecuentes son la miocárdica, los síndromes cerebelosos y vestibulares.
En algunos pacientes se puede descubrir una corio-retinitis aguda, unilateral, que se asocia a la liberación de los parásitos y a la intensa inflamación generada por la respuesta inmune. Existen en esta forma de la enfermedad episodios de agudización, con los que se destruyen elementos de la retina irremplazables. Las formas diseminadas graves son excepcionales, ellas se producen fundamentalmente en pacientes con deficiencia inmune primaria, o secundaria a infecciones como el VIH, a terapéutica inmuno-supresora o a enfermedades debilitantes como los linfomas. Fiebre elevada con escalofríos, toma del estado general, erupciones cutáneas, así como manifestaciones pulmonares, hepáticas, miocárdicas y cerebrales forman parte de las manifestaciones que pueden presentarse en estos pacientes.
Se considera que la mayor parte de los casos de toxoplasmosis ocular podrían ser adquiridos en forma postnatal. Un valor positivo de IgM confirma una toxoplasmosis adquirida, pero valores elevados de IgG en un joven o en un adulto sugiere fuertemente una toxoplasmosis adquirida.
Toxoplasmosis relacionada al SIDA
Algunos casos de toxoplasmosis ocular han sido descritos en pacientes con SIDA. En estos casos, las lesiones pueden no originarse de cicatrices corio-retinianas previas y pueden ser bilaterales, difusas y multifocales. Estudios histológicos mostraron escasa reacción inflamatoria en la retina, pero pudo encontrarse el parásito en el humor vítreo y hasta en el iris. La toxoplasmosis intracraneal es común en pacientes con SIDA; un estudio mostró que cuando estos pacientes tienen trastornos neurológicos, el 33% tenían la enfermedad.
Toxoplasmosis relacionada con corticoides y con inmuno-supresores
Casos atípicos de retinitis muy extensas han sido descritos en la literatura en pacientes tratados con corticoides durante largos períodos. En cuanto a los enfermos tratados con drogas inmunosupresoras –por su enfermedad de base aunque no constituye una inmuno-supresión total como la del SIDA- la toxoplasmosis ocular puede presentarse de manera diferente a lo que habitualmente se observa. Pueden existir extensas zonas de necrosis retiniana a pesar del tratamiento adecuado.
Toxoplasmosis relacionada a la edad
La edad avanzada es un factor de riesgo para tener formas extensas y difusas de toxoplasmosis ocular similar a la que se ve en pacientes tratados con corticoides o en inmunosuprimidos. Las lesiones agudas pueden ser multifocales y difusas y típicamente no están asociadas con una cicatriz previa, lo que hace posible que sean formas adquiridas que cursan con títulos elevados de IgG o inclusive IgM presente en algunos casos. El tratamiento debe ser prolongado para lograr la resolución de estos cuadros y las recurrencias son mayores al 50% al suspender el tratamiento.
Toxoplasmosis con obstrucción vascular
La perivasculitis es un hallazgo frecuente en toxoplasmosis ocular. Dice el oftalmólogo Dodds que este envainamiento puede ocurrir adyacente a un foco de corio-retinitis o puede ocurrir a distancia. No hay evidencia angiográfica de que estas placas puedan bloquear la arteria. Su origen sería debido a una reacción antígeno-anticuerpo que se manifiesta en la pared de los vasos. Por otro lado puede producirse una vasculitis más severa con obstrucción vascular en los lugares de retinitis activa, probablemente por la necrosis retinal que allí se genera. Tanto obstrucciones arteriales como venosas han sido observadas.
Toxoplasmosis con papilitis o neuro-retinitis
Se trata de un edema de papila unilateral que se manifiesta como una masa blanquecina inflamatoria adyacente al nervio óptico. Conserva buena agudeza visual si la mácula no está comprometida. Esta inflamación del nervio óptico puede asociarse con una estrella macular simulando una neuro-retinitis de otras causas.
CARACTERÍSTICAS OCULARES
El diagnóstico de la toxoplasmosis ocular se basa en los hallazgos oftalmológicos, ya que el laboratorio solamente comprueba que la persona ha tenido contacto con el parásito. Menos importancia aún tienen estas pruebas serológicas en países donde la prevalencia de anticuerpos en la población general es elevada. Como las formas adquiridas con reactivaciones tardías son las más comunes, los hallazgos serológicos son una IgM negativa y valores positivos variables de IgG. El parásito se aloja en la retina en la forma de bradizoítos enquistados y al romperse este quiste se desarrolla una retinitis. En la forma recurrente, esta retinitis se localiza adyacente a una cicatriz corio-retiniana previa. El resultado de esta retinitis previa combinada con la reacción inflamatoria que compromete al epitelio pigmentario y la coroides, es la que le da el nombre inexacto de corio-retinitis a la toxoplasmosis ocular (Ver fotografía retiniana, cortesía del profesor Álex Trojovsky). Se pueden involucrar distintas partes del ojo produciéndose vasculitis, vitritis, coroiditis y uveítis anterior. Reproducimos otra fotografía de una retina con Toxoplasma, por cortesía de los oftalmólogos españoles Aurelio J. Martínez-Parra y José A. Rodríguez-Chico que aparece en Photo-Web de la casa Alcon, dirigida por Jordi Bernal.
 |
 |
Las tablas anexas corresponden a Vargas y Zagorín, Revista Mexicana de Oftalmología.
| Hallazgos oculares – Uveítis anterior – Retinitis interna – Retino-coroiditis – Vitreítis – Cicatrices corio-retinianas – Lesión satélite – Vasculitis – Edema macular |
Complicaciones oculares – Sinequias posteriores – Cataratas – Glaucoma secundario – Membranas vítreas – Isquemia de retina – Anastomosis vasculares – Neo-vascularización – Desgarros y desprendimientos de retina |
Hallazgos oculares atípicos – Uveítis intermedia – Escleritis – Retinitis difusa o externa – Hemorragias intra-retinianas – Neuro-retinitis – Papilitis – Desprendimiento seroso – Ausencia de cicatrices corio-retinianas |
Según el argentino Emilio R. Dodds, la vasculitis puede afectar tanto a las arterias como a las venas y afectar no sólo a los vasos adyacentes a la lesión activa sino también a toda la circulación retinal simulando el cuadro de angeitis de rama congelada. Algunos pacientes no tratados nunca desarrollan vitritis y otros que demoran un poco el tratamiento llegan a tener vitritis tan severas como para requerir una vitrectomía. Cuando se produce un desprendimiento del vítreo posterior inducido por la inflamación es posible ver precipitados inflamatorios por detrás de la hialoides y esto es un hallazgo común en la toxoplasmosis ocular. La uveítis anterior aparece en aproximadamente el 50% de los pacientes con toxoplasmosis ocular. Cuando las células en la cámara anterior ascienden a 2+ o mayor, la presión intraocular suele estar elevada y característicamente responde muy bien a los corticoides tópicos, por lo que el mecanismo más probable sea el de trabeculitis. Por otro lado la uveítis anterior no se produce por un fenómeno de rebasamiento, ya que aún pacientes con poca inflamación en el vítreo pueden tener inflamación intensa de la cámara anterior. La revisión del doctor Dodds contiene interesantes y variadas fotografías retinianas que se pueden ver en la web.
Gary N. Holland ha publicado recientemente una revisión sobre el tema, donde observa que la prevalencia de la infección por T. gondii varia geográficamente y aumenta con la edad, siendo la proporción general en los Estados Unidos de un 22.5%, de los cuales aproximadamente un 2% desarrolla toxoplasmosis ocular, pero este compromiso es sustancialmente mayor en otras partes del mundo como en el sur del Brazil. Ha cambiado el paradigma en relación con el momento más frecuente de la infección, que ahora se considera el post-natal. Pueden pasar muchos años después de la infección para que se desarrolle el problema oftalmológico, pero la recurrencia es más frecuente en el transcurso del primer año después de haber tenido un ataque de retino-coroiditis. La apariencia de las lesiones de esta lesión ocular varía con la duración de la infección retiniana activa y la intensidad de la inflamación, siendo mucho más severa en pacientes inmuno-comprometidos, ya que este parásito es oportunista. Algo similar ocurre con los pacientes más viejos, pues tienen bajas sus defensas. En los pacientes inmuno-competentes puede ser beneficioso –así no haya sido comprobado en estudios aleatorizados- el uso de terapias anti-microbianas en los casos de coroido-retinitis toxoplásmica. Sin embargo el uso de trimetoprim-sulfametoxazol intermitente se asoció a una cantidad menor de recurrencias que un placebo, durante un estudio clínico aleatorizado que duró veinte meses.
DIAGNÓSTICO
Los métodos más utilizados para el diagnóstico son los serológicos, con los que se investiga la inmunidad humoral frente al Toxoplasma gondii. Se debe tener en cuenta que las primeras inmunoglobulinas producidas son IgM, seguidas por las IgA y la IgE, las cuales pueden ser detectadas durante la fase aguda de la enfermedad -es decir, durante los dos primeros meses después de la infección-excepto la IgM que puede circular hasta un año después. Las inmunoglobulinas G aparecen más tardíamente, alcanzando el máximo en uno o dos meses, y luego persisten en valores estables durante años, sirviendo de evidencia o marcador sexológico de una infección pasada.
En Cuba por ejemplo, la técnica más utilizada es la inmuno-fluorescencia indirecta (IFI), con la que se puede encontrar la Toxoplasmosis -mediante el estudio de dos o más sueros con intervalos de aproximadamente veintiun días- para determinar el aumento de títulos en dos o más diluciones, lo que demostrará una sero-conversión positiva o infección reciente.
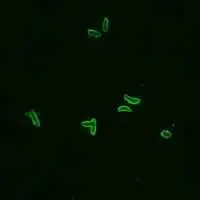

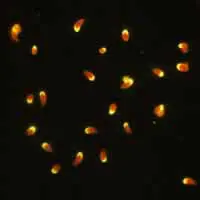
A: Taquizoitos de Toxoplasma gondii fijados en formalina y teñidos con inmuno-fluorescencia (IFA). Aquí se ve una reacción positiva (taquizoitos más anticuerpos humanos a Toxoplasma más IgG anti-humana marcada con FITC = fluorescencia).
B: IFA negativa para anticuerpos a IFA T. gondii.
C: IFA negativa para anticuerpos a T. gondii, reacción de tinción polar.
(De la Biblioteca de Imágenes del CDC de Atlanta, Sección de Parásitos)
La prueba de ELISA tiene ventajas para detectar IgM mientras que para IgG es similar a la IFI; tiene mayor sensibilidad y especificidad. Es capaz de detectar anticuerpos IgM muchos meses después a la infección .Una variedad de esta prueba mide la avidez de los anticuerpos; esta afinidad varía de acuerdo con el grado de maduración que tenga y es por lo tanto un indicador del tiempo de este anticuerpo. Los anticuerpos maduros tienen alta avidez mientras que los anticuerpos recientes tienen baja avidez.
La IFI es un excelente método y sus resultados son similares a la prueba de Sabin y Feldman para detectar IgG. La IgM puede tener falsos positivos con factor reumatoideo, anticuerpos antinucleares, reacciones cruzadas con anticuerpos para cito-megalovirus, Epstein-Barr, hepatitis A y sífilis.
Otros métodos usados son el Western Blot y el coeficiente de Witmer-Desmonts, usado entre los europeos. La reacción en cadena de la polimerasa (PCR) ha permitido identificar antígenos del parásito en liquídos oculares; sin embargo su sensibilidad y especificidad aún es baja en muestras de humor acuoso, lo que hace que su utilidad en el diagnóstico de toxoplasmosis ocular sea limitado. Un estudio de Villard comparó tres técnicas analíticas – ELISA, mancha (blot) inmune y PCR- en dos grupos de personas, uno con enfermedad oftálmica no inflamatoria y otro con la inflamatoria, casi todas estos últimos con evidencia serológica de toxoplasmosis. Se detectó una producción local de anticuerpos específicos IgG en el análisis apareado de muestras séricas y de humor acuoso en 63% con ELISA y en 53% con blot. El PCR de muestras de humor acuoso confirmaron la presencia de DNA de T. gondii en 28%. Combinando las tres pruebas se confirmó el origen toxoplásmico de las lesiones retinianas en un 83% de los casos, siendo las especifidades relativas de las tres técnicas, 100% para el PCR y 89% para las otras dos.
BIOLOGÍA MOLECULAR
- En la infección inicial se produce gran cantidad de interferón gamma (Debido a una activación celular temprana de células T y células asesinas naturales)
- Un mecanismo importante para esto es la inducción de inter-leucina 12 (IL-12) por los macrófagos.
- La IL-12 promueve la diferenciación de los efectores de los linfocitos T ayudadores
- Promueve la adquisición y activación de funciones microbicidas por parte de los macrófagos
- Favorece la liberación de óxido nítrico
- La IL-10 favorece la cronicidad de la toxoplasmosis, siendo entonces antagónica de la IL-12
- La prevención de la re-activación del quiste está mediada por el IFN- en la fase crónica de la infección
- El factor de necrosis tumoral alfa (TNF-) –al igual que el IFN– es importante para controlar la replicación de taquizoitos en las fases aguda y crónica de la infección, mientras que la IL-10 e IL-12 –que inhiben o favorecen la producción de IFN- son importantes básicamente en la fase aguda.
- Aunque las lesiones oculares son similares en la infección congénita y en la adquirida, los mecanismos inmunológicos que se encuentran detrás de ellas son diferentes.
TRATAMIENTO
En el tratamiento de la Toxoplasmosis se han empleado diferentes medicamentos de los cuales los más utilizados son la sulfadiazina y la pirimetamina, ambos durante seis a ocho semanas en adultos y cuatro semanas en niños, como quimioterapia supresora. Al tratamiento anterior se agrega el ácido folínico para evitar trastornos hematopoyéticos y en pacientes con trastornos oculares se asocian esteroides. Otras drogas que se han utilizado es la asociación de sulfadoxina y pirimetamina, el cotrimazol, y la hidroxi-naftoquinona. En el caso de las embarazadas se recomienda la espiramicina -un antibiótico de la familia de los macrólidos- con posibilidad de utilizarse en la mujer embarazada. El tratamiento durante el embarazo, disminuye de manera significativa el riesgo de infección fetal y la gravedad de su expresión.
En la toxoplasmosis ocular se ha propuesto el tratamiento clásico con las drogas arriba enunciadas; otras drogas que pueden usarse son la clindamicina (300 mg c/6 horas)a veces junto con la trimetoprima-sulfametoxazol.
Una droga que se pensaba podía tener un efecto sobre los quistes tisulares es el atovaquone. Sin embargo, clínicamente no ha demostrado disminución en las recurrencias de la enfermedad y por otro lado es un tratamiento largo y costoso. Otras drogas utilizadas son la espiramicina, azitromicina, claritomicina y tetraciclinas. En cuanto a tratamientos no medicamentosos se utilizan la foto coagulación con láser -una alternativa que sólo debe utilizarse cuando hay formas resistentes- que también podría utilizarse cuando hay intolerancia o complicaciones severas por el tratamiento médico. El tratamiento con láser no previene recurrencias y aumenta el tamaño de la cicatriz. Existen indicaciones para vitrectomía cuando hay persistencia de vítreo turbio con visión reducida durante más de seis meses. Otra indicación sería la vitrectomía diagnóstica cuando no hay visión del fondo de ojo o cuando se presenta un vítreo turbio asociado a un desprendimiento de retina.
Referencias
Dodds EM. Toxoplasmosis ocular. Arch Soc Española Oftalmol 2003. 78 (10):531-541.
Holland GN. Ocular toxoplasmosis: a global reassessment. Part II: disease manifestations and management.
Am J Ophthalmol. 2004 Jan; 137(1):1-17
Holland GN. Ocular toxoplasmosis: a global reassessment. Part I: epidemiology and course of disease.
Am J Ophthalmol. 2003 Dec;136(6):973-88.
Glasner PD, Silveira C et al. An unusually high prevalence of ocular toxoplasmosis in southern Brazil. Am J Ophthalmol 1992; 114: 136-144.
Bou G, Figueroa MS et al. Value of PCR for detection of Toxoplasma gondii in aqueous humor and blood samples from immunocompetent patients with ocular toxoplasmosis. J Clin Microbiol 1999; 37: 3465-3468.
Pearson PA et al. Atovaquone for the treatment of toxoplasma retinochoroiditis in immunocompetent patients. Ophthalmology 1999; 106: 148-153.
Vallochi AL, Nakamura MV et al. Ocular toxoplasmosis: more than just what meets the eye. Scand J Immunol. 2002. 55:324-328.
Vargas LE, Zagorín B. Toxoplasmosis ocular. Rev Mex Oftalmol 2001.75(5)
Ginorio D y cols. Toxoplasmosis. Bol Epidemiol Sem IPK- 2000. 10(5).
Trojovsky Alex. www.trojovsky.net/toxo/toxolit.htm
Pantoja A, Pérez-García L. Rseña histórica acerca de las investigacions relacionadas con toxoplasmosis. Rev Cubana Med tropical. 2001. 53(2): 111.117.
Villard O et al. Comparison of enzyme-linked immunosorbent assay, immunoblotting, and PCR for diagnosis of toxoplasmic chorioretinitis. JClin Microbiol. 2003. 41(8):3537-4
Denkers EY, Gazzinelli RT. Regulation and function of T-cell-mediated inmunity during Toxoplasma gondii infection. Clin Microbiol Rev .1998.11:569-588.
Tensiómetro Virtual agradece a los profesores Álex Trojovsky, Aurelio Martínez Parra, José A. Rodríguez-Chico y a Volmar Padilla –oftalmólogo de la Asociación San Bartolomé Apóstol- por su colaboración en la realización de este suplemento sobre toxoplasmosis. Indirectamente también al profesor Emilio Dodds , a Annie Pantoja, a L.E. Vargas y B. Zagorín, L.M y otros latino-americanos que han escrito sobre este tema.