El metabolismo óseo y el de los minerales calcio, fósforo –e indirectamente de otros iones como el magnesio y el potasio-. Está regulado por varias hormonas sistémicas denominadas calciotróficas, por citoquinas, factores de crecimiento, y moléculas de adhesión.
La homeostasis del calcio ionizado es el efecto más inmediato de dichas hormonas. Además de su contribución a la regeneración fisiológica del hueso.
Avances de la última década se relacionan con la vitamina D y su receptor. Análogos de PTH –moduladores de su acción- con utilidad terapéutica en osteoporosis. Y proteínas relacionadas con la PTH (con importantes efectos fisiológicos adicionales a la homeostasis del calcio). Mientras que la calcitonina ha perdido protagonismo en su papel fisiológico, aunque es clara su utilidad terapéutica como anti-reabsortivo.
Además se ha hecho evidente que el calcio mismo actúa como una hormona. Fijándose al receptor que contiene un detector (o sensor) del calcio extracelular.
HORMONAS CALCIO-REGULADORAS O CALCIOTRÓFICAS
Parathormona
La hormona paratiroidea (PTH). Es el único producto de secreción de las glándulas paratiroides. Estas pequeñas glándulas –en número de cuatro- son del tamaño de un garbanzo y usualmente se encuentran detrás de la tiroides. Aunque una de cada diez puede estar en el mediastino o dentro de la misma glándula tiroides. Están constituidas por células principales, células oxifílicas y células claras. Siendo las primeras la principal fuente hormonal.
La PTH es un polipéptido de una sola cadena, constituida por setenta y cinco amino-ácidos. Se segrega en respuesta a la hipocalcemia y la correlación es bastante directa entre las concentraciones de calcio y PTH. En la insuficiencia renal, donde hay hipocalcemia y retención de fosfato. Se produce un hiperparatiroidismo secundario con hiperplasia de las glándulas paratiroides.
Su secreción está regulada por los niveles extracelulares de calcio ionizado (o libre), reconocidos por el receptor sensor del calcio. En presencia de hipercalcemia hay todavía alguna secreción de parathormona.
Acciones de la PTH
- Intestino: indirectamente favorece la absorción de calcio. Por estimulación de la alfa-oxidación renal de la vitamina D
- Hueso: estimula los osteoclastos, generando osteólisis y liberando calcio en la circulación
- Riñón: frena la excreción de calcio urinario. Tiene acción fosfatúrica -por inhibición de la reabsorción tubular de fosfato-. Aumenta la excreción de sodio, potasio, bicarbonato y aminoácidos y disminuye también de la excreción de magnesio y amonio. El resultado neto en plasma es una elevación en los niveles de calcio y disminución de los de fosfato.
Receptores de parathormona
Existen dos, el tipo 1 – acoplado a la proteína G. Que fija tanto PTH como la proteína relacionada con la parathormona o PTHrP, receptor que cuando se une con el ligando activa la adenil-ciclasa. Y el sistema de fosfolipasa C, actuando a través de la vía del AMPc y la proteino-quinasa A, pero también la C.
Este tipo de receptor es abundante en el hueso- especialmente en los condorcitos en las placas de crecimiento- y en el riñón, sitios de acción de la PTH. Como hay niveles bajos del ARNm de este receptor en muchos otros tejidos, esto probablemente se refiere a que sirve también de receptor del PTHrP. El receptor tipo 2 es menos conocido, fija PTH pero su afinidad por PTHrP es muy baja.
La poli hormona PTHrP, factor de desarrollo y de control celular
Las proteínas relacionadas con la parathormona o PTHrP son una familia de hormonas proteicas producidas en prácticamente todos los tejidos. Que tienen un segmento que se fija al receptor 1 de PTH (de ahí su nombre). Pero que se liga también a otros receptores.
El descubrimiento de esta poli hormona permitió el conocimiento de una amplia variedad de sus funciones. Particularmente el control, diferenciación y apoptosis de muchos tipos de células. Lo que muestra que su nombre no es el adecuado al relacionarla principalmente con la homeostasis del calcio. Si bien es cierto que se descubrió en casos de tumores asociados a hipercalcemia –hiperparatiroidismos asociados a PTH ectópica- pues presentaba supresión de la excreción urinaria de calcio y aumento en la reabsorción ósea, como se ve en el hiperparatiroidismo primario.
El complejo poli hormonal PTHrP es codificado (en muchos tejidos, fetales y post-natales) por un gen único, del cual sale un precursor poli hormonal que genera varias hormonas peptídicas por la división alternante del transcriptor primario o sitios alternantes de partición o clivaje post-traduccional; además, esta familia de péptidos interactúa con múltiples receptores. El proceso proteolítico del precursor poli hormonal da lugar principalmente a tres péptidos, la osteostatina, el similar a la PTH y el de la región media.
Además de los conocimientos generados por estos modelos patológicos, existen los modelos biológicos pre-diseñados. Por ejemplo, se han podido desarrollar cepas de ratones a los que se les ha suprimido o extraído el gen de PTHrP –alterando algunos de sus exones- o el gen del receptor de vitamina D (ratones denominados knock out); por otro lado se han desarrollado cepas de ratones transgénicos que sobre-expresan un gen –como el de la PTHrP- en algunos tejidos.
En la Tabla 2 podemos ver los efectos fisiológicos de esta polihormona, observando que algunos de ellos son similares a los de la vitamina D activa, como los efectos sobre el ciclo del pelo, el crecimiento mamario –que sería de eventual utilidad en el manejo del cáncer de seno- y la regulación de la tensión arterial.
Efectos fisiológicos de PTHrP
(según estudios en ratones modificados en sus genes)
- Desarrollo óseo y cartilaginoso: estimula la proliferación de condrocitos y suprime su diferenciación final, al interactuar con el receptor de PTH. La inactivación de su gen causa muerte temprana, cierre prematuro de las epífisis y condrodisplasia severa.
- Desarrollo mamario: Se requiere la presencia de PTHrP en la compleja interacción de células epiteliales y mesenquimales que logran el desarrollo de la glándula mamaria.
- Lactancia: PTHrP –al ser segregado en grandes cantidades por el tejido epitelial mamario, juega un papel en la adaptación del metabolismo materno a las demandas aumentadas de calcio que ocurre durante la lactancia.
- Transporte placentario de calcio: Su bombeo se controla a través del péptido de la región media.
- Funcionamiento del músculo liso: es vasodilatador, pues al ser producido por estas células musculares lisas en respuesta al estiramiento, las relaja. La sobre-expresión del gen causa hipotensión, y también se observan efectos sobre la contracción muscular en vejiga, útero y corazón.
- Efectos en la piel: La sobre-expresión del gen causa alopecia, pero la administración de un antagonista de PTHrP aumenta el número de folículos pilosos del ratón y le da el aspecto de peludo; este hallazgo es interesante en el desarrollo de nuevas drogas para el tratamiento de la calvicie.
- Dientes: se desarrollan normalmente en el ratón con supresión del gen, pero no brotan de las encías.
- Sistema nervioso: influencian la supervivencia neuronal, aspecto también interesante en la investigación farmacológica para tratar demencias y otras pérdidas del tejido nervioso.
Vitamina D
Las vitaminas D son un grupo de esteroides –lípidos- biológicamente activos que tiene profundos efectos sobre el metabolismo mineral. De los cuatro tipos de vitamina D, el ergo-calciferol o D2 proviene de la irradiación del ergosterol, un esterol -de origen vegetal- en una serie de plantas.
Aunque la vitamina D3 o cole-calciferol se encuentra en forma natural en el aceite de pescado y yema de huevo y -con las otras formas de vitamina D- es un constituyente dietético esencial, no es propiamente una vitamina porque prácticamente todas las necesidades del ser humano se pueden llenar por las acciones de la luz solar sobre la piel; allí, la pro vitamina D 7-dehidrocolesterol, se convierte a vitamina D3 o colecalciferol.
La vitamina D3 se metaboliza en el hígado a 25-OH-D3 y luego en el riñón a 1-alfa-25, dihidroxi-D3 o a 24,25, dihidroxi-D3, según estén las concentraciones de vitamina D, calcemia y fosfatemia. La 1-alfa-hidroxilación es clave para mantener la homeostasis del calcio.
La 1,25(OH)2D3 ó calcitriol, es una hormona esteroidea, por lo tanto actúa a nivel del intestino a través de una vía genómica, parcialmente se describió al ligarse la hormona a un receptor.
Cuando se administra la 1,25(OH)2D3 por vía intravenosa, a animales deficientes de vitamina D, se produce una respuesta bifásica, una rápida a las 2 horas con un pico a las 6 horas y una respuesta tardía a las 12 horas, con un pico a las 24 horas; lo que sugiere que existen varios mecanismos implicados en la absorción intestinal del calcio.
La 1,25(OH)2D3 además incrementa la absorción de fósforo, pero la mayor absorción de fósforo ocurre en el yeyuno, ileon; la de calcio, ocurre principalmente en el duodeno, aun cuando tanto el calcio como el fósforo sé absorben a nivel del intestino delgado.
La absorción del calcio intestinal tiene cierto control modulatorio a nivel citosólico, pero además se induce una serie de protooncogenes como el C-mic, C-fos y C-sis, especialmente incrementa la síntesis de la C-fos e induce una regulación de la proliferación y diferenciación celular, estas dos funciones se observan 1-2 horas después de la unión hormona-receptor; esta diferenciación y proliferación celular se traduce en un mejor perfeccionamiento de las funciones de las células de la microvellosidades.
Como conclusión de las diferencias funcionales del calcitriol al incrementar la síntesis de calbindina-D, ésta incrementa el transporte transpitelial del calcio, la osteopontina induce una modulación del calcio intracelular y al incrementar la actividad de la 24-hidroxilasa, esta modula el metabolismo óseo (149,151,152,155,208,209).
La absorción de la vitamina D se lleva a cabo en la porción distal del intestino delgado, se acumula rápidamente en el hígado y luego se distribuye en varios órganos, en especial el riñón, hueso e intestino. Como la síntesis hepática – o 25 hidroxilación- de la vitamina D es regulada de manera muy laxa, los niveles de esta molécula dependen de la cantidad del precursor ingerido o producido en la piel.
En cambio la producción renal del calcitriol –es decir del metabolito activo- es debida a la activación de la enzima 1-alfa- hidroxilasa, fuertemente regulada por los niveles de PTH y por la hipofosfatemia, por lo que -por ejemplo- una prolongada exposición al sol aumenta los niveles de 25-hidroxi-colecalciferol, pero no los de 1-alfa-25, dihidrocolecalciferol, que depende de su regulación por la parathormona.
Este último metabolito –denominado calcitriol- es mil veces más afín al receptor que su precursor, lo que explica su gran potencia. Su receptor, llamado VDR – al igual que el de los esteroides y el de la hormona tiroidea- es intracelular y al ser activado forma un complejo con el receptor del retinoide X que también es citosólico, y el heterodímero formado (1,25(OH)2 D3-VDR) se liga al ADN con su dominio fijador de ADN, funcionando como factor de transcripción para modular la expresión genética de proteínas transportadoras de calcio. Estos receptores están presentes en varios tejidos, pero particularmente en el intestino, hueso y riñón.
La acción de la vitamina D es predominantemente sobre el intestino delgado, favoreciendo la absorción del calcio por la acción de proteínas como la calbindina-D, que lo hace por difusión facilitada: liga el calcio en el borde en cepillo (superficie luminar) que se incorpora a través de los canales del calcio o transportadores, posteriormente ocurre el traslado del complejo calbindina-D calcio a la membrana basal, donde se transfiere el ion calcio a una bomba Ca-ATPasa que lo lleva a la circulación.
También induce la producción de la fosfatasa alcalina, la CaATPasa de baja afinidad, la actina del borde en cepillo, la calmodulina y las proteínas del borde en cepillo de 80 a 90 Kda. Otros efectos –de menor importancia fisiológica- son los de inducir la expresión de osteocalcina y suprimir la síntesis de colágeno tipo I, estimulando en cultivos celulares la diferenciación de los osteoclastos.
También favorece la absorción de magnesio y de fosfato y la reabsorción tubular de calcio y fosfato. En intoxicación crónica -por ingesta de dosis altas de suplementos- aumenta la reabsorción ósea en presencia de parathormona, tiene una acción fosfatúrica -al igual que la parathormona- y produce hipercalcemia e hipofosfatemia.
Diferencias principales entre vitamina D y PTH
- Para un nivel dado de calcio plasmático, el fosfato cae más y la excreción de calcio por la orina aumenta menos con la PTH que con la vitamina D.
- El tiempo de acción de la vitamina D es más prolongado que el de la PTH.
- La fosfaturia se acompaña con pérdida de potasio con la PTH pero no con la vitamina D.
Calcitonina
Es una hormona polipeptídica producida por las células intersticiales o para-foliculares de los acinis tiroideos. Se segrega ante la hipercalcemia y su acción se realiza aún en ausencia de PTH y vitamina D. tiene acción a nivel de hueso con un efecto antiosteolítico.
Baja la calcemia, la fosfatemia y disminuye la excreción urinaria de ambos minerales. Es producida patológicamente en los carcinomas medulares de tiroides. Aunque su efecto anti-reabsortivo está comprobado en su uso terapéutico para ciertas patologías, su papel fisiológico es menor, si es que lo tiene.
Receptor sensor del calcio extracelular
El clonaje de los receptores de PTH y calcitriol ha ayudado a dilucidar mejor los mecanismos celulares involucrados en la rama eferente de la regulación del calcio extracelular. Precisamente fue de paratiroides bovinas de donde se aisló la secuencia de ADN que codifica el receptor denominado sensor del calcio extracelular.
Con este receptor de membrana que pertenece a la familia de las proteínas G, interactúa el calcio ionizado actuando como si fuera una hormona; al activarse activarse, genera los segundos mensajeros DAG e IP3, inhibe la adenilciclasa y por consiguiente disminuye la concentración intracelular de AMPc.
El clonaje del gen para este receptor ha mostrado un mecanismo que permite la liberación de PTH en respuesta al calcio por parte de la glándula paratiroides y la regulación de la reabsorción tubular de calcio medida por el propio Ca ionizado, que juega importante papel en la homeostasis normal del calcio.
Afecta pues directamente la síntesis y secreción de la PTH y de la calcitonina. El receptor se expresa también en células del epitelio renal, en osteoblastos, en varias células hematopoyéticas, en la mucosa gastrointestinal que incluye –curiosamente- su presencia en células epiteliales escamosas del esófago.
METABOLISMO ÓSEO
Anatomía e histología del Hueso
 El esqueleto es un sistema altamente especializado que de manera muy dinámica se regenera continuamente. Contiene células –osteoblastos, osteoclastos, osteocitos y células de lineamiento- matriz de tejido conjuntivo mineralizada y no mineralizada, y varios espacios como el correspondiente a la medula ósea, canales para los vasos sanguíneos, canalículos y lagunas.
El esqueleto es un sistema altamente especializado que de manera muy dinámica se regenera continuamente. Contiene células –osteoblastos, osteoclastos, osteocitos y células de lineamiento- matriz de tejido conjuntivo mineralizada y no mineralizada, y varios espacios como el correspondiente a la medula ósea, canales para los vasos sanguíneos, canalículos y lagunas.
Un proceso de modelación – que con el fin de lograr su forma y tamaño finales esculpe el hueso removiendo tejido de un lado para depositarlo en otro- se realiza durante el crecimiento y desarrollo.
La regeneración del esqueleto ya maduro se llama remodelación, en el cual se reemplaza hueso viejo por nuevo, pero en el mismo sitio; cada década disponemos de un esqueleto completamente regenerado. El 70% del tejido óseo está constituido por cristales inorgánicos de hidroxi-apatita y el 30% por matriz orgánica u osteoide, constituido fundamentalmente por colágeno (rico en hidro-prolina, prolina y glicina).
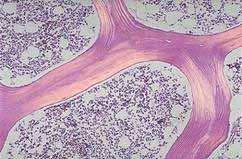
La estructura macroscópica del hueso se divide en esponjosa –localizada en las metáfisis de los huesos largos- constituida por finas espículas óseas denominadas trabéculas y cortical -hueso compacto- localizada en la corteza y diáfisis de los huesos largos. El hueso está envuelto por el periostio (excepto la porción intra-articular, que está cubierta por la membrana sinovial o por cartílago), mientras que en la superficie interna se encuentra el endostio. La figura 1 muestra las espículas de un hueso vertebral y la medula ósea.
El hueso compacto constituye la mayor parte de la diáfisis de los huesos largos así como de la parte externa de todos los huesos, sirviendo de protección y soporte.
A nivel de organización, la unidad estructural del hueso se llama ostión o Sistema de Havers; esta es una estructura irregular , cilíndrica, con ramificaciones; usualmente tiene la dirección del eje largo del hueso y tiene un canal central o canal haversiano, alrededor del cual hay capas fibrilares concéntricas, dentro de la matriz fibrilar están las lagunas, dentro de las que están los osteocitos, comunicadas entre sí por canalículos, a través de los cuales hay transporte de líquidos y que sirven de comunicación entre el hueso y los líquidos corporales
Los canales de Havers están conectados con otros llamados de Volkmann, que perforan el periostio. Ambos canales son utilizados por los vasos sanguíneos, linfáticos y nervios para extenderse por el hueso. Las restantes láminas entre ostiones se llaman láminas intersticiales.
A diferencia del compacto, el hueso esponjoso no contiene ostiones, es el principal constituyente de las epífisis de los huesos largos y del interior de muchos huesos. Las trabéculas son la parte más activa metabólicamente y están recubiertas por una membrana endóstica altamente celular compuesta de osteoblastos, los cuales elaboran osteoide y la enzima fosfatasa alcalina; los osteoblastos son responsables de la formación de hueso, y al terminar esta función se convierten en osteocitos que se encargan del mantenimiento óseo.
Durante la osteólisis, la membrana celular osteoblástica que cubre las trabéculas se rompe y las células se agrupan formando los osteoclastos, células multinucleadas. La membrana endóstica regula el metabolismo óseo y se encarga de la nutrición del órgano.
Tipos de células óseas
Osteoprogenitoras
No especializadas derivadas del mesénquima, se encuentran en la capa interna del periostio, en el endostio y en los canales del hueso que contienen los vasos sanguíneos. A partir de ellas se generan los osteoblastos y los osteocitos
Osteoblastos
Células de forma cúbica, citoplasma basófilo y ricas en una isoenzima específica de la fosfatasa alcalina. Los pre-osteoblastos son células madre mesenquimales multipotenciales, de donde también se originan las células del estroma medular óseo, condrocitos, miocitos y adipositos, y se hallan en contacto directo con las superficies óseas formando grupos compactos de una sola capa de espesor.
Sintetizan el componente orgánico de la matriz ósea (colágeno tipo I, proteoglicanos, proteínas implicadas en la adhesión celular, osteocalcina y factores de crecimiento) y controlan el depósito de las sales minerales.
El factor sistémico más potente que induce la diferenciación y proliferación de los osteoblastos es la hormona paratiroidea (PTH), pues poseen receptores para ella; sin embargo, algunos de los efectos de la hormona son probablemente mediados por factores locales. Los osteoblastos pasan sucesivamente por tres estadios funcionales:
 Proliferación celular y síntesis de los componentes orgánicos de la matriz ósea
Proliferación celular y síntesis de los componentes orgánicos de la matriz ósea- Maduración de la matriz ósea
- Depósito de mineral.
- A medida que segregan los materiales de la matriz ósea, esta los va envolviendo, convirtiéndolos en osteocitos
Osteocitos
Son células óseas maduras derivadas de los osteoblastos que constituyen la mayor parte del tejido óseo. Al igual que los osteoblastos han perdido la capacidad de dividirse.
Los osteocitos no segregan materiales de la matriz ósea y su función es la mantener las actividades celulares del tejido óseo como el intercambio de nutrientes y productos de desecho.
Osteoclastos
Son células multinucleadas de citoplasma acidófilo y ricas en anhidrasa carbónica y fosfatasa ácida resistente al tartrato; derivados de la célula madre hematopoyética de la línea monocito/macrófago, se asientan sobre la superficie del hueso y proceden a la destrucción de la matriz ósea (reabsorción ósea).
En el desarrollo de los osteoclastos participan varias citoquinas, como IL-1, IL-3, IL-6, IL-11, el factor inhibidor de la leucemia, oncostatina M, factor neurotrópico ciliar, TNF, GM-CSF, M-CSF, siendo inhibido dicho desarrollo osteoclástico por la IL-4, IL-10, IL-18 e interferon.Los osteoclastos reabsorben el hueso en dos fases.
Primero solubilizan el mineral y luego digieren la matriz orgánica y son activados por interacciones entre integrinas, selectinas y cadherinas y proteínas transmembrana (Ver figura 2).
Metabolismo óseo – Funcionamiento
Durante la osteólisis o reabsorción ósea se forma una cavidad endocondrial o membranosa de la cual se remueve tanto la matriz como la parte mineral óseas.
Después de varios meses este proceso destructivo cesa y se empieza a formar un nuevo ostión con la elaboración de capas concéntricas de osteoide, que crecen hacia adentro del ostión, haciendo el canal haversiano cada vez más estrecho; esta matriz ósea es originalmente descalcificada y permanece así de cuatro a ocho días.
Luego, debido a un cambio en la matriz, esta empieza a calcificarse; al ser desplazada el agua del osteoide, la rata de calcificación disminuye. Una vez que el hueso se calcifica completamente, empieza de nuevo la osteólisis, inicalmente llevada a cabo por osteocitos maduros y luego por osteoclastos.
 Sabemos que la masa ósea alcanza su máximo pico aproximadamente 10 años después que se ha terminado su crecimiento lineal, inicia su caída alrededor de los 40 años y alcanza su máximo pico de disminución alrededor de los 80 años.
Sabemos que la masa ósea alcanza su máximo pico aproximadamente 10 años después que se ha terminado su crecimiento lineal, inicia su caída alrededor de los 40 años y alcanza su máximo pico de disminución alrededor de los 80 años.
El pico de masa ósea máximo se alcanza alrededor de los 30 años y es menor en las mujeres que en los hombres y de éstos más bajo en las personas de raza blanca, presentando una fase acelerada de pérdida entre los primeros 5 a 10 años después de la menopausia, siendo más rápida en las que han presentado una menopausia precoz, tanto en forma espontánea como inducida.
Se ha estimado que las mujeres perderán el 35% de su hueso cortical y el 50% del trabecular, mientras que los hombres solamente dos tercios de estos valores. La mitad de estas pérdidas de hueso trabecular estaría relacionada con la menopausia y el resto con factores inherentes al mismo proceso de envejecimiento. Aún permanece controvertido identificar el momento en el cual se inicia la pérdida ósea, siendo similar para los dos tipos de hueso (Figura 3).
El proceso de remodelamiento ocurre en paquetes pequeños (unidades multicelulares básicas o BMU) en todo el esqueleto, pero la que ocurre en cada paquete está anatómica y cronológicamente separada una de otra, por control local de factores autocrinos o paracrinos generados en el micro ambiente óseo. La resorción ósea osteoclástica es seguida por la formación ósea osteoblástica.
La formación del nuevo hueso – unidad ósea estructural- se debe a señales de estímulo producidas por células locales en el mismo ambiente del osteoclasto, que atraen osteoblastos al sitio de reabsorción e inician la reparación (quemotaxis, proliferación y diferenciación de oteoblastos, mineralización del hueso y finalización de la actividad osteoblástica).
La interleucina-1 es responsable en la fase inicial estimuladora de la resorción osteoclástica, reacción que es mediada en parte por prostaglandinas.
Estadísticas vitales de la remodelación ósea adulta
(Adaptado de Manolagas)
- Vida media de la BMU: 6 a 9 meses
- Volumen óseo reemplazado por una BMU: 0.025 mm3
- Vida media de un osteoclasto: dos semanas
- Vida media de un osteoblasto: tres meses
- Intervalo de tiempo entre dos remodelaciones del mismo sitio: dos a cinco años
- Regeneración esquelética: diez por ciento anual
METABOLISMO MINERAL
Calcio.
El cuerpo de un adulto contiene aproximadamente un poco más de un kilo de calcio, 99% dentro de los cristales de hidroxi-apatita presentes en los huesos. Alrededor de un gramo se encuentra en los líquidos extra-celulares y a pesar del enorme depósito de calcio en el tejido óseo, de las amplias variaciones en ingesta y excreción, la cantidad de calcio ionizado se mantiene constante por el control logrado por sistemas hormonas calcio tróficos.
El calcio en el plasma de presenta en tres estados, un 46% ligado a proteína (principalmente albúmina), que sube y baja de acuerdo con la concentración plasmática de proteínas totales y no tiene actividad biológica.
El 54% restante está formado por el calcio ionizado –biológicamente activo- y una pequeñísima fracción correspondiente a calcio ligado a aniones monovalentes del tipo fosfato, citrato, etc. que además de ser inactivo no es capaz de reabsorberse a nivel del túbulo renal, por lo que se pierde en la orina.
La absorción del calcio es primordialmente en el duodeno y parte alta del yeyuno; se aumenta por la vitamina D y también cuando hay hipocalcemia, se administra parathormona, cuando el medio intestinal es ácido, en presencia de hormona del crecimiento o de cantidades adecuadas de fosfato en la dieta; un exceso de fosfato inorgánico no digerible, álcali, cortisol y exceso de ácidos grasos, disminuyen su absorción.
Al ingerir un gramo de calcio se segregan 600 mg en los jugos intestinales, se absorben 700 y se pierden en las heces 900 mg, dando un ingreso neto de 100 mg de calcio.
Después de absorberse se incorpora al pool extra-celular, manteniénd0se en constante intercambio con el hueso, filtrado glomerular y líquido intra-celular. El filtrado glomerular excreta unos 10 g de calcio, pero un 99% de este se reabsorbe, perdiéndose sólo 100 mg en la orina de 24 horas; la excreción e mayor si los niveles plasmáticos suben, pero aun en hipercalcemias severas, la calciuria rara vez pasa de 500 mg diarios.
Los efectos del calcio sobre los procesos celulares son por lo menos de dos clases. El primero, la disminución de la permeabilidad celular por reducción en el flujo de sustancias iónicas y no iónicas a través de las membranas; la hiper-calcemia disminuye entonces el intercambio de sodio por potasio a nivel celular (como en la reabsorción tubular de sodio), lo mismo que la acción de la vasopresina; la hipo-calcemia aumenta la permeabilidad celular y la excitabilidad neuro-muscular, dando lugar la tetania.
Una segunda acción del calcio es la de unir la excitación con la contracción muscular. Al despolarizarse la membrana por un aumento en el potasio extra-celular, hay una liberación del calcio ligado a la membrana, que activa el proceso de contracción, acción que se antagoniza por el magnesio.
El calcio sirve de puente a la acetil-colina para unir el estímulo y la secreción glandular, y esta a su vez entra a las células de la medula suprarrenal para activar la secreción de catecolaminas. El calcio aumenta la secreción de ácido clorhídrico en el estómago, influye en las acciones del ACTH en la corteza suprarrenal y de la vasopresina en el túbulo contorneado distal.
El potasio y magnesio antagonizan varios efectos del calcio sobre la membrana celular, alterando la hidrólisis del ATP, de ahí que la administración de calcio endovenosos revierta los efectos electrocardiográficos de la hipercalemia.
Fósforo
El plasma y los tejidos blandos contienen del 10 al 20% del fósforo en el organismo y el resto está en los huesos, en forma de cristales de hidroxi-apatita (fosfato tri-cálcico e hidróxido de calcio, combinados). Una tercera parte del fosfato plasmático es inorgánico y el resto son fosfolípidos. En los tejidos, la concentración de ésteres fosfóricos es mucho mayor que en el plasma. La absorción intestinal de fósforo se facilita con la absorción de calcio, e indirectamente e aumenta por la vitamina D.
La excreción y depuración de fosfato en el riñón depende de factores como niveles séricos, rata de la filtración glomerular, reabsorción tubular y posiblemente secreción tubular., factores que pueden ser modificados por la parathormona y la vitamina D.
Patologías Hormonas Calciotróficas y Metabolismo Óseo
Los adenomas paratiroideos son la causa del hiperparatiroidismo primario (y de la osteitis fibrosa quística generalizada de von Recklinghausen) y la falla renal crónica, la del hiperparatiroidismo secundario.
El hipoparatiroidismo primario es una enfermedad familiar rara que cursa con hipocalcemia con PTH baja, y el secundario resulta de la remoción quirúrgica de las paratiroides, usualmente como una complicación de la tiroidectomía.
El pseudo-hipo (con anticuerpos a los receptores de PTH) tienen hipocalcemia y PTH alta. El carcinoma medular de tiroides cursa con niveles altos de calcitonina como marcador tumoral, pero sin hipocalcemia.
El uso crónico de dosis altas de vitamina D lleva a un cuadro de intoxicación, con severa hipercalcemia. La deficiencia de vitamina D causa raquitismo en los niños y osteomalacia en los adultos.
Efectos clínicos de los trastornos de la calcemia
Hipocalcemia
- Tetania clínica, con espasmo carpo-pedal, convulsiones
- Tetania latente
* Parestesias
* Aumento de la irritabilidad neuro-muscular (signos de Chvostek y Trousseau positivos) - Cataratas metabólicas
- Prolongación del espacio QT
- Acortamiento de los espacios RR
- Disminución de la contractilidad cardiaca
- Atenuación de los efectos digitálicos
- Síntomas tetánicos atenuado por hipocalemia
- Tetania latente en alcalemia causada por hiperventilación, por caída en el calcio ionizado
- En hipocalcemia total asociada con retención de fosfatos (como se ve en la insuficiencia renal crónica) no hay tetania, en parte también por la acidosis
Hipercalcemia
- Síntomas gastro-intestinales (anorexia, náuseas, vómito, dolor abdominal, estreñimiento)
- Síntomas neuromusculares (hipotonía, estupor, coma)
- Cambios electrocardiográficos opuestos a los de la hipocalemia (acortamiento del QT, aumento en los espacios RR).
Enfermedades que cursan con hiperfosfatemia
Acromegalia
- Falla renal
- Coma diabético no tratado
- Hipo-paratiroidismo
- Hipogonadismo
Enfermedades que cursan con hipofosfatemia
- Hiper-paratiroidismo primario
- Avitaminosis D (raquitismo y osteomalacia)
- Disfunciones tubulares
- Intoxicación por vitamina D
Algunas causas de pérdida ósea y de aparición de osteoporosis
- Edad (disbalance entre reabsorción y formación de hueso)
- Déficit de estrógenos
- Exceso de glucocorticoides
- Hipertiroidismo
- Alcoholismo
- Inmovilización prolongada
- Hipercalciuria
- Tabaquismo
- Trastornos gastro-intestinales
- Algunos cánceres
- Exceso de cafeína
- Factores genético-familiares
- Estructura corporal
- Raza blanca
Terapéutica – Hormonas Calciotróficas y Metabolismo Óseo
 El manejo del hiperparatiroidismo primario es quirúrgico, por resección del adenoma paratiroideo. El del hiperparatiroidimo secundario de los renales crónicos es con calcitriol y el hipoparatiroidismo se trata con calcio y vitamina D.
El manejo del hiperparatiroidismo primario es quirúrgico, por resección del adenoma paratiroideo. El del hiperparatiroidimo secundario de los renales crónicos es con calcitriol y el hipoparatiroidismo se trata con calcio y vitamina D.
La enfermedad de Paget se maneja con calcitonina, y la osteoporosis, con medidas preventivas, ejercicio, dieta, suplencia de calcio y vitamina D, terapia hormonal de suplencia y bisfosfonatos
(Figura 4. La radiografía muestra cuello de fémur osteoporótico).
Historia de las Hormonas Calciotróficas y Metabolismo Óseo
 Desde que Courtial descubrió en 1709 los cambios óseos de la osteitis fibrosa quística y Steinheim definió la tetania por hipoparatiroidismo en 1830, muchos hallazgos clínicos y de laboratorio empezaron lentamente a observarse.
Desde que Courtial descubrió en 1709 los cambios óseos de la osteitis fibrosa quística y Steinheim definió la tetania por hipoparatiroidismo en 1830, muchos hallazgos clínicos y de laboratorio empezaron lentamente a observarse.
Erb, Trousseau y Chvostek describieron signos de la tetania hipocalcémica, Virchow encontró en el hombre las glándulas paratiroides (1863), Erdheim (1906) describe hiperplasia de las paratiroides en casos de raquitismo y osteomalacia, JB Collip llama parathormona a un extracto muy activo de tejido paratifoideo en 1925.
Dubois un año después empieza a estudiar el metabolismo del calcio del capitán de mar Charles Martell –quien sufría hiperparatiroidismo primario- que Fue sometido a la primera paratiroidectomía, y al año siguiente Cushing y Davidoff describen un paciente con adenomas endocrinos múltiples.
Pero no fue sino hasta 1929 cuando la fisiología paratiroidea empieza a hacer su aparición con estudios como los de Fuller Allbright quien describió la teoría renal de la acción –fosfatúrica- de la PTH y Koltz en 1933 usa el AT-10 (dihidrotaquisterol) para tratar la tetania.
Collip –en 1934- muestra el efecto histológico directo de los extractos paratifoideos sobre los huesos en los animales nefrectomizados y Patt en 1942 demuestra que los niveles de calcio regulan la secreción de PTH.
En 1948 Barnicot mostró que el injerto de tejido paratifoideo adyacente al hueso tiene un efecto descalcificante local y directo y tres años más tarde Chang comprende las relaciones entre el calcio, la PTH y la vitamina D.
En 1962 Copp descubre la calcitonina. Pearse –estudioso del sistema APUD- acuña el término de células C del tiroides, productoras de la anterior hormona.
Luego Neer estudia la calcio-cinética con métodos radiactivos y Reiss mide PTH por radioinmuno-análisis; en 1970 Brewer informa la secuencia de aminoácidos de la PTH bovina, y Boyle y De Luca, la síntesis renal de la 1 alfa, 25, dihidroxicolecalciferol, una nueva hormona y en 1971 Aus demuestra que la acción de la PTH se hace a través del segundo mensajero AMPc.
Referencias
- Ardila E. Epidemiología y patogénesis de la osteoporosis. Rev Col Menop 1997.3: No.1. encolombia.com
- Brown EM. Extracellular Ca2+ sensing, regulation of parathyroid cell function, and role of Ca2+ and other ions as extracellular (first) messengers. Physiol Rev 1991; 71:371-411.
- Iglesias-Gamarra A y cols. Enfermedades metabólicas del hueso (Tomos I y II), 900 páginas. Instituto Nacional de Salud, Bogotá, 1992.
- Iglesias-Gamarra A. Del raquitismo a la vitamina D. 2004 (en prensa).
- Jácome-Roca A. Cronología histórica de las paratiroides. Rev Soc Col Endocrinol 1982. 13. 88-93.
- Ramírez J, Jácome A y cols. Problemas diagnósticos del hiperparatiroidismo primario, presentación de cinco casos. Acta Méd Col 1980. 5:395-406.
- Manolagas SC et al. Sex Steroids and Bone. Recent Prog Horm Res, 2002; 57(1): 385 – 409.
- Manolagas SC. Birth and death of bone cells, basic regulatory mechanisms and implications for the pathogenesis and treatment of osteoporosis. Endocr Rev 2000; 21:115-137.
- Negri AL. Receptor – Censor de calcio extracelular: su rol en la homeostasis mineral Rev. Nefrol. Diál. y Transpl., N° 43 – Septiembre 1997, Pág. 13-18
- Riggs BL, Khosla S, Melton LJ. Sex Steroids and the Construction and Conservation of the Adult Skeleton. Endocr Rev, 2002; 23(3): 279-302.
- Sutton ALM, MacDonald PN. Vitamin D: More Than a “Bone-a-Fide” Hormone. Molec Endocrinol 2003; 17 (5): 777-791.
- Strewler GH. The physiology of parathyroide hormone-related protein. N Eng J Med 2000. 342: 177-185.
 Proliferación celular y síntesis de los componentes orgánicos de la matriz ósea
Proliferación celular y síntesis de los componentes orgánicos de la matriz ósea