Glándula Tiroides Fisiología
Autor: Alfredo F Jácome-Roca, MD, FACP
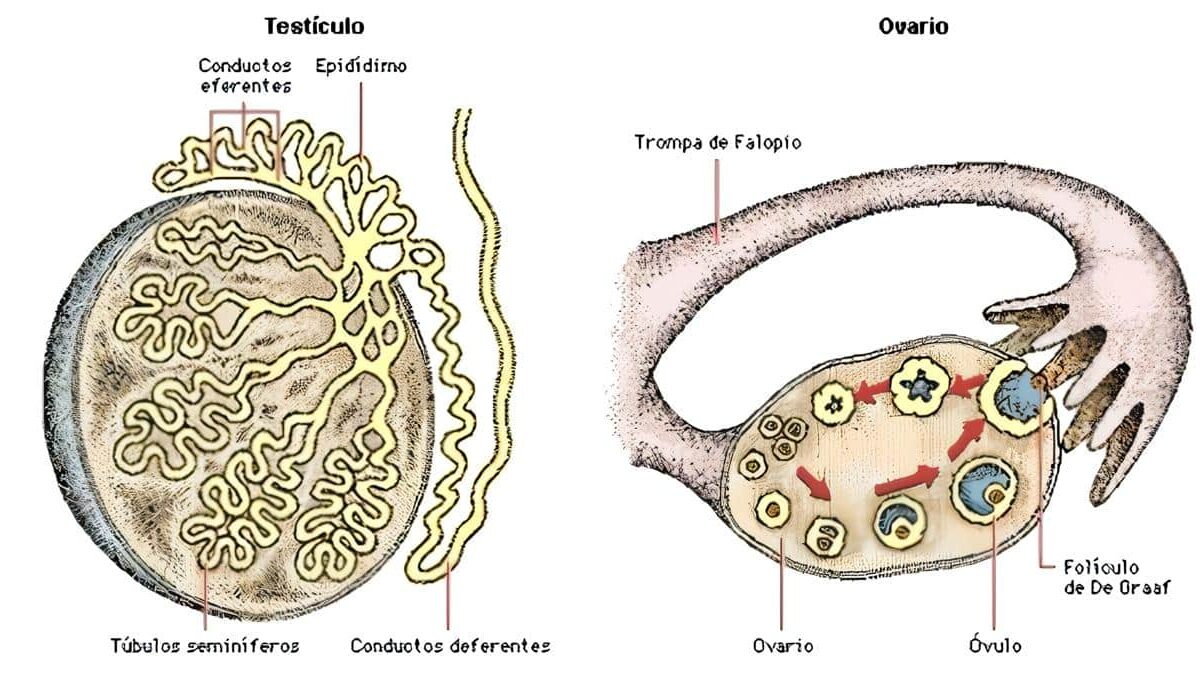
La fisiología de la glándula tiroides. Es uno de los órganos endocrinos más grandes, pues tiene un peso promedio de 20 gramos. Se encuentra localizada en la parte anterior e inferior del cuello, sobre los aspectos anteriores y laterales de la tráquea.
Tiene forma de mariposa, aunque los antiguos le veían forma de escudo o “tiroides”, en griego.
Consta de un lóbulo derecho, un poco más grande, y otro izquierdo, unidos entre sí por un istmo; en ocasiones puede observarse un lóbulo piramidal que sale de dicho istmo y es un resto del canal tirogloso. Este se desarrolla a partir de la base de la lengua, en el foramen cecum y se forma hacia la 5ª. o 6ª. semana del desarrollo embrionario.
Las estructuras cercanas a la glándula tiroides son el nervio recurrente laríngeo y las cuatro glándulas paratiroides, que deben ser identificadas por el cirujano durante la tiroidectomía.
(Ver capítulo completo en el Capítulo 4 del libro FISIOLOGÍA ENDOCRINA en la librería virtual encolombia.com)
Islotes Pancreáticos
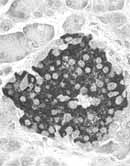 El páncreas (palabra griega que significa todo carne) es una glándula elongada anexa al aparato digestivo, anidada alrededor del duodeno, con una función digestiva exocrina y una función endocrina basada en los islotes de Langerhans (Figura 1).
El páncreas (palabra griega que significa todo carne) es una glándula elongada anexa al aparato digestivo, anidada alrededor del duodeno, con una función digestiva exocrina y una función endocrina basada en los islotes de Langerhans (Figura 1).
De los cincuenta a setenta y cinco gramos que pesa el páncreas, sólo un gramo corresponde a tejido insular; en la histología convencional, los islotes se ven como grupos de células relativamente pálidas diseminadas por el tejido exocrino que se tiñe de oscuro.
El número de islotes va de un cuarto de millón a un millón y tres cuartos, su diámetro aproximado es de ciento cincuenta micras y son más numerosos hacia la cola del páncreas.
Aunque se encuentran distribuidos por todo el órgano. Hay tres tipos de células:
- El sesenta a noventa por ciento de las células corresponden al tipo beta, productoras de insulina
- La mayoría de las demás son alfa, productoras de glucagón
- Otro pequeño porcentaje está representado por las delta, productoras de somatostatina.
Este órgano endocrino produce las hormonas tiroideas tiroxina (T4) y triyodotironina (T3) que intervienen en la regulación del crecimiento y desarrollo, en el metabolismo celular y en la producción de calor o termogénesis.
Anatomía e Histología
La glándula tiroides es uno de los órganos endocrinos más grandes, pues tiene un peso promedio de 20 gramos. Se encuentra localizada en la parte anterior e inferior del cuello, sobre los aspectos anteriores y laterales de la tráquea.
Tiene forma de mariposa, aunque los antiguos le veían forma de escudo o “tiroides”, en griego.
Consta de un lóbulo derecho, un poco más grande, y otro izquierdo, unidos entre sí por un istmo; en ocasiones puede observarse un lóbulo piramidal que sale de dicho istmo y es un resto del canal tirogloso. Este se desarrolla a partir de la base de la lengua, en el foramen cecum y se forma hacia la 5ª. o 6ª. semana del desarrollo embrionario.
Las estructuras cercanas a la glándula tiroides son el nervio recurrente laríngeo y las cuatro glándulas paratiroides, que deben ser identificadas por el cirujano durante la tiroidectomía.
Acinis Glandulares o Folículos
Histológicamente la tiroides está formada por acinis glandulares o folículos, los cuales serán irrigados por una red capilar muy rica; la pared del folículo está compuesta por una sola hilera de células epiteliales cuboidales, las cuales reposan sobre una membrana basal compuesta por mucopolisacáridos; el interior del folículo está lleno de un líquido claro y proteinàceo, llamado coloide acinar, el cual constituye la mayor parte de la masa tiroidea.
El coloide contiene tiroglobulina, una proteína grande que pesa aproximadamente 650.000 MW, la cuál sirve de transporte y bodega de las hormonas tiroideas durante su síntesis y al final de esta; la tiroglobulina es TSH- dependiente.
Entre 20 y 40 de estos folículos forman un lobulillo, irrigado por sangre arterial y separado de los demás lobulillos por tejido conectivo.
Entre los folículos se encuentran importantes células endocrinas pertenecientes al sistema APUD, denominadas células C o parafoliculares, que producen calcitonina, una hormona calciorreguladora.
La irrigación de la tiroides está hecha por las arterias tiroideas superior e inferior; es excepcionalmente bien vascularizada, teniendo un flujo sanguíneo que varia entre 4 y 6 ml por gramo de tejido tiroideo y por minuto, el cual es casi el doble del flujo renal.
Esto tiene importancia fisiológica en lo que respecta a la capacidad para concentrar yodo (Figura 1).
Regulación fisiológica
Un mecanismo de retroalimentación negativo hace que niveles aumentados de T4 libre (transformados en hipófisis e hipotálamo a T3), frenen la producción de TSH y también de la TRH u hormona liberadora de la tirotrofina.
 Figura. Eje hipotálamo-Hipófisis-Tiroides
Figura. Eje hipotálamo-Hipófisis-Tiroides
El primer mecanismo resulta más importante pero un aumento de la TRH (que viaja por el sistema porta venoso del tallo hipofisiario) estimula la producción, tanto de la TSH como de la Prolactina.
La TSH se fija a receptores localizados en las células epiteliales tiroideas, de esta manera favoreciendo la síntesis de la bomba de sodio o transportadora de yoduro, la peroxidasa tiroidea y la tiroglobulina; el aumento de la endocitosis epitelial tiroidea por la tirotropina también aumenta la liberación de hormona tiroidea en la circulación.
Metabolismo extratiroideo del yodo.
La formación de hormonas tiroideas depende de un suministro adecuado de yodo; aunque hay mecanismos que garantizan la extracción máxima de yodo de la sangre para efectos de la tiroxinogènesis, en caso de deficiencias de yodo de larga data, estos pueden fallar.
El balance de yodo es mantenido por la ingesta de este halògeno, el cuàl viene en los alimentos y el agua, pero especialmente en la sal yodada; otra fuente es la administración de medicamentos o medios de contraste yodados.
En países como los Estados Unidos, la dieta corriente contiene unos 500 microgramos diarios, mientras que en Japón, esta cantidad es más alta y en otras regiones más baja.
La distribución de yodo en el organismo varía de acuerdo con el espacio o tejido en que se encuentra. Así, después de la transformación del elemento yodo en el Ion yoduro, en el intestino delgado se produce su absorción (unos 500 mcg diarios); la mitad pasa al líquido extracelular.
Hay una remoción constante del yoduro plasmático, que ingresa o reingresa al tiroides en un 20% (diariamente capta 120 y devuelve 60 mcg, el cual se origina de la dehalogenaciòn de las tirosinas).
Un 77% se elimina por la orina (un promedio de 488 mcg diarios) -aunque una buena cantidad se reabsorbe pasivamente por los tùbulos renales- y un 3% (12 mcg) por las heces.
El total de hormona tiroidea en sangre (particularmente tiroxina), contiene 600 mcg de yodo. 8 mg del halógeno se encuentran en la glándula, el sitio de mayor concentración. Esta es misma cantidad se encuentra en una gota de solución de Lugol, mientras que otra de solución saturada de yoduro potásico contiene 50 mg.
Tiroxino-gènesis y secreción de las hormonas tiroideas
La síntesis de las hormonas tiroideas ocurre en cuatro etapas sucesivas:
1. Atrapamiento del yodo. Trasporte activo del Ion yoduro dentro de la tiroides.
2. Organificaciòn. El yoduro se oxida a yodo y se produce una yodinaciòn de los residuos tirosìlicos dentro de la molécula de tiroglobulina, para dar lugar a las yodotirosinas (MIT y DIT), que no tienen acción hormonal.
3. Acoplamiento de las yodotirosinas, para formar las hormonas tiroideas triyodotironina (T3) y tiroxina (tetrayodotironina o T4).Dentro del coloide acinar, estas hormonas se encuentran ligadas a la tiroglobulina por enlaces peptìdicos.
4. Proteòlisis de la tiroglobulina y liberación o paso a la sangre de las hormonas tiroideas.
Atrapamiento de yodo.- La entrada de yodo al tiroides es un proceso activo en el que interviene la hormona tirotropa (TSH), y que requiere la hidrólisis de ATP. La concentración de yodo en la glándula es unas 20 a 40 veces mayor que en el plasma, lo que se denomina gradiente tiroides- suero.
Una rápida oxidación del yodo o su devolución al plasma sucede de inmediato, yodo inorgánico que en este momento constituye menos del 1% del total que hay en la tiroides.
Es un “pool” de yodo fácilmente intercambiable, ante la administración de gran cantidad de yodo al organismo. Un segundo “pool” de yodo inorgánico no intercambiable está constituido por el proveniente de la deyodinaciòn de las yodotironinas.
Ante el estímulo de la glándula con TSH o la administración de una dieta baja en yodo, o si se bloquean con drogas los pasos posteriores de la tiroxinogènesis, se ensancha notablemente el “pool” de yodo fácilmente intercambiable, por lo que el gradiente tiroides- plasma puede llegar a pasar de varios cientos.
Membrana Basolateral
Una proteína integral de membrana, situada en la membrana basolateral de las células epiteliales tiroideas se encarga de transportar activamente sodio dentro de la célula, trasportando activamente el yodo en forma secundaria.
Este transportador de sodio-yodo se conoce en inglés con el nombre de “symporter”, derivando la energía del gradiente electroquímico que sodio a través de la membrana, ya que una concentración baja intracelular se logra merced a la bomba de sodio.
Cuando hay defectos congénitos de organificaciòn (que llevan a un hipotiroidismo), la administración de iones monovalentes tipo perclorato o tiocianato llevan a un desplazamiento del yodo hacia el exterior de la glándula.
Oxidación del yodo y su organificaciòn.- Durante la oxidación, el yoduro pasa a yodo por acción de una peroxidasa, y luego por acción de esta misma enzima, usando el aminoácido tirosina y agua oxigenada proveniente de la fosforilación oxidativa mitocondrial, se organifica, formando las yodotirosinas inactivas 3-monoyodotirosina (MIT) y 3,5 diyodotirosina (DIT), las cuales se incorporan a la proteína soluble tiroglobulina y se depositan como coloide en la luz del folículo.
Estas reacciones son facilitadas por la TSH e inhibidas por las drogas antitiroideas propil-tiouracilo y metimazol.
Acoplamiento.- Por medio de la peroxidasa de la tiroides, con la pérdida de la cadena lateral de alanina en una de las moléculas de tirosina yodada y por la unión del anillo fenòlico yodado a otra molécula de yodotirosina por un puente de éter, se acoplan DIT + MIT para formar triyodotironina o T3 o DIT + DIT, para formar tiroxina o T4.
Las hormonas tiroideas se depositan dentro del folículo y se liberan de acuerdo a las necesidades.
Proteólisis y liberación.-
Por acción de la TSH, la tiroglobulina es sometida a un efecto proteolìtico que consiste en lo siguiente: las células epiteliales tiroideas ingieren coloide acinar por endocitosis, coloide que contiene tiroglobulina y T4 y T3; los endosomas –una vez llenos de coloide- se fusionan con lisosomas –que contienen enzimas hidrolìticas que digieren la tiroglobulina- y de esta manera las hormonas tiroideas son segregadas a la sangre al pasar a través de la membrana citoplásmica de la célula tiroidea.
Los yoduros bloquean esta liberación.
El 90% de la hormona liberada es T4 y 10%, T3. El 90% de la T3 circulante se produce por la deyodinación periférica (hígado y riñón) de T4 (que da también lugar a una hormona metabòlicamente inactiva llamada T3 reversa), y el restante 10% se libera directamente de la tiroides (Figura).
 Figura. Molécula de Tiroxina.
Figura. Molécula de Tiroxina.
Transporte, degradación e interacción con receptores
Más del 99% de la hormona tiroidea es transportada por medio de unas proteínas, a las que se hallan firmemente unidas. Estas tres proteínas son la TBG o “globulina fijadora del tiroides, la TTR o transtiretina, antiguamente llamada TBPA o “pre-albúmina fijadora” y finalmente está la albúmina.
En condiciones normales, un 75% de la T4 está ligada a la TBG, 10-15% a la TTR y 5-15% a la albúmina. Cuando está ligada la T4, no es activa, pero se encuentra como una depósito que puede durar entre 2 y 3 meses, con una vida media de 6.7 días en los adultos.
La TBG es la más importante de las proteínas transportadoras; producida en el hígado bajo la influencia de los estrógenos, mantiene una relación constante de T4 ligada a T4 libre, no obstante que hay situaciones que aumentan o disminuyen bien su concentración o su capacidad de fijación.
Los aumentos en la TBG pueden observarse durante el embarazo, la terapia de suplencia estrogénica y la anticoncepción hormonal, en la hepatitis infecciosa, en la cirrosis biliar o por determinación genética, lo que produce un aumento de la tiroxina total, más no de la fracción libre.
La disminución de la fijación de T4 por la TBG se da con el uso de andrógenos o esteroides anabólicos (que a veces utilizan indebidamente los atletas), dosis altas de glucocorticoides, en el síndrome nefròtico o en las hepatopatìas crónicas tipo cirrosis (por pérdida o formación disminuida de proteínas), en enfermedades sistémicas severas no tiroideas, acromegalia activa, determinación genética o uso de ciertas drogas como el difenilhidantoinato sòdico o el Tegretol.
 Figura, Adaptado de GA Brent, N Eng J Med 1994
Figura, Adaptado de GA Brent, N Eng J Med 1994
La acción es mediada por múltiples isoformas del receptor hormonal tiroideo, que son expresadas de manera diferente en varios tejidos y etapas de la vida.
Son codificados por dos genes distintos (alfa y beta) y pertenecen a una superfamilia de receptores nucleares, que también incluye receptores para otras hormonas lipofìlicas pequeñas.
Estos receptores funcionan al ligarse a secuencias que responden a las hormonas tiroideas, localizadas en promotores de los genes blanco y regulando su trascripción.
Los receptores a menudo forman heterodìmeros con los receptores de retinoide X y su función es modulada por sus regiones amino-terminales.
El receptor reprime la trascripción cuando no está ligado a la hormona tiroidea, mientras que al ligarse se cambia su conformación ocasionando la interacción de otros co-reguladores.
Como sabemos la tiroxina se transforma en triyodotironina por acción de deyodinasas a nivel celular, que hacen que esta última hormona sea la que interactúe con el receptor, excepto en el caso de la isoforma alfa-2.
Acción de las hormonas tiroideas
Aunque todas las células del organismo son potenciales órganos blanco para la acción de las hormonas tiroideas, sus principales efectos son sobre el metabolismo, el crecimiento y el desarrollo; tienen también acciones sobre el aparato cardiovascular, el sistema nervioso central y los órganos reproductores.
Muchos de estos efectos se han estudiado merced a observaciones realizadas en situaciones clínicas o de laboratorio caracterizadas por exceso o defecto de la hormona tiroidea.
Efectos sobre el metabolismo.- Aumentan el consumo de oxígeno e intervienen en la termogénesis, aumentando el metabolismo basal y la producción de calor.
Estos efectos están relacionados con el incremento en la fosforilación oxidativa mitocondrial, que genera ATPs, los que son hidrolizados por la ATPasa de membrana (o “bomba de sodio”), que activa el intercambio de sodio por potasio y libera calor.
Como la hormona tiroidea T3 interactúa con un receptor nuclear, logra aumentar la trascripción y la producción de diferentes tipos de ARNm, lo que genera síntesis de proteínas en los ribosomas.
Como incrementa la absorción de glucosa y galactosa, además de favorecer la movilización de grasa y de carbohidratos en general, aumenta la cantidad disponible de sustratos metabólicos, lo que activa el metabolismo en general.
La síntesis proteica es estimulada por efecto de las hormonas tiroides en concentraciones fisiológicas aunque cuando está elevada, el efecto es catabólico e induce pérdida de peso y disminución de la masa ósea y muscular.
La acción es permisiva en cuanto la utilización de la glucosa y la síntesis de glicógeno, y en altas concentraciones aumenta la glicemia postprandial a la hora, por aumento en la absorción.
Hipertiroidismo
La administración de tiroxina aumenta la síntesis de colesterol y de ácidos grasos pero la rata de conversión del colesterol a ácidos biliares es aún más notoria; de hecho el hipertiroidismo se caracteriza por disminución en los niveles de colesterol, mientras que en el hipotiroidismo clínico hay hipercolesterolemia.
La demanda de vitaminas en el hipertiroidismo está aumentada mientras que en la hipofunción está impedida la conversión de carotenos a vitamina A, lo que da un pigmento característico de la piel.
En estados de balance nitrogenado negativo como en la desnutrición, la transformación de T3 en T3-reversa (inactiva) está aumentada.
Efectos sobre el crecimiento y desarrollo.
Estimula en mamíferos la síntesis de hormona del crecimiento (al igual que la del cortisol), y posiblemente la producción hepática de IGF-1.
Con estas dos hormonas hace sinergia periféricamente, ya que puede aumentar el número de sus receptores. La deficiencia tiroidea en cretinos conduce a enanismo.
En cuanto al desarrollo, es claro que es necesario para el sistema nervioso, pues induce la maduración de los axones, la formación de mielina, el crecimiento de las dendritas, y hace que la diferenciación de los oligodendrocitos se haga en el momento correcto.
Los pulmones y el esqueleto también son influidos en su desarrollo; además juega un papel permisivo en la maduración sexual de mamíferos y en su reproducción; la T3 estimula la producción hepática de la globulina fijadora de los esteroides sexuales o SHBG.
En animales inferiores interviene en la descamación y en el cambio de plumas. La disfunción tiroidea se asocia con trastornos menstruales e infertilidad, y la agilidad mental también cambia en los distiroidismos.
Efectos sobre el aparato cardiovascular.
Aumentan la frecuencia cardiaca, su contractibilidad y el gasto cardiaco; promueven la vasodilatación y la hiperemia.
Todo esto aumenta el flujo plasmático renal, la filtración glomerular, aumenta la reabsorción de solutos como la glucosa y aminoácidos, al tiempo que produce aumento en el tamaño del riñón.
Contrario a lo asumido anteriormente, aunque en hipertiroidismo hay un efecto inotrópico positivo, el resultado neto es que no hay un aumento en la sensibilidad del miocito al estímulo adrenérgico, a pesar de que es clínicamente similar a un estado hiperadrenérgico; los niveles de catecolaminas en hipertiroidismo son normales o bajos.
La transcripción de los siguientes genes está regulada por el complejo receptor nuclear-T3:
- ATPasa dependiente de Ca2+ y Fosfolamban en el retículo endoplásmico
- Miosina
- Receptores beta-adrenérgicos
- Adenil-ciclasa
- Protreínas fijadoras del nucleótido guanina
- Intercambiador de Na+/Ca2+
- ATPase dependiente de Na+/K+
- Canales de potasio dependientes de voltaje
- Hay otras acciones no nucleares a nivel de membrana
La contracción sistólica y la relajación diastólica de la liberación y re-captación de calcio por el retículo endoplásmico.
Este transporte activo es regulado por el fosfolamban, que a su vez modificado por la fosforilación; los cambios en las cantidades relativas de las proteínas mencionadas y la fosforilación del fosfolamban son los responsables de la disfunción diastólica de la falla cardiaca y de la enfermedad tiroidea.
Los efectos transcripcionales y no-transcripcionales de la hormona tiroidea pueden actuar de manera conjunta para modular la función miocárdica y vascular en situaciones fisiológicas y patológicas.
No está claro si los cambios en la función cardiaca asociados a disfunción tiroidea se deben principalmente a alteración en la contractibilidad del miocardio y a modificaciones en la carga.
El aparato cardiovascular responde a cambios mínimos –pero persistentes- en la hormona tiroidea circulante, los que ocurren en personas disfunción tiroidea subclínica.
En el caso del hipertiroidismo subclínico
Se observa un aumento de la frecuencia cardiaca, arritmias auriculares, aumento en la masa ventricular izquierda, relajación ventricular alterada, capacidad reducida para el ejercicio y aumento en el riego de mortalidad cardiovascular.
El hipotiroidismo subclínico se asocia con disfunción diastólica – y una sutil disfunción sistólica- del ventrículo izquierdo, un riesgo aumentado de aterosclerosis e infarto del miocardio.
Es necesario tratar estas entidades, bien con el reajuste de la dosis de suplencia tiroidea o por beta-bloqueo, ya que todas las alteraciones cardiovasculares se revierten con estas medidas.
Hay alguna evidencia de que los pacientes con enfermedades cardiovasculares agudas y crónicas y los que van a ser sometidos a cirugía cardiaca pueden tener un metabolismo periférico de la hormona tiroidea alterado que puede contribuir a la disfunción cardiaca y que la administración de suplencia tiroidea –o del análogo ácido 3,5 –diyodo-tiro-propiónico- pueda ser benéfica.
Efectos sobre el hueso.
Tiene una acción probablemente mediada por factores de crecimiento tipo IGF-1 e IGF-2, sobre la osificación de cartílagos, crecimiento linear post-natal del hueso, maduración de los centros de osificación epifisiarios, maduración y actividad de los condrocitos.
Como habíamos mencionado, la masa ósea se disminuye con el tiempo por el efecto de dosis tóxicas sobre el receptor de T3 en los osteoblastos.
Interacción con otras hormonas.
Toda hormona que aumente el AMPc en las células tiroideas aumenta la síntesis y liberación, mientras que lo contrario ocurre con el aumento del GMPc.
El primer caso ocurre con la epinefrina y el péptido intestinal vasoactivo (VIP), mientras que el segundo con la acetil-colina. Sobre las funciones de la epinefrina ejerce una acción permisiva, aumenta el metabolismo de los glucocorticoides y de las vitaminas.
En hipotiroidismo primario, el aumento de la TRH lleva a un aumento de la prolactina en un porcentaje de casos.
La secreción de TSH (y la actividad tiroidea) se disminuyen por acción del cortisol, somatostatina y dopamina.
Patología tiroidea

El crecimiento de la glándula tiroides se llama generalmente bocio, el que puede ser difuso o nodular, puede ser endémico (en áreas con deficiencia endémica de yodo), o esporádico; algunos bocios presentan características inflamatorias-crónicas, subagudas o agudas, mientras que los nódulos pueden ser sólidos o quìsticos, únicos o múltiples, benignos (más frecuentemente) o malignos.
Desde el punto de vista endocrino sin embargo, lo más importante es la disfunción tiroidea, por exceso (hipertiroidismo) o por deficiencia (hipotiroidismo).
El hipertiroidismo se caracteriza pérdida de peso, a pesar de que la ingesta calòrica está aumentada.
Se presentan cambios neurovegetativos y de otra clase como aumento de la diaforesis y de la ingesta de agua, taquicardia (en ocasiones fibrilación auricular), temblor fibrilar en las extremidades, hiperdefecaciòn, hiperreflexia y fase de relajación rápida en el reflejo aquiliano, irritabilidad, taquipsiquia (“acelere”) y taquilalia, intolerancia al calor e hipertermia, piel sedosa, caliente y húmeda, caída del cabello, fragilidad ungueal, onicolisis, trastornos menstruales (más frecuentemente amenorrea) y presencia de bocio.
Las causas más comunes son:
1) La Enfermedad de Graves o bocio difuso tóxico asociado a exoftalmos y en ocasiones a mixedema pretibial; se trata de una enfermedad autoinmune (y psicosomática), en la cual un anticuerpo se liga a los receptores de TSH, reproduciendo su efecto.
2) Bocios multinodulares, que generalmente han estado presentes por años antes de convertirse en hiperfuncionantes.
3) Adenomas únicos autónomos (que se consideran parte de la enfermedad tiroidea autoinmune, que incluye la Enfermedad de Graves y la Tiroiditis crónica).
4) Tiroiditis subaguda de De Quervain, bocio inflamatorio doloroso que inicialmente cursa con hipertiroidismo.
5) adenomas hipofisiarios productores de TSH. 6) Tirotoxicosis factitia (por ingesta excesiva de hormonas tiroideas).
7) Struma ovarii con hipertiroidismo.
8) Mola hidatidiforme productora de una molécula similar a la TSH. (Figura. Tiroides de tamaño normal y bocio difuso).
El hipotiroidismo se llama en los adultos mixedema.
Se caracteriza por letargo, hipotermia, Hipotermia, edema palpebral y periférico (que no deja huella), estreñimiento, pérdida del cabello, trastornos menstruales, anemia, piel carotenèmica amarillenta, artralgias, y en general, los síntomas contrarios al hipertiroidismo; algunas veces existe bocio.
En los niños existe el hipotiroidismo congénito, que cuando se manifiesta clínicamente –por ausencia de tratamiento a tiempo- se denomina cretinismo, donde además de síntomas de hipotiroidismo hay otras manifestaciones como retardo mental, macroglosia, abdomen prominente y hernia umbilical, corta estatura, etc.
Las causas más comunes de hipotiroidismo son:
1) Trastorno autoinmune que hace que los anticuerpos interactúen con los receptores de TSH, pero que al no reproducir sus efectos, genera un bloqueo. La glándula se atrofia entonces.
2) Trastorno autoinmune en el que la invasión crónica de linfocitos produce bloqueo parcial de la tiroxinogènesis, generando además bocio, como se observa en la tiroiditis crónica de Hashimoto.
3) Hipotiroidismo post-ablativo (por dosis altas de yodo radiactivo o por tiroidectomía).
4) Deficiencias congénitas enzimàticas, que bloquean la formación de hormonas tiroideas.
Pueden además haber procesos inflamatorios agudos o subagudos (como en la tiroiditis de De Quervain), o procesos malignos de tipo carcinoma papilar, folicular, anaplàsico o medular, entre los más frecuentes.
Terapéutica
Los síntomas del hipertiroidismo se pueden controlar con betabloqueadores, pero el tratamiento definitivo se logra con ablación por medio del yodo radiactivo, la cirugía o un control (que puede ser transitorio, pero a veces es definitivo) con las drogas antiotiroideas metimazol o propiltiouracilo. El hipotiroidismo se trata con terapia de suplencia a base de tiroxina; los nódulos tiroideos se pueden manejar con terapia supresiva.
Nota histórica
La glándula tiroides es mencionada desde tiempos de Galeno, y aún antes.
El griego le asignaba un papel como lubricante de la laringe, aunque el nombre viene de “thyreos” que significa escudo (protector). Morgagni describió las vesículas, Lalouette describió la pirámide, Baumann descubrió la presencia de yodo. Kendall encontró la tiroxina y Harrington la sintetizó.
El estudio del bocio tiene también importancia histórica, pero el del hipertiroidismo ha generado epónimos:
Graves describió tres pacientes con bocio y palpitaciones, Basedow publicó cuatro más a los que le añadió el exoftalmos, Plummer encontró que había dos clases de bocios tóxicos, uno de ellos multinodular. Platter habló del cretinismo y Gull informó de casos de hiportiroidismo en el adulto. Hashimoto describió una clase de tiroiditis crónica.
Referencias Seleccionadas
- Braverman LE, Utiger RD. Werner and Ingbar’s The Thyroid. A fundamental and Clinical Text. 7th Edition. Lippincott-Raven, Philadelphia. 1996. Pp. 25-161.
- Brent GA. The molecular basis of thyroid hormone action. N Eng J Med 1994. 331: 847-853.
Brent GA. Thyroid hormone action, down novel paths. Am J Physiol 1999. 276: C-1012. - De Groot LJ, Larsen PR, Henneman G. The thyroid and its diseases. 6th Edition. Churchill Livingstone. New York, 1996.Pp. 491-517.
- Kogui T, Herhman JN et al. Differential regulation of the human sodium/iodide symporter gene promoter in papillary thyroid carcinoma cell lines and normal thyroid cells. Endocrinology 2001. 142: 3369-3379.
- Lazar MA. Thyroid hormone receptors, multiple forms, multiple possibilities. Endocr Rev 1993.14. 184-193.
- Surks MI, Sievert R. Drugs and thyroid function. N Eng J Med 1995. 333: 1688-1694.
Stanley BA. Thyroid hormone (lecture on physiology). www.hmc.psu.edu/core/stanley/4thyroid.pdf - Zhang J, Lazar MA. The mechanism of action of thyroid hormones. Annu Rev Physiol 2000. 62: 439-466.
- Walsh JP et al. Combined Thyroxine/Liothyronine Treatment Does Not Improve Well-Being, Quality of Life, or Cognitive Function Compared to Thyroxine Alone: A Randomized Controlled Trial in Patients with Primary Hypothyroidism J Clin Endocrinol Metab 2003 88: 4543-4550.
- Monzani, F et al. Effect of Levothyroxine Replacement on Lipid Profile and Intima-Media Thickness in Subclinical Hypothyroidism: A Double-Blind, Placebo- Controlled Study J Clin Endocrinol Metab 2004 89: 2099-2106.
- Tang HY et al. Thyroid Hormone Causes Mitogen-Activated Protein Kinase-Dependent Phosphorylation of the Nuclear Estrogen Receptor Endocrinology 2004 145: 3265-3272.
- Shih CH et al.Thyroid Hormone Receptor-Dependent Transcriptional Regulation of Fibrinogen and Coagulation Proteins Endocrinology 2004 145: 2804-2814.
- Fazio S et al. Effects of Thyroid Hormone on the Cardiovascular System Recent Prog Horm Res 2004 59: 31-50.

 Figura, Adaptado de GA Brent, N Eng J Med 1994
Figura, Adaptado de GA Brent, N Eng J Med 1994