Carcinoma de Lengua, Tratamiento
Tratamiento
Cirugía
Estado I
Resección quirúrgica endooral, con margen de 1,5 cm y biopsia por congelación intraoperatoria, de bordes de resección. Cierre primario, con colgajo de lengua.
Recomendamos disección ganglionar supraomohioidea clasificatoria ipsilateral (niveles I, II, III) debido a que 29% de los pacientes presentan metástasis ganglionares ocultas; también se recomienda en los casos de invasión muscular mayor de 4 mm, pobremente diferenciado y aneuploidia tumoral.
Se administra radioterapia complementaria cuando el informe de patología soporta márgenes de resección quirúrgica comprometidos, enfermedad ganglionar metastásica a más de un ganglio o enfermedad ganglionar extracapsular.
Estado II
Resección quirúrgica endooral con margen de 1,5 cm y biopsia por congelación intraopetatoria de los bordes de resección. El cierre puede ser primario o con colgajos locales.
Disección supraomohioidea clasificatoria ipsilateral. En pacientes T2 se encuentran metástasis ganglionares subclínicas en 43% de los casos.
Se administra radioterapia complementaria cuando el informe de patología señale márgenes de resección quirúrgica comprometidos, enfermedad ganglionar metastásica a más de un ganglio o enfermedad ganglionar extracapsular.
Estado III
En tumores T3N0 se recomienda resección combinada orocervical tipo “pull through”, margen de 1,5 cm y biopsia por congelación intraoperatoria de los bordes de resección, acompañada de disección radical modificada de cuello al grupo ganglionar V. La reconstrucción incluye múltiples opciones como cierre primario, colgajos pediculados o colgajos libres. Entre los pacientes con tumores T3, 77% presentan metástasis ganglionares ocultas.
En estados III por N1, se recomienda realizar disección radical de cuello.
Se administra radioterapia complementaria cuando el informe de patología indique márgenes de resección quirúrgica comprometidos, tumor histológicamente mal diferenciado, enfermedad gaglionar metastásica a más de un ganglio o enfermedad ganglionar extracapsular.
Estado IV
En tumores T4 N0 M0 se recomienda resección combinada orocervical tipo “pull through”, margen de 1,5 cm y biopsia por congelación intraoperatoria de los bordes de resección, acompañada de disección radical modificada tipo II (disección niveles I–V, preservando el nervio accesorio del espinal y la vena yugular interna). La reconstrucción incluye colgajos pediculados o colgajos libres.
En todo paciente en estado IV se recomienda realizar radioterapia complementaria postoperatoria.
Cualquier T N2 M0, cualquier T N3 M0: se recomienda resección combinada orocervical tipo “pull through”, margen de 1,5 cm y biopsia por congelación intraoperatoria de los bordes de resección, acompañada de disección radical clásica. La reconstrucción incluye colgajos pediculados o colgajos libres.
Cualquier T, cualquier N M1: se recomienda manejo paliativo con radioterapia. La quimioterapia puede emplearse como radiosensibilizador.
Para administrar quimioterapia se deben considerar la condición general del paciente, los efectos colaterales y la eficacia potencial.
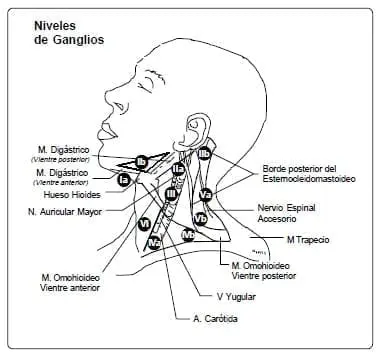
Disecciones de cuello
- Disección radical de cuello: Es el procedimiento básico estándar para la linfadenectomía radical de cuello y cualquier otro es una modificación de este procedimiento. En la disección radical de cuello se resecan los grupos ganglionares de los grupos I al V sin preservar el nervio accesorio del espinal, vena yugular ni músculo esternocleidomastoideo.
Se indica básicamente cuando hay presencia de adenopatías con compromiso extracapsular y de estructuras vecinas. - Disección radical modificada de cuello: También se conoce como disección funcional del cuello; en este procedimiento se retiran los grupos ganglionares del I al V, preservando estructuras no linfáticas como el nervio accesorio del espinal (NAE), la vena yugular (VY) y el músculo esternocleidomastoideo (MECM). Se subclasifican según las estructuras preservadas:
– Tipo I: Preservación NAE
– Tipo II: Preservación NAE, VY
– TipoIII: Preservación NAE, VY, MECM - Disección selectiva de cuello: Se practica en pacientes con cuello negativo y con riesgo de metástasis linfáticas tempranas, según la localización del tumor primario. Este tipo de disecciones ha sido trabajada y propuesta por el grupo del MD Anderson.
El propósito es la preservación estética y funcional de estructuras relevantes.
Disección supraomohiodea: Remoción de los grupos ganglionares I II III, preservando el nervio accesorio del espinal.
Radioterapia
Lesiones T1 y T2
Lesiones pequeñas, bien definidas, las cuales involucran la punta o el borde anterolateral de la lengua pueden ser controladas con resección quirúrgica transoral o con radioterapia. Sin embargo en nuestro grupo se prefiere resección quirúrgica por su baja morbilidad.
La radioterapia se prefiere en lesiones pequeñas, de localización posterior, pobremente definidas e inaccesibles para el cirujano a través del abordaje transoral. La dosis está entre 56-60 Gy, durante 6 a 7 semanas.
Lesiones T3 y T4
Las lesiones tumorales avanzadas, con compromiso muscular profundo, usualmente se acompañan de metástasis cervicales y deben ser tratadas con radioterapia. El manejo ideal es la combinación de cirugía con radioterapia postoperatoria.
Técnica para administrar radioterapia
Es importante la higiene oral y la evaluación odontológica previa a la radioterapia. La técnica más usada es la de los campos laterales opuestos, con inclusión de la parte superior del cuello. Cuando las lesiones son pequeñas y el cuello es N0, el volumen de irradiación incluye los ganglios subdigástricos, submentonianos y submandibulares.
La laringe es excluida del campo de tratamiento. Se debe utilizar un dispositivo intraoral especial para deprimir la lengua hacia abajo y proteger la piel y el tejido celular subcutáneo, para prevenir el edema y la fibrosis tardía. El límite posterior del campo es 2 cm detrás del músculo esternocleidomastoideo, y el inferior limita con el cartílago tiroides.
Cuando el compromiso cervical es importante, puede requerirse la inclusión de los grupos ganglionares IV y V. Si la cadena cervical posterior lo amerita, la irradiación debe llevarse a 4.500 cGy, con exclusión medular. Si se requiere incluir el cuello inferior, estos ganglios se tratan por un campo anterior, con protección laríngea.
Todos estos esquemas requieren la simulación de los campos de radiación, la verificación semanal y el manejo con inmovilizador y protecciones personalizadas.
El cono intraoral y los implante intersticiales pueden ser utilizados bajo estrictos criterios de inclusión y por protocolo multidisciplinario del Instituto Nacional de Cancerología.
Quimioterapia
El papel de la quimioterapia en los cánceres de la cavidad oral y en especial de lengua, no está definido. Los cánceres en estados tempranos rara vez se manejan con quimioterapia, pues el control es excelente con cirugía, radioterapia o la combinación de los dos métodos.
Pacientes con extenso compromiso local o enfermedad metastásica a distancia, en quienes las tasas de supervivencia son muy bajas, pueden ser candidatos para quimioterapia.
Es importante en estos casos contemplar varios factores para iniciar el tratamiento, como la condición general del paciente, la eficacia potencial y los efectos secundarios. La quimioterapia puede ser usada con propósito paliativo o curativo; también puede ser usada sola o con otras formas de terapia adyuvante.
El cisplatino y el 5-fluorouracilo son los agentes más utilizados en el cáncer
escamocelular de cabeza y cuello, con respuestas que oscilan entre el 30% y el 35% y supervivencia para enfermedad metastásica de 6 meses en promedio.
Pronóstico
El pronóstico en el carcinoma de lengua está influenciado por la profundidad tumoral mayor de 4 mm, la invasión perineural y vascular.
Los tumores pobremente diferenciados tienen una alta incidencia de enfermedad metastásica. La incidencia de metástasis cervicales es del orden de 40%. La causa más común de muerte en paciente con carcinoma de lengua oral es la recaída local-regional.
La tasas de supervivencia en lesiones menores de 4 cm de diámetro es de 70-80% a 3 años; en lesiones mayores de 4 cm, la supervivencia es de 40-50%.
En pacientes menores 40 años el tumor suele presentarse en forma más agresiva, sin que se conozca la causa. El 57% de estos pacientes desarrolla recaída local-regional, y el 47% muere por su enfermedad.
El 30% de los pacientes puede desarrollar un segundo cáncer primario. Cuando se presentan metástasis a distancia, éstas en su gran mayoría ocurren en el pulmón.
La supervivencia a 5 años para el estado I es de 90%; para el estado II, 72%; para el estado III, 54%; y para estado IV, 34%.
Seguimiento
La causa más frecuente de muerte en estos pacientes es la recaída local o regional, por lo cual es importante practicar seguimiento cuidadoso con el fin de detectar en forma temprana la persistencia o la recaída.
Se recomiendan controles cada dos meses durante los dos primeros años, cada tres meses en el tercer año, cada 6 meses, hasta completar 5 años y posteriormente, cada año. Los controles deben incluir radiografía de tórax una vez al año. En caso de sospecha en el examen físico, se debe practicar biopsia de la zona dudosa.
Durante los controles puede ser difícil detectar enfermedad recurrente en forma precoz, especialmente cuando los pacientes han recibido manejo complementario con radioterapia.
Si el paciente presenta dolor, ello debe ser considerado como signo temprano de recaída, y debe ser llevado a biopsia y a estudios por TAC de la zona.
Lecturas Recomendadas
- 1. BATSAKIS JG. Pathology of tumors of the oral cavity. En: Cancer of the Head and Neck. Myers EN , Suen JY (eds). WB Saunders Company. Philadelphia, 1996
- 2. BEENKEN SW, KRONTIRAS H, MADDOX WA, ET AL. T1 and T2 squamous cell carcinoma of the oral tongue: Prognostic factors and the role of elective lymph node dissection. Head & Neck March:124, 1999.
- 3. BOURHIS J, PIGNON JP. Meta–analysis in head and neck squamous cell carcinoma. Hematol/Oncol Clin North Am 13:769, 1999.
- 4. BRENTANI RR, KOWALSKI LP, SOARES JF, ET AL. Results of a prospective trial on elective modified radical classical versus supraomohyoid neck dissection in the management of oral squamous carcinoma. Am J Surg 176:422, 1998.
- 5. BYERS RM, EL-NAGGAR AK, LEE Y-Y, ET AL. Can we detect or predict the presence of occult nodal metastases in patients with squamous carcinoma of the oral tongue? Head & Neck March:138, 1998.
- 6. CERNEA C, MONTENEGRO F, CASTRO I, ET AL. Prognostic significance of lymph node reactivity in the control of pathologic negative node squamous cell carcinomas of the oral cavity. Am J Surg 174:548, 1997.
- 7. DESANTO LW, JOHNSON JT, MILLION RR. Cost-effective management of T1N0 carcinoma of the tongue. Head & Neck Nov: 573, 1996.
- 8. DON DM, ANZAI Y, LUFKIN RB, ET AL. Evaluation of cervical lymph node metastases in squamous cell carcinoma of the head and neck. Laryngoscope 105:669, 1995.
- 9. FRANCESCI D, GUPTA R, SPIRO RH, SHAH JP. Improved survival in the treatment of squamous carcinoma of the oral tongue. Am J Surg 166:360, 1993.
- 10. GAY J. Standardization of neck dissection. Nomenclature. Head & Neck Surg . November:75, 1987.
Referencias
- 11. GLUCKMAN JL, PAVELIC ZP, WELKOBORSKY H-J, ET AL. Prognostic indicators for squamous cell carcinoma of the oral cavity: A clinicopathologic correlation. Laryngoscope 107:1239, 1997.
- 12. HADDADIN KJ, SOUTAR DS, OLIVER RJ, ET AL. Improved survival for patients with clinically T1/T2,NO tongue tumors undergoig a prophylactic neck dissection. Head & Neck September: 517, 1999.
- 13. HERRERA A, CADENA E, POSSO H, OLIVEROS G. Evaluación de las disecciones electivas del cuello en el manejo del cáncer temprano de lengua y piso de la boca. Instituto Nacional de Cancerologá. Santafé de Bogotá. Agosto 1998. Inédito.
- 14. HOUCK JR, MEDINA JE. Management of cervical lymph nodes in squamous carcinomas of head and neck. Sem Surg Oncol 11:228, 1995.
- 15. HOLT RG. Lip tumors. En: Cancer of the head and neck. Myers EN , Suen JY (eds). WB Saunders Company. Philadelphia, 1996
- 16. JESSE RH, BALLNTYNE AJ, LARSON D. Radical or modified neck dissection: A therapeutic dilemma. Am J Surg 136:516,1978.
- 17. KERREBIJN JDF, FREEMAN JL, IRISH JC, ET AL. Supraomohyoid neck dissection. Is it diagnostic or therapeutic? Head & Neck January: 39, 1999.
- 18. KHATTAB J, URBE SG. Chemotherapy in head and neck cancer. Overview of newer agents. Hematol Oncol Clin North Am 13:753, 1999.
- 19. MAJOUFRE C, FAUCHER A, LAROCHE C, ET AL. Supraomohyoid neck dissection in cancer of oral cavity. Am J Surg 178:73, 1999.
- 20. MILLON RR, CASSISI NJ, MANCUSO AA. Oral cavity. En: Management of head and neck cancer a multidisciplinary approach. Million RR, Cassisi NJ (eds). JB Lippincott Company. Philadelphia, 1996.
Bibliografías
- 21. PARSONS JT, MILLION RR. Radiation therapy of tumors of the oral cavity. In: Cancer of the head and neck. Myers EN, Suen JY (eds). WB Saunders Company. Philadelphia, 1996.
- 22. PERSKY MS, LAGMAY VM. Treatment of the clinically negative neck in oral squamuos cell carcinoma. Laryngoscope 109:1160, 1999.
- 23. PERSKY MS, LAGMAY VM. Treatment of the clinically negative neck in oral squamous cell carcinoma. Laryngoscope 109:1160, 1999.
- 24. RUBRIGHT WC, HOFFMAN HT, LYNCH CF, ET AL. Risk factors for advanced-stage oral cavity cancer. Arch Otorl Head Neck Surg 122:621, 1996.
- 25. SHINGAKY S, SUSUKY I, NAKAJIMA T, ET AL. Evaluation of histopathologic parameters in predicting cervical lymph node metastasis of oral and oropharyngeal carcinomas. Oral Surg 66:683, 1988.
- 26. SINARD RJ, NEETERVILLE JL, GARRETT CG, OSSOFF RH. Cancer of the larynx. In: Cancer of the head and neck. Myers EN, Suen JY (eds). WB Saunders Company. Philadelphia, 1996
- 27. SPIRO RH, GUILLAMONDEGUI O JR, PAULINO AF. Pattern of invasion and margin assessment in patients with oral tongue cancer. Head & Neck August:408, 1999.
- 28. SUEN JY, STERN SJ. Cancer of the neck. En:Cancer of the head and neck. Myers EN , Suen JY (eds). WB Saunders Company. Philadelphia, 1996
- 29. UICC. Union International Contra el Cáncer. Atlas TNM. Guía ilustrada de la clasificación TNM/pTNM de los tumors malignos. 4a Edición. Editado por P Hermanek, RVP Hutter, LH Sobin, G Wagner, Ch Wittekind. Springer-Verlag Ibérica SA. Barcelona, 1998.
CLIC AQUÍ Y DÉJANOS TU COMENTARIO