4.2
Edgar Velandia Neira. Médico Magíster en Toxicología Universidad Nacional de Colombia Docente Postgrado de Salud Ocupacional Universidad Distrital, Bogotá Toxicólogo Centro de información y Asesoría Toxicológica del Convenio: Consejo Colombiano de Seguridad -CISPROQUIM – Ministerio de Salud y Protección Social
Generalidades
Los piretroides son moléculas sintéticas derivadas de los tóxicos naturales llamados piretrinas que provienen de la planta del crisantemo (Chrysanthemun Cinerareafolium), de cuyas flores secas se extrae el extracto “pyrethrum”1-2-3.
El pyrethrum, es una mezcla de esteres de insecticidas (Piretrinas, cinerinas y jasmolinas), y se conocen entre ellas los derivados del ácido crisantémico que se relacionan con las piretrinas clase I. Con nombres análogos pero derivadas del ácido pirétrico se encuentran la piretrinas clase II1-3-4.
Los piretroides (sintéticos), generados de la molécula del ester carboxílico ciclopropano, se dividieron originalmente también en dos grupos:
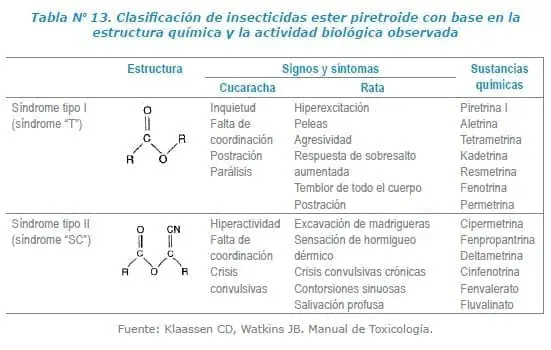
Tipo I (síndrome T): se describen así ya que se observa temblor al ser aplicado en ratas.
Tipo II (síndrome CS): por generar coreo-atetosis y salivación. Este segundo grupo tenía un grupo Alfa-Ciano, ligado al ester. (1). Ver Tabla Nº 13.
Usos
Los piretroides se utilizan como insecticidas, tanto para el hogar como para uso agrícola y salud pública. Los métodos con que se aplican son diversos, pueden ser inmersos en telas de mosquiteros y cortinas, utilizados en dispositivos eléctricos que generan vapores, spray. También existen aplicaciones para uso humano en la escabiosis con aplicación de cremas y en loción para el tratamiento de la pediculosis capitis3,5.
En EE. UU., se ha encontrado que los niños entre 5 y 17 años se han expuesto principalmente a permetrina y cipermentrina, por contacto por aplicaciones dadas en sus casas por medio de paños, polvos, alimentos contaminados y pulverizaciones6.
Toxicocinética
Absorción
La principal vía de ingreso es la oral, alcanzando cerca del 35%, lo cual es muy importante y de interés ocupacional ya que los trabajadores limpian o destapan “boquillas” de aplicación con sus bocas. Para la vía dérmica depende del vehículo por lo cual puede variar. Esta vía puede ser la responsable de las parestesias por paso directo a nervios periféricos. Para el evento en que se encuentre piretroides tipo polvo, pulverizacion o neblinas puede haber inhalación (vía de ingreso respiratoria), donde los efectos respiratorios se han considerado son debidos a los disolventes hidrocarburos de los productos que los contienen1,3,4.
Distribución
Los piretroides son lipofílicos, por lo cual llegan rápidamente al Sistema Nervioso Central (SNC), se metabolizan muy rápido sin bioacumulación1,2.
Metabolismo:
Los piretroides son rápidamente metabolizados en sangre e hígado por hidrólisis de los grupos ester y por la actividad del sistema oxidativo microsomal enzimático hepático (CYP), siendo los metabolitos de menor toxicidad que los compuestos originales. Por el rápido metabolismo, la toxicidad crónica es limitada1,3.
Eliminación
La eliminación se realiza por vía urinaria. No hay evidencia que los piretroides experimenten recirculación entero-hepática. Se han encontrado múltiples metabolitos que se han relacionado con cipermetrina, permetrina, ciflutrina, deltametrina, alletrina, resmetrina, tetrametrina, o algunos inespecíficos de múltiples piretroides, pero su observación y análisis se ha realizado dentro de estudios poblacionales de exposición1,3,5.
Mecanismo de acción
Los piretroides se unen a la subunidad α del canal de sodio voltaje dependiente disminuyendo su activación (apertura). Cuando el canal se encuentra abierto prolongan su activación y por ende la despolarización de la membrana neuronal.
La piretrinas naturales y los piretroides sintéticos tipo I inducen descargas repetitivas que se siguen de un estímulo único, pero tienen poco efecto en el potencial de reposo, esto sucede porque prolongan la apertura de los canales de sodio sólo el tiempo necesario para causar disparos repetitivos.
Los piretroides tipo II mantienen abiertos los canales de sodio por mayor tiempo, lo que lleva a que el potencial de membrana se convierta en despolarizado y no sea posible la generación de un potencial de acción y se produzca un bloqueo en la neuroconducción. Sin embargo, debido a que en mamíferos los canales de sodio voltaje dependientes tienen diferentes isoformas hay cierta resistencia a la acción tóxica de estas sustancias.
También pueden producir una interferencia en el mecanismo de transporte iónico a través de la membrana del axón, interfiriendo en la función neuronal y bloqueando las vías inhibitorias por:
- Inhibición de la calcio – magnesio – ATPasa lo cual produce interferencia con el ión calcio.
- Inhibición de los canales de cloro en el receptor GABA (tipo II).
- Inhibiendo la calmodulina con bloqueo de los canales de calcio, incrementando los niveles de calcio libre y actuando sobre los neurotransmisores de las terminaciones nerviosas1, 2,3.
Manifestaciones clínicas
Las manifestaciones clínicas relacionadas con piretrinas corresponden a reacciones alérgicas por presentar componentes naturales en los extractos. Pero los piretroides sintéticos por lo general no inducen este tipo de reacciones1.
Clásicamente se ha considerado la intoxicación en animales por piretroides tipo I (Síndrome T) dado por temblores, espasmos, hipertermia, y aumento de la tasa metabólica. Esto es poco probable en humanos ya que la afinidad por los canales de Na, es muchísimo menos que en los animales1,5.
Los piretroides tipo II (Síndrome CS), causan en animales salivación, ataxia temblor grueso coreo-atetosis y convulsiones1,2,4,5.
En el humano pueden generar salivación, náuseas, vómito, mareo, fasciculaciones, alteración del estado de conciencia, convulsiones, coma. Esta presentación clínica puede ser confundida con el cuadro clínico de intoxicación por insecticidas organofosforados o carbamatos.
Las presentaciones con alteraciones de síndrome de dificultad respiratoria pueden ser debidas al vehículo solvente o surfactantes3,5,7.
Exposición dérmica:
Ocurre especialmente en actividades laborales con vaporizaciones o pulverizaciones. Los síntomas asociados a esta exposición son cefalea, náuseas, sensación de debilidad, ansiedad, disnea e irritación ocular.
Las parestesias son síntomas predominantes en la exposición dérmica donde se pueden evidenciar en algunos casos además irritación cutánea localizada con prurito, eritema y vesículas. Los síntomas pueden presentarse entre la media hora y las dos horas posteriores a exposición, pudiendo prolongarse hasta las 24 horas1,3,4,5.
Exposición ocular:
Puede ser muy evidente notando dolor, lagrimeo, fotofobia y conjuntivitis1,3,4,8,9.
Exposición oral:
Por lo general se debe a ingestas de tipo voluntario o accidentes donde generalmente son dosis más altas. Las alteraciones predominantes son las gastro-intestinales con dolor de garganta, náuseas, vómito, dolor epigástrico, dolor faríngeo. Eventualmente se pude evidenciar ulceraciones con disfagia y sialorrea1,3,5.
Exposición inhalatoria:
Las alteraciones por inhalación de aerosoles o pulverizaciones pueden generar irritación y congestión nasal, estornudos y ardor faríngeo. Se han informado casos de neumonitis por hipersensibilidad y broncoespasmo8, 9,10.
Efectos crónicos
No se ha establecido claramente una toxicidad crónica, puesto que los piretroides se metabolizan rápidamente y no son biopersistentes.
Se ha postulado la posible neurotoxicidad, pero no hay estudios que la soporten1, 5,11. Se reporta el caso de un individuo que después de una alta exposición en un lugar cerrado presentó anosmia persistente – observada por 3 años12.
Diagnóstico
El diagnóstico se basa en la historia de la exposición7. Es posible el biomonitoreo de trabajadores expuestos en la industria o aplicadores observando los compuestos intactos o sus metabolitos en orina, por medio de una diversidad de métodos, o en plasma por detección electroquímica en cromatografía de gases.
Pero estos métodos tienen poca aplicabilidad en intoxicaciones agudas por su baja disponibilidad en centros clínicos y no ser consecuentes con la clínica y su manejo5,7,11.
Las pruebas cutáneas ayudan al diagnóstico de sensibilidad al Pyretro10.
Laboratorio clínico: como apoyo al diagnóstico se sugiere realizar glicemia, electrolitos, gases arteriales, oximetría7.
Diagnóstico diferencial
Debe considerarse reacción alérgica a otros plaguicidas, plantas, flores, picadura de insectos, y a productos caseros. También intoxicaciones alimentarias y enfermedades respiratorias agudas.
Debe tenerse en cuenta el síndrome muscarinico de los pesticidas inhibidores de colinesterasa1,5,10.
(Lea También: Intoxicación por Paraquat)
Tratamiento médico
Cada caso se debe individualizar y tratar de acuerdo a:
- Cantidad de tóxico a la que ha sido expuesta
- Vía de ingreso
- Tiempo de exposición
- Cuadro clínico y severidad
El tratamiento para intoxicaciones por piretroides NO tiene antídoto específico.
Decontaminación:
- Inhalatoria: retirar de áreas contaminadas – incluye retiro de prendas o elementos contaminados.
- Dérmico: retiro de prendas, baño con agua – se puede utilizar un jabón neutro.
- Oral: no inducir el vómito, aplicación de carbón activado (C.A.), preferiblemente dentro de la primera hora post-ingesta. El lavado gástrico no se recomienda cuando haya disponibilidad del C.A, cuando haya dosis sub-tóxicas o cuando se considere un vehículo hidrocarburo en el producto comercial. El lavado gástrico se sugiere para ingestas masivas.
Parestesias por exposición local:
- Vitamina E en caso de parestesias, aunque estas pueden desaparecer espontáneamente en las 24 horas siguientes.
Reacciones alérgicas y/o anafilácticas:
- En reacciones alérgicas moderadas se puede tratar con antihistamínicos como difenhidramina, hidroxina o loratadina.
- En reacciones severas, monitorizar la vía aérea, tratar la hipotensión con líquidos cristaloides, uso de epinefrina, difenhidramina y corticosteroides a necesidad. El broncoespasmo se trata con oxígeno, Agonistas β2 en nebulización, como terbutalina, salbutamol o aminofilina IV.
Convulsiones:
- Si se presentan pueden tratarse con benzodiacepinas: Diazepam 5-10 mg iv, (dosis adultos).
Manejo de soporte:
- Observación
- Control de signos vitales y/o monitorización
- Protección de la mucosa gástrica
- Tratar la hiperglicemia (A la vez, cuando se presenta puede ser un factor indicativo de complicaciones en pacientes no diabéticos)1, 3,4,5,7,13,14,15,16.
Valoración por toxicología clínica para continuar manejo especializado y consideración de otras medidas terapéuticas útiles en situación clínica grave.
En caso de intento de suicidio siempre se debe realizar evaluación y manejo por los especialistas de Psiquiatría.
Pronóstico y criterios de remisión
La gran mayoría de individuos con sobre-exposición, se recuperan en menos de 24 horas.
Si el centro de atención hospitalario no cuenta con los recursos de infraestructura en salud suficientes se debe remitir a quien presente bronco-espasmo, neumonitis química o edema pulmonar.
Estas complicaciones mencionadas, no solo se pueden presentar por la exposición a los piretroides, ya que se han visto en exposiciones masivas con productos que contengan solventes hidrocarburos1,5.
Criterios de UCI
Aunque en las bibliografías no se encuentra específicamente los criterios se puede establecer:
- Alteración del estado de conciencia que requiera intubación.
- Presencia de complicaciones en quien se requiera soporte ventilatorio.
- Depresión respiratoria.
- Convulsiones que no cedan con el manejo inicial con benzodiacepinas1,2,7,13.
Referencias
- 1. Holland MG. En Goldfrank’s Toxicologic Emergencies. McGraw-Hill; Tenth edition 2010. Chapter 114, Pyrethrins/Pyrethroids; p. 2446-53.
- 2. Klaassen CD, Watkins JB. Manual de Toxicología. Efectos tóxicos de los plaguicidas- Piretroides. 5ta Ed. 2006, p. 634-638.
- 3. Parra JF, Avila AA, En Toxicología en Urgencias. Editorial Médica Celsus, Cap. 49. Intoxicaciones agudas por Piretrinas y Piretroides, 2015, p. 379-86.
- 4. Zamora A. En Toxicología Clinica. Corporación para investigaciones biológicas CIB. Primera edición Intoxicacion por piretrinas y piretroides; 2010. p. 131-134
- 5. Perry H. En Haddad Clinical management poisoning and drug overdose. Saunders Elsevier. Fourth edition Chapter 79. Pyrethrum, Pyrethrins, And Pyrethroids.; 2009. p.1185-88.
- 6. Morgan MK, Children’s Exposures to Pyrethroid Insecticides at Home: A Review of Data Collected in Published Exposure Measurement Studies Conducted in the United States. Int. J. Environ. Res. Public Health. 2012; 9, 2964-2985.
- 7. Brent R. Ekins, PharmD. Poisoning and Drug Overdose. 6th ed. McGrawHill; Pyrethrins, And Pyrethroids; 2012. p. 276-7.
- 8. Hudson N. Et al, Characteristics and Magnitude of Acute Pesticide-Related Illnesses and Injuries Associated With Pyrethrin and pyrethroid Exposures—11 States, 2000–2008. American Journal Of Industrial Medicine. 2014; 57:15–30.
Bibliografías
- 9. Cha YS et al. Pyrethroid poisoning: features and predictors of atypical presentations. Emerg Med J. 2014 Nov; 31(11): 899-903.
- 10. O´Malley M. En Diagnóstico y tratamiento en Medicina Laboral y ambiental. Edit. Manual Moderno. 4ta Edit. Pesticidas –Piretro e insecticidas piretroides sintéticos; 2007. p. 591-2.
- 11. Anne-Marie Saillenfait et al. International Journal of Hygiene and Environmental Health 218 (2015) 281–292. Review Pyrethroids: Exposure and health effects – An update.
- 12. Gobba F. Abbacchini C. Anosmia after exposure to a pyrethrin based insecticide: a case report. Int J Occup Med Environ Health. 2012 Sep; 25(4): 50612.
- 13. Giampreti A. et al. Recurrent tonic–clonic seizures and coma due to ingestion of Type I pyrethroids in a 19-month-old patient. Journal Clinical Toxicology Volume 2013. 51: 497-500.
- 14. Jeongmi Moon. The Initial Hyperglycemia in Acute Type II Pyrethroid Poisoning. Journal Korean Med Sci 2015; 30: 365-370.
- 15. Llinas V. En Manual de terapéutica. Corporación para investigaciones biológicas CIB. 16th. Edición. Antidotos; 2014. p. 69-91. 16. Brunton L, Chabner B, Knollman B. Goodman and Gilman the Pharmacological basis of Therapeutics. McGraw-Hill. 12th Edition. 2011.