3.4.7 Resumen de la evidencia: Manejo no quirúrgico en persistencia o recaída
Se formuló una estrategia de búsqueda de la literatura con el propósito de obtener revisiones sistemáticas o metanálisis que evaluaran el tratamiento con quimioterapia, radioterapia o quimioterapia más radioterapia como mejor soporte paliativo sin manejo adicional.
Se encontró sólo una revisión sistemática (31) que presenta diversos estudios que por su heterogeneidad clínica no pudieron ser comparados. Sin embargo, dicha revisión presenta diferentes comparaciones quimoterapéuticas con o sin radioterapia.
Para responder esta pregunta se revisaron los estudios primarios que dicha revisión presenta. Además, se hizo una búsqueda manual para encontrar estudios más recientes, encontrando dos estudios clínicos aleatorizados con reportes preliminares que responden a las mismas intervenciones. Las características de dichos estudios se presentan en la tabla 3.4.10.

Los estudios seleccionados para responder esta pregunta son estudios clínicos aleatorizados fase II o III con diferentes opciones quimioterapéuticas.
3.4.7.1 Calidad de la evidencia de estudios primarios
La revisión de Hirte y cols (31) incluyó 15 estudios primarios, sin embargo, sólo trece de dichos estudios pudieron ser evaluados (32-45), ya que dos de ellos sólo se publicaron como abstracts y este equipo no tuvo acceso a los mismos.
De los estudios encontrados, seis compararon cisplatino como agente único con una combinación de cisplatino (32-34;36;3;,40), dos compararon quimioterapia basada en cisplatino versus otro régimen quimioterapéutico, tres compararon carboplatino versus otro tipo de quimioterapia, y tres estudios compararon agentes que no contuvieron platino. Las dosis de cisplatino variaron entre 20 a 80 mg-m2.
Hubo estudios con tres brazos de comparación, sin embargo, uno de los estudios de finalizó debido a muertes relacionadas con el tratamiento en uno de los brazos. Los demás estudios tuvieron dos brazos de comparación. Uno de los estudios reportó información para todos los cánceres ginecólógicos; sin embargo la información fue reportada por separado para las pacientes con cáncer cervical.
Para ser elegible para participar en los estudios aleatorizados, las pacientes debieron tener cáncer recurrente, metastásico o persistente. Las pacientes recibieron quimioterapia previa en tres de los estudios, quimioradioterapia en cuatro de los estudios y radioterapia en diez de ellos, además de cirugía en seis de los estudios. Los ensayos se llevaron a cabo en Estados Unidos, Europa, Rusia, Bélgica, Suráfrica, México y Dinamarca.
Donde reportado, los pacientes fueron estratificados por institución, diagnóstico histológico, sitio de la enfermedad y radioterapia pélvica previa a la quimioterapia. Cuatro de los estudios realizaron análisis de subgrupos para investigar el efecto de la quimioterapia neoadyuvante en las tasas de supervivencia y respuesta.
3.4.7.2 Resumen de resultados
Los autores de la revisión sistemática reportaron haber realizado meta análisis iniciales para respuesta global, periodo libre de enfermedad y supervivencia comparando cisplatino versus combinación quimioterapéutica. Para estas comparaciones, no se encontró heterogeneidad estadísticamente significativa entre las comparaciones y se encontraron diferencias significativas a favor de la combinación quimioterapia versus cisplatino como agente [único en cada uno de los desenlaces.
Sin embargo, los autores consideraron que la heterogeneidad clínica entre los estudios es muy grande como para realizar metanálisis significativos. En uno de los estudios (32), que refleja la conducta más frecuente en la actualidad, la quimioterapia previa ocurrió en aproximadamente un tercio de los pacientes.
Adicionalmente, los regímenes de tratamiento variaron a tal punto que cualquier diferencia estadísticamente significativa detectada ofrecería muy poca información clínica. Dada la heterogeneidad clínica de las poblaciones de pacientes y los tratamientos quimioterapéuticos, los autores de dicha revisión sistemática se abstuvieron de llevar a cabo cualquier metanálisis.
3.4.7.2.1 Calidad de los estudios
Todos los estudios clínicos fueron ciegos al investigador. En uno de los estudios, sólo los 25 pacientes iniciales fueron aleatorizados entre los brazos de tratamiento; después de análisis preliminares, el brazo de hidroxiúrea fue detenido y los pacientes posteriores recibieron cisplatino y metotrexate (41). El método de aleatorización fue reportado en 7 de los 17 estudios.
El poder para detectar diferencias significativas entre los brazos de tratamiento fue reportado en cuatro de los estudios (32;34;36;39). Tres de los estudios fueron descontinuados prematuramente (33;38;40). Las características de los pacientes al inicio de los estudios fue más o menos uniforme en todos los estudios; sin embargo, no se reportaron comparaciones estadísticas entre los brazos de tratamiento.
A continuación se describe y analiza la evidencia disponible para cada una de las intervenciones propuestas en el PICO. Debido la heterogeneidad clínica de los estudios incluidos no se elaboraron tablas GRADE para esta pregunta.
3.4.7.2.2 Resumen de resultados
Los desenlaces principales encontrados en los estudios fueron tasa de respuesta, mediana de supervivencia y periodo libre de enfermedad. El impacto de la quimioterapia previa en los desenlaces de interés también fue investigado en dichos estudios.
3.4.7.2.3 Desenlace 1: Tasa de respuesta
Todos los estudios clínicos reportaron tasa de respuesta y se reportan en la tabla 3.4.10.
Cuatro de los 15 estudios clínicos encontraron mejoría significativa en la tasa global de respuesta (respuesta completa y parcial) con combinaciones basadas en cisplatino cuando se compararon con cisplatino únicamente.
Long y cols (32) reportaron una ventaja para pacientes que reciben cisplatino y topotecan cuando se compara con pacientes que recibieron cisplatino únicamente (27% vs 13%, P=0.004). De la misma manera, Moore y cols (34) reportaron una tasa maron de respuesta global para pacientes que recibieron cisplatino y paclitaxel cuando se comparó con pacientes recibiendo únicamente cisplatino (36% vs 19%, P=0.005).
El estudio de Vermoken y cols (36) también reportó una ventaja para pacientes que recibieron BEMP cuando esta se comparó con pacientes recibiendo únicamente cisplatino (24% vs 14%, P=0.005) y Omura y cols (37) quienes reportaron mayor tasa de respuesta para pacientes que recibieron cisplatino e ifosfamida cuando se comparó con pacientes que recibieron cisplatino únicamente (34% vs 18%, P=0.004).
3.4.7.2.4 Desenlace 2: Supervivencia
Trece estudios reportaron mediana de supervivencia, también reportado en en la tabla 3.4.10. Sólo un estudio (32) reportó una ventaja significativa para pacientes recibiendo combinación con cisplatino cuando esta se comparó con pacientes que recibieron cisplatino únicamente (9.4 vs 6.5 meses, P=0.017). En este estudio, el HR para la supervivencia global fue de 0.76 (0.59-0.98; IC 95, P=0.017) a favor de la combinación de régimen.
Los demás estudios no reportaron diferencias estadísticamente significativas entre los brazos de tratamiento para mediana de supervivencia ni para supervivencia global.
3.4.7.2.5 Desenlace 3: Periodo Libre de Enfermedad (PLE)
La mediana de PLE se reportó en 8 de los estudios clínicos. De éstos, tres reportaron una ventaja estadísticamente significativa para pacientes que recibieron combinación de quimioterapia con cisplatino cuando ésta se comparó con pacientes que recibían cisplatino únicamente. Long y cols (32) reportaron un PLE mayor en pacientes tratados con cisplatino y topotecan cuando ésta se comparó con pacientes que recibían cisplatino únicamente (4.6 vs 2.9 meses, P=0.014).
El HR para el PLE global fue de 0.76 (0.60-0.97; 95% IC, 0.014). Moore y cols (34) también reportaron una ventaja en PLE para pacientes que recibieron cisplatino y paclitaxel cuando se compararon con pacientes que recibieron únicamente cisplatino (4.8 vs 2.8 meses, P<0.001). De la misma manera, el estudio de Omura y cols (37) encontró mayor PLE entre pacientes tratados con cisplatino e ifosfamida comparado con pacientes que recibieron cisplatino únicamente (4.6 vs 3.2 meses, P=0.003). Los demás estudios no reportaron diferencias significativas.
3.4.7.2.6 Desenlace 4: Eventos adversos
Los eventos adversos se reportaron en 14 estudios; el estudio de Barlow y cols (44) no reportó resultados de toxicidad de forma preparada para pacientes con cáncer cervical.
Los eventos adversos hematológicos fueron menos prevalentes en los brazos de cisplatino como único agente quimioterapéutico comparado con pacientes que recibieron combinaciones con cisplatino. Hubo significativamente menos neutropenia grado 3 o 4, neutropenia febril, trombocitopenia, leucopenia y anemia. Vermoken y cols (36) reportaron menos toxicidad hematológica en todos los ciclos cuando se comparó cisplatino con BEMP (6/144 vs 33/143, P=0.001). El estudio de Lira-Puerto (38) reportó significativamente menos trombocitopenia grado 3 o 4 y vómito entre los pacientes tratados con carboplatino cuando se comparó con pacientes tratados con iproplatino (6% vs 13% y 43% vs 78%, respectivamente).
Diferencias significativas para eventos adversos no hematológicos grado 3 ó 4 fueron reportados en cinco estudios (32;36-39). Long y cols (32) reportaron un número significativamente menor de infecciones en paciente tratados con cisplatino únicamente comparado con pacientes recibiendo cisplatino en combinación con otros (8% vs 18%).
El estudio de Vermorken (36) reportó una proporción significativamente menor de pacientes con alopecia cuando se comparó el grupo de pacientes recibiendo cisplatino vs aquellos recibiendo BEMP (22% vs 57%, P=0.001). Omura y cols (37) reportaron neurotoxicidad central y periférica de forma menos frecuente y severa en pacientes que recibieron cisplatino comparado con pacientes tratados con cisplatino e ifosfamida. Dos estudios que compararon carboplatino con iproplatino reportaron un mayor número de pacientes con náusea y vomito entre aquellos que recibieron iproplatino (nausea y vomito 32% vs 53%, P=0.001(39); vómito 43% vs 78%, P=0.001 (38)).
3.4.7.2.7 Desenlace 5: Calidad de vida
Dos estudios reportaron información acerca de calidad de vida (32;34). Ninguno de los estudios encontró diferencias significativas entre terapia única con cisplatino y terapia en combinación con topotecán o paclitaxel respectivamente. Ambos estudios evaluaron pacientes al inicio y tres puntos después; la calidad de vida fue completada por 59% y 60% de los pacientes en cada uno de los estudios. Después de completar al menos un cuestionario, no se encontraron diferencias significativas entre quienes lo completaron y quienes no terminaron el estudio para ambos bazos de tratamiento.
(Lea También: Radioterapia Usada en Pacientes con Cáncer de Cuello Uterino)
3.4.8 De la evidencia a la recomendación
3.4.8.1 Mejor terapia concomitante a radioterapia

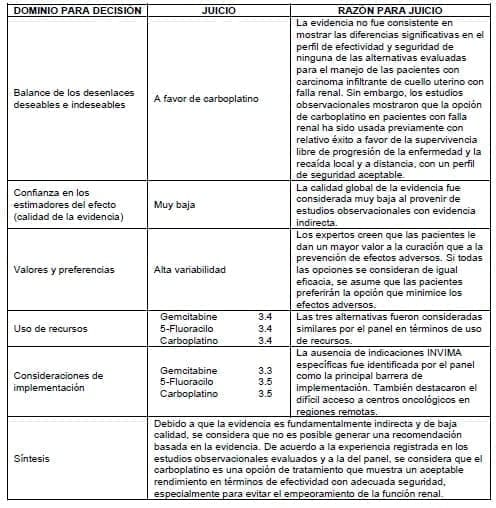
3.4.8.2 Quimioterapia en falla renal
3.4.8.3 Quimioterapia neoadyuvante

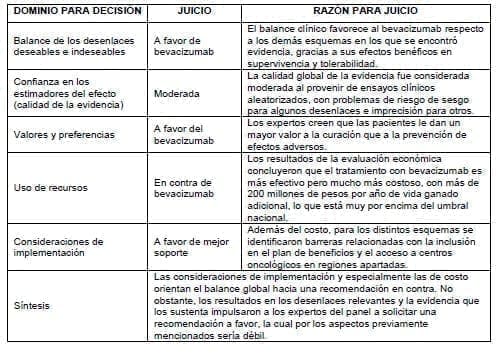
3.4.8.4 Persistencia o recaída
3.4.9 Recomendaciones
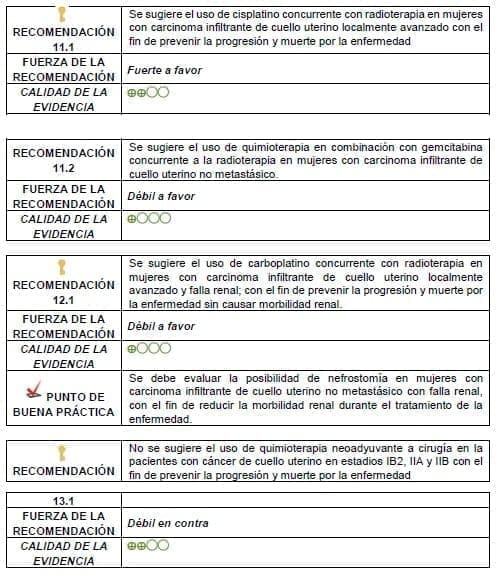
Detalles de la recomendación
Puede realizarse quimoterapia neoadyuvante a cirugía en casos muy excepcionales a criterio de una junta.

Detalles de la recomendación
La elección de la terapia a realizar en recaída debe hacerse de forma personalizada teniendo en cuenta aspectos como el tipo de recaída y el tratamiento previo recibido, entre otros.
Implicaciones de investigación
Son necesarios ensayos clínicos de mayor calidad que evalúen las alternativas de tratamiento al cisplatino, como son el tratamiento combinado con Gemcitabina, con mayor tiempo de seguimiento y mejor rendimiento en términos de calidad, así como de estudios económicos para determinar la relación costo-efectividad de ésta intervención.
Asimismo, se requieren series de casos locales donde se muestre el pronóstico renal y oncológico de las pacientes con falla renal que son tratadas con diferentes esquemas de quimioterapia, con o sin nefrostomía.
Para definir el beneficio del uso de quimioterapia neoadyuvante a la cirugía es necesario contar con resultados de nuevos estudios que la comparen con el tratamiento quirúrgico primario, y que estos estudios cuenten con mayores tamaños de muestra que los ya publicados, y arrojen información sobre eventos adversos secundarios y calidad de vida.
Referencias
-
1. Ferlay J, Dikshit R, Elser S, Mathers C, Rebelo M, Parkin DM. Globocan 2012. CancerBase No11 [Internet].
-
2. Rotman M, Sedlis A, Piedmonte M, Bundy B, Lentz S, Muderspach L, et al. A phase III randomized trial of postoperative pelvic irradiation in Stage IB cervical carcinoma with poor prognostic features: follow-up of a gynecologic oncology group study. Int J Radiat Oncol Biol Phys. 2006;65(1):169-76.
-
3. Delgado G, Bundy B, Zaino R, Sevin B, Creasman W, Major F. Prospective surgical-pathological study of disease-free interval in patients with stage IB squamous cell carcinoma of the cervix: a Gynecologic Oncology Group study. Gynecol Oncol. 1990;38(3):352-7.
-
4. Chemoradiotherapy for Cervical Cancer Meta-analysis Collaboration (CCCMAC). Reducing uncertainties about the effects of chemoradiotherapy for cervical cancer: individual patient data meta-analysis. Cochrane Database Syst Rev. 2010; 20 (1).
-
5. Kim Y, Shin S, Nam J, Kim Y, Kim YM, Kim JH, et al. Prospective randomized comparison of monthly fluorouracil and cisplatin versus weekly cisplatin concurrent with pelvic radiotherapy and high-dose rate brachytherapy for locally advanced cervical cancer. Gynecol Oncol. 2008;108(1):195-200.
-
6. Logsdon, P.J. Eifel. FIGO IIIB squamous cell carcinoma of the cervix: an analysis of prognostic factors emphasizing the balance between external beam and intracavitary radiation therapy. Int J Radiat Oncol Biol Phys, 1999;43 (4):763-75.
-
7. Nam EJ, Lee M, Yim GW, Kim JH, Kim S, Kim SW, et al. Comparison of carboplatin- and cisplatin-based concurrent chemoradiotherapy in locally advanced cervical cancer patients with morbidity risks. Oncologist. 2013;18(7):843-9.
-
8. Cetina L, Rivera L, Candelaria M, de la Garza J, Dueñas-González A. Chemoradiation with gemcitabine for cervical cancer in patients with renal failure. Anticancer Drugs. 2004;15(8):761-6.
-
9. Kim HS, Sardi JE, Katsumata N, Ryu HS, Nam JH, Chung HH, et al. Efficacy of neoadjuvant chemotherapy in patients with FIGO stage IB1 to IIA cervical cancer: an international collaborative meta-analysis. Eur J Surg Oncol. 2013;39(2):115-24.
-
10. Ye Q, Yuan HX, Chen HL. Responsiveness of neoadjuvant chemotherapy before surgery predicts favorable prognosis for cervical cancer patients: a meta-analysis. J Cancer Res Clin Oncol. 2013;139(11):1887-98.
-
11. Monk BJ, Sill MW, McMeekin DS, Cohn DE, Ramondetta LM, Boardman CH, et al Phase III trial of four cisplatin-containing doublet combinations in stage IVB, recurrent, or persistent cervical carcinoma: a Gynecologic Oncology Group study.. J Clin Oncol. 2009;27(28):4649-55.
-
12. Kitagawa L, Katsumata N, Shibata T, et al. A randomized, phase III trial of paclitaxel plus carboplatin (TC) versus paclitaxel plus cisplatin (TP) in stage IVb, persistent or recurrent cervical cancer: Japan Clinical Oncology Group study (JCOG0505). J Clin Oncol. 2012;30:Abstr 5006.
-
13. I Tewari KS, Sill MW, Long HJ 3rd, Penson RT, Huang H, Ramondetta LM, et al. Improved survival with bevacizumab in advanced cervical cancer. N Engl J Med. 2014;370(8):734-43.
-
14. Phippen NT, Leath CA 3rd, Havrilesky LJ, Barnett JC. Bevacizumab in recurrent, persistent, or advanced stage carcinoma of the cervix: Is it cost-effective? Gynecol Oncol. 2014 Nov 9. pii: S0090-8258(14)01416-4. doi: 10.1016/j.ygyno.2014.11.003. [Epub ahead of print]
-
15. Duenas-Gonzalez A, Cetina-Perez L, Lopez-Graniel C, Gonzalez-Enciso A, Gomez-Gonzalez E, Rivera-Rubi L, et al. Pathologic response and toxicity assessment of chemoradiotherapy with cisplatin versus cisplatin plus gemcitabine in cervical cancer: a randomized Phase II study. Int J Radiat Oncol Biol Phys. 2005;61(3):817-23.
-
16. Duenas-Gonzalez A, Zarba JJ, Patel F, Alcedo JC, Beslija S, Casanova L, et al. Phase III, open-label, randomized study comparing concurrent gemcitabine plus cisplatin and radiation followed by adjuvant gemcitabine and cisplatin versus concurrent cisplatin and radiation in patients with stage IIB to IVA carcinoma of the cervix. J Clin Oncol. 2011;29(13):1678-85.
-
17. Verma AK, Arya AK, Kumar M, Kumar A, Gupta S, Sharma D, et al. Weekly cisplatin or gemcitabine concomitant with radiation in the management of locally advanced carcinoma cervix: results from an observational study. J Gynecol Oncol. 2009;20(4):221-6.
-
18. Hashemi FA, Akbari EH, Kalaghchi B, Esmati E. Concurrent chemoradiation with weekly gemcitabine and cisplatin for locally advanced cervical cancer. Asian Pac J Cancer Prev. 2013;14(9):5385-9.
-
19. Umanzor J, Aguiluz M, Pineda C, Andrade S, Erazo M, Flores C, et al. Concurrent cisplatin/gemcitabine chemotherapy along with radiotherapy in locally advanced cervical carcinoma: a phase II trial. Gynecol Oncol. 2006;100(1):70-5.
-
20. Zarba JJ, Jaremtchuk AV, Gonzalez Jazey P, Keropian M, Castagnino R, Mina C, et al. A phase I-II study of weekly cisplatin and gemcitabine with concurrent radiotherapy in locally advanced cervical carcinoma. Ann Oncol. 2003;14(8):1285-90.
-
21. Pattaranutaporn P, Thirapakawong C, Chansilpa Y, Therasakvichya S, Ieumwananontachai N, Thephamongkhol K. Phase II study of concurrent gemcitabine and radiotherapy in locally advanced stage IIIB cervical carcinoma. Gynecol Oncol. 2001;81(3):404-7.
-
22. Pu J, Qin SS, Ding JX, Zhang Y, Zhu WG, Yu CH, et al. A randomized controlled study of single-agent cisplatin and radiotherapy versus docetaxel/cisplatin and radiotherapy in high-risk early-stage cervical cancer after radical surgery. J Cancer Res Clin Oncol. 2013;139(4):703-8.
-
23. Sehouli J, Runnebaum IB, Fotopoulou C, Blohmer U, Belau A, Leber H, et al. A randomized phase III adjuvant study in high-risk cervical cancer: simultaneous radiochemotherapy with cisplatin (S-RC) versus systemic paclitaxel and carboplatin followed by percutaneous radiation (PC-R): a NOGGO-AGO Intergroup Study. Ann Oncol. 2012;23(9):2259-64.
-
24. Geara FB, Shamseddine A, Khalil A, Abboud M, Charafeddine M, Seoud M. A phase II randomized trial comparing radiotherapy with concurrent weekly cisplatin or weekly paclitaxel in patients with advanced cervical cancer. Radiat Oncol. 2010;5:84.
-
25. de Vos FY, Bos AM, Gietema JA, Pras E, Van der Zee AG, de Vries EG, et al. Paclitaxel and carboplatin concurrent with radiotherapy for primary cervical cancer. Anticancer Res. 2004;24(1):345-8.
-
26. Katanyoo K, Tangjitgamol S, Chongthanakorn M, Tantivatana T, Manusirivithaya S, Rongsriyam K, et al. Treatment outcomes of concurrent weekly carboplatin with radiation therapy in locally advanced cervical cancer patients. Gynecol Oncol. 2011;123(3):571-6.
-
27. Au-Yeung G, Mileshkin L, Bernshaw DM, Kondalsamy-Chennakesavan S, Rischin D, Narayan K. Radiation with cisplatin or carboplatin for locally advanced cervix cancer: the experience of a tertiary cancer centre. J Med Imaging Radiat Oncol. 2013;57(1):97-104.
-
28. Ghaemmaghami F, Behtash N, Yarandi F, Moosavi A, Modares M, Toogeh G, et al. First-line chemotherapy with 5-FU and platinum for advanced and recurrent cancer of the cervix: a phase II study. J Obstet Gynaecol. 2003;23(4):422-5.
-
29. Rydzewska L, Tierney J, Vale CL, Symonds PR. Neoadjuvant chemotherapy plus surgery versus surgery for cervical cancer. Cochrane Database Syst Rev. 2012;12:CD007406.
-
30. Kim HS, Sardi JE, Katsumata N, Ryu HS, Nam JH, Chung HH, et al. Efficacy of neoadjuvant chemotherapy in patients with FIGO stage IB1 to IIA cervical cancer: an international collaborative meta-analysis. Eur J Surg Oncol. 2013;39(2):115-24.
-
31. Hirte HW, Strychowsky JE, Oliver T, Fung-Kee-Fung M, Elit L, Oza AM. Chemotherapy for recurrent, metastatic, or persistent cervical cancer: a systematic review. Int J Gynecol Cancer 2007 Nov;17(6):1194-204.
-
32. Long HJ, III, Bundy BN, Grendys EC, Jr., Benda JA, McMeekin DS, Sorosky J, et al. Randomized phase III trial of cisplatin with or without topotecan in carcinoma of the uterine cervix: a Gynecologic Oncology Group Study. J Clin Oncol 2005 Jul 20;23(21):4626-33.
-
33. Cadron I, Jakobsen A, Vergote I. Report of an early stopped randomized trial comparing cisplatin vs cisplatin/ifosfamide/ 5-fluorouracil in recurrent cervical cancer. Gynecol Obstet Invest 2005;59(3):126-9.
-
34. Moore DH, Blessing JA, McQuellon RP, Thaler HT, Cella D, Benda J, et al. Phase III study of cisplatin with or without paclitaxel in stage IVB, recurrent, or persistent squamous cell carcinoma of the cervix: a gynecologic oncology group study. J Clin Oncol 2004 Aug 1;22(15):3113-9.
-
35. Bloss JD, Blessing JA, Behrens BC, Mannel RS, Rader JS, Sood AK, et al. Randomized trial of cisplatin and ifosfamide with or without bleomycin in squamous carcinoma of the cervix: a gynecologic oncology group study. J Clin Oncol 2002 Apr 1;20(7):1832-7.
-
36. Vermorken JB, Zanetta G, De Oliveira CF, van der Burg ME, Lacave AJ, Teodorovic I, et al. Randomized phase III trial of bleomycin, vindesine, mitomycin-C, and cisplatin (BEMP) versus cisplatin (P) in disseminated squamous-cell carcinoma of the uterine cervix: an EORTC Gynecological Cancer Cooperative Group study. Ann Oncol 2001 Jul;12(7):967-74.
-
37. Omura GA, Blessing JA, Vaccarello L, Berman ML, Clarke-Pearson DL, Mutch DG, et al. Randomized trial of cisplatin versus cisplatin plus mitolactol versus cisplatin plus ifosfamide in advanced squamous carcinoma of the cervix: a Gynecologic Oncology Group study. J Clin Oncol 1997 Jan;15(1):165-71.
-
38. Lira-Puerto V, Silva A, Morris M, Martinez R, Groshen S, Morales-Canfield F, et al. Phase II trial of carboplatin or iproplatin in cervical cancer. Cancer Chemother Pharmacol 1991;28(5):391-6.
-
39. McGuire WP, III, Arseneau J, Blessing JA, DiSaia PJ, Hatch KD, Given FT, Jr., et al. A randomized comparative trial of carboplatin and iproplatin in advanced squamous carcinoma of the uterine cervix: a Gynecologic Oncology Group study. J Clin Oncol 1989 Oct;7(10):1462-8.
-
40. Alberts DS, Kronmal R, Baker LH, Stock-Novack DL, Surwit EA, Boutselis JG, et al. Phase II randomized trial of cisplatin chemotherapy regimens in the treatment of recurrent or metastatic squamous cell cancer of the cervix: a Southwest Oncology Group Study. J Clin Oncol 1987 Nov;5(11):1791-5.
-
41. Bezwoda WR, Nissenbaum M, Derman DP. Treatment of metastatic and recurrent cervix cancer with chemotherapy: a randomised trial comparing hydroxyurea with cisdiamminedichloro-platinum plus methotrexate. Med Pediatr Oncol 1986;14(1):17-9.
-
42. Wallace HJ, Jr., Hreshchyshyn MM, Wilbanks GD, Boronow RC, Fowler WC, Jr., Blessing JA. Comparison of the therapeutic effects of adriamycin alone versus adriamycin plus vincristine versus adriamycin plus cyclophosphamide in the treatment of advanced carcinoma of the cervix. Cancer Treat Rep 1978 Oct;62(10):1435-41.
-
43. Greenberg BR, Kardinal CG, Pajak TF, Bateman JR. Adriamycin versus adriamycin and bleomycin in advanced epidermoid carcinoma of the cervix. Cancer Treat Rep 1977 Oct;61(7):1383-4.
-
44. Barlow JJ, Piver MS, Chuang JT, Cortes EP, Onuma T, Holland JF. Adriamycin and bleomycin, alone and in combination, in gynecologic cancers. Cancer 1973 Oct;32(4):735-43.
-
45. Monk BJ, Sill MW, McMeekin DS, Cohn DE, Ramondetta LM, Boardman CH, et al. Phase III trial of four cisplatin-containing doublet combinations in stage IVB, recurrent, or persistent cervical carcinoma: a Gynecologic Oncology Group study. J Clin Oncol 2009 Oct 1;27(28):4649-55.