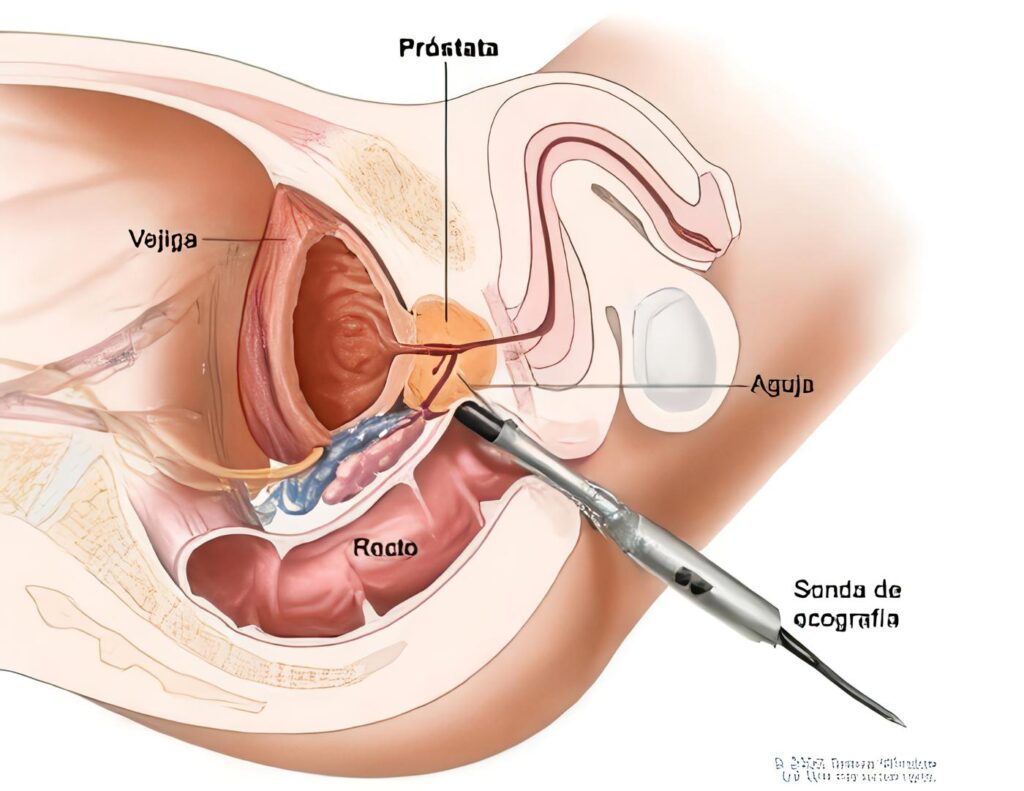
Entre las ventajas prácticas del sistema de graduación de Gleason; se cuentan la facilidad que existe en cuanto al aprendizaje y posterior aplicación del mismo, basados en el reconocimiento de los patrones a baja magnificación microscópica; así como su aplicación con relación al tiempo empleado, el cual es menor al realizar el análisis, que en aquellos sistemas de graduación en donde se examinan figuras citológicas20,21.
Así mismo, histopatológicamente, este sistema tiene éxito en:
1. Identificación de patrones histológicos, por el grado de diferenciación glandular, sin tener en cuenta modelos histogenéticos o morfogenéticos.
2. Estabilidad de representación esquemática simplificada y estandarizada.
3. Información prospectiva que permite un desarrollo objetivo por si solo, de este sistema de graduación.
4. Información acerca de la heterogeneidad tumoral y comportamiento biológico del mismo3.
5. Buena correlación (hasta 80 %), al predecir el grado de Gleason, tanto en la citología por aspiración con aguja fina, como en la biopsia trucut14,15,16,18.
Entre las desventajas del sistema de Gleason citadas por Mostofi y Goeta, se cuentan el hecho de considerar únicamente un patrón glandular, sin tener en cuenta figuras citológicas tales como la anaplasia nuclear ya que los cambios nucleares y glandulares no pueden ser considerados en la mayoría de los casos como variables independientes1,3, el bajo poder predictivo en lo referente al pronóstico de pacientes con Gleason intermedio,en quienes se considera incierto2; y la pobre correlación que puede tener este sistema de clasificación al correlacionar Gleason en biopsias vs. Gleason del especimen quirúrgico17,21.
Con miras a lograr una mayor sensibilidad y especificidad de este sistema de clasificación; se han propuesto modificaciones que incluyen la graduación morfométrica y nuclear, el empleo del Gleason no comprimido sino de forma individual, la correlación volumen-grado tumoral (pronóstico de metástasis) y la correcta diferenciación histopatológica entre algunas entidades que pueden generar confusión al momento del diagnóstico tales como la hiperplasia intraglandular atípica (adenosis) versus adenocarcinoma bien diferenciado, e hiperplasia intraductal atípica (PIN) variedad cribiforme versus cáncer de próstata de tipo cribiforme3,6,7,8.
Reproductibilidad del sistema de graduación de Gleason
La variabilidad intraobservador e interobservador ha sido reportada con Gleason y otros sistemas de graduación. La naturaleza subjetiva de los sistemas de graduación carece de absoluta precisión, sin importar que tan cuidadosamente definido haya sido el sistema empleado.
Gleason en su experiencia personal obtuvo una reproducibilidad que oscilaba entre el 50% y el 80% en biopsias con aguja1,3.
Algunos observadores han expresado sus dudas acerca del sistema de graduación de Gleason, a causa de la significativa variabilidad entre diferentes observadores. DiLoreto y colaboradores encontraron un alto nivel de discordancia entre 3 patólogos, que evaluaron 41 casos con cáncer entre bien y moderadamente diferenciado8.
Para perfeccionar el análisis; los autores comprimieron el score de Gleason en 3 grupos: 2-5, 6-7, 8-10, comparando el pronóstico con base en 5 sistemas de graduación (Broders, Gleason, Anderson, Mostofi y Mostofi-Schroeder) en 50 especímenes de prostatectomía y promediaron los resultados de 5 patólogos para reducir el efecto de variabilidad interobservador. Utilizando como variables tiempo de recurrencia y tiempo de muerte, encontraron que el sistema de Gleason presentó la menor capacidad predictiva razonable, a pesar del alto grado de variabilidad interobservador12.
Contrariamente, Cintra y Billis11, compararon el nivel de concordancia intraobservador, con los sistemas de Gleason, Mostofi y Bocking, y no encontraron diferencias significativas y el nivel de variabilidad no fué afectado por el tipo de especimen o la cantidad de tejido examinado.
Ozdomar y Sarikaya10, evaluando la reproducibilidad inter e intraobservador con los sistemas de la W.H.O. y Gleason, no encontraron diferencias significativas (p>0,005) intra e interobservador en el sistema Gleason, pero encontraron diferencias significativas intra e interobservador en el sistema de la WHO(p<0,05).
Epstein, Grignon, Mcneal, del departamento de patología del Hospital Johns Hopkins de Baltimore, realizaron un estudio similar a los anteriormente mencionados buscando el grado de reproductibilidad interobservador en el diagnóstico de PIN; encontrando gran variabilidad interobservador para el diagnóstico de PIN 1. Hecho que les sirvió como soporte para no continuar reportando PIN 1 en material de biopsias de próstata. Sin embargo, encontraron buena correlación en el diagnóstico de PIN 1 reconocido como de Bajo Grado y PIN 2-3 como de Alto Grado, sin reportar como se hacía anteriormente el diagnóstico de PIN 2 o de Grado Intermedio9.
A pesar de todos los interrogantes y controversias que existen en torno a la reproductibilidad exacta, tanto inter como intraobservador con base en los sistemas de Gleason, la experiencia colectiva apoya la utilidad clínica de la graduación del mismo considerándolo como uno de los más poderosos predictores del comportamiento biológico del cáncer de próstata (incluyendo invasividad y poder metastásico), pero no lo suficientemente confiable al ser utilizado en forma individual para predecir estado patológico del paciente, sobrevida y conducta terapéutica, como se realizaría si además se contara con otros predictores como edad, comorbilidad, estadío clínico y nivel de PSA3.
Objetivos
A. Generales
1. Establecer y unificar criterios morfológicos en el Departamento de Patología del Hospital San Ignacio para los distintos grados de Gleason en el diagnóstico de adenocarcinoma de próstata.
B. Específicos
1. Establecer el grado de concordancia intraobservador de cada patólogo participante en el estudio.
2. Establecer el grado de concordancia interobservador entre los médicos patólogos participantes en el estudio.
Materiales y métodos
1. TIPO DE ESTUDIO: retrospectivo de concordancia.
2. POBLACION: la constituyen las biopsias transrectales de próstata en las que se hizo diagnóstico de adenocarcinoma de próstata.
3. TAMAÑO DE MUESTRA: la constituyen 30 casos, obtenidos del archivo ubicado en el Departamento de Patología del Hospital San Ignacio.
4. CRITERIOS DE INCLUSION: casos con diagnóstico morfológico de adenocarcinoma de próstata realizado en el Departamento de Patologia del Hospital San Ignacio, en un espacio de tiempo comprendido entre enero de 1996 y julio de 1997 y cuyas placas se encuentran en el archivo del servicio anteriormente mencionado, pertenecientes a pacientes captados por la consulta de Urología de la misma institución o remitidos para estudio por otros centros de atención
5. CRITERIOS DE EXCLUSION: acuerdo entre los patólogos que intervienen en el estudio de que el material es inadecuado para realizar un diagnóstico preciso.
6. METODO: antes de comenzar con el análisis de cada caso se realizó una revisión de la literatura, con una posterior reunión de los participantes en el estudio donde se establecieron de forma específica los criterios morfológicos segun el grado (I,II,III,IV,V) de la clasificación de Gleason a tener en cuenta en el momento de realizar el análisis de cada caso (Anexo 1). En la primera fase del estudio, se repartieron a cada uno de los patólogos, series de 5 casos por semana, sin conocimiento previo del diagnóstico por parte de ninguno de ellos.
Cada caso se identificó con un número arábigo, que fue asignado aleatoriamente y así mismo se entregó un formulario que contenía cada una de las posibilidades a tenerse en cuenta, en donde se recogió la información.
Después de la primera fase, se realizó una segunda fase, con un intervalo de 1 mes, en la que se revisaron nuevamente los mismos casos con nueva rotulación y numeración.
9. ANALISIS DE RESULTADOS: análisis de Concordancia KAPPA PONDERADO, para variables ordinales, con asignación de pesos o factores de ponderación según el grado de discordancia de las observaciones realizadas tanto intra como interobservador, considerado como BUENO, con valores > ó = a 0,5.
Resultados
A. Tabulación de datos
1. Total de observaciones: 180.
| 2. Clasificación de observaciones:Gleason Score(2 -10)3. Agrupación de observaciones:Bien diferenciado (2 – 4) Moderada/diferenciado (5 – 6) Mal diferenciado (7 -10) |
4. Evaluación de observaciones según ESCALA KAPPA(Nominal)
DEBIL : 0,0 – 0,2.
BUENA : 0,2 – 0,4
(> ó = 0,5 en escala ordinal)
MODERADA : 0,4 – 0,6.
SUSTANCIAL : 0,6 – 0,8.
CASI PERFECTA : 0,8 – 0,10.
B. Análisis de resultados
1. Una de las placas seleccionadas al azar incluída inicialmente en el estudio, fue evaluada por los tres patólogos participantes coincidiendo en las observaciones realizadas en Fase I y II, en la ausencia de cáncer de próstata en el material examinado. Hecho que se puede atribuir a la presencia de cáncer en cortes de la misma pieza pero a otro nivel y en otras placas de las cuales no se pudo disponer en ese momento para su estudio.
Es de anotar que para el análisis posterior del estudio en mención, estas observaciones no fueron tenidas en cuenta.
2. Para lograr uniformidad y poder así estadificar y procesar estadísticamente los datos previamente tabulados, fue necesario agrupar los diferentes Scores de Gleason en tres grupos discriminados de la siguiente forma:
– Grupo 1: Gl. Score 2 – 4.
– Grupo 2: Gl. Score 5 – 6.
– Grupo 3: Gl. Score 7 – 10.
3. El grado de concordancia intraobservador fue mayor en los grupos peor diferenciados (5 – 10), que en los bien diferenciados (2 – 4).
4. El grado de concordancia intraobservador (Kappa Ponderado) fue de 0,5862 para el patólogo 2 y 0,5977 para los patólogos 1 y 3, sugiriéndose un nivel moderado de concordancia para los tres patólogos que participaron en el estudio.
5. El grado de concordancia interobservador (Kappa Ponderado) osciló entre 0,4712 – 0,5287 en la Fase 1, y 0,5172 – 0,5862 en la Fase 2, con resultados definitivos de concordancia entre Fase 1 + Fase 2 que se mantuvieron entre rangos de 0,5057 – 0,5517, registrándose el mayor índice de concordancia kappa entre el patólogo 1 y el patólogo 3.
Conclusiones
1. Existió una mayor dificultad para lograr una concordancia tanto intra como interobservador, en la evaluación de biopsias transrectales de próstata con carcinoma de próstata bien diferenciado.
2. No se registraron dudas ó errores diagnósticos al clasificar los diferentes casos en estudio (bajo grado vs alto grado), por parte de ninguno de los patólogos participantes en el estudio.
3. El mayor grado de concordancia tanto intra como interobservador se obtuvo en el diagnóstico de carcinoma de próstata de alto grado.
4. Los índices de concordancia Kappa tanto intra como interobservador, registraron niveles de incremento al analizar las diferentes fases del estudio, hallazgo atribuible al proceso de aprendizaje que se derivó del anterior estudio.
5. Los índices de concordancia intraobservador e interobservador de los patólogos del Hospital Universitario de San Ignacio que colaboraron en la realización del análisis anteriormente descrito, según la Escala Cualitativa de Validación Kappa para variables ordinales, se ubicaron en el rango entre 0.4 – 0.6, correspondiéndoles un nivel BUENO de concordancia.
Anexo 1 Criterios histopatologicos de grados de Gleason para valoración de biopsias transrectales de próstata
GLEASON 1: Glándulas uniformes, pequeñas, en estrecho contacto con escaso estroma. Patrón de crecimiento expansivo con bordes bien circunscritos.
GLEASON 2: Hay ligera variación en forma y tamaño de las glándulas con mayor separación entre ellas y mayor cantidad de estroma. Aunque el patrón de crecimiento continua siendo expansivo los bordes son menos bien circunscritos.
GLEASON 3: Marcada variación en tamaño y forma de las glándulas. Pueden observarse areas cribiformes y papilares pero bien circunscritas. El patrón de crecimiento se torna infiltrativo constituido por estructuras glandulares.
GLEASON 4: Masas de estructuras glandulares con patrón cribiforme, de bordes irregulares. Puede observarse el patrón de célula clara conocido como hipernefroide. Patrón de crecimiento infiltrativo, muy irregular, constituido por estructuras cribiformes o cordones.
GLEASON 5: Patrón predominantemente sólido, sin diferenciación glandular. Pueden observarse areas de comedocarcinoma con necrosis central.
Bibliografía
1. Mostofi FK, Davis Ch. J, Sesterhenn IA. Pathology of Carcinoma of the Prostate (Suppl.). Cancer 1.992 Jul 1, 1.992. Vol 70. No. 1.
2. Epstein JI. Grading of Prostatic Adenocarcinomas. Biopsy Interpretation Series. Departments of pathology and Urology, John Hopkins University School of Medicine. Baltimore, Maryland, 1.984.
3. Bostwick DG. Grading Prostate Cancer. (Suppl. 1). Am J Clin Pathol 1.994, Vol. 102. No. 2.
4. Helpap B. Review of the morphology of Prostatic Carcinoma with special emphasis on subgrading and prognosis. J.Urol. Pathol, 1.993; 3-19.
5. Thomas R, Lewis R, Sarma D, et al. Aid to accurate clinical staging – histopathologic grading in prostatic cancer. J.Urol.,1.982; 128: 726-728.
6. McNeal JE, Villers AA, Redwine EA, Freiha FS, Stamey TA. Histologic differentiation, cancer volume, and pelvic lymph node metastasis in adenocarcinoma of the prostate. Cancer, 1.990; 52: 246-251.
7. McNeal JE, Reese JH, Redwine EA, Freiha FS,Stamey TA. Cribiform adenocarcinoma of the prostate. Cancer 1.986; 58: 1714-1719.
8. DiLoreto C, Fitzpatrick B, UnderHill SH, Kim DH. Correlation between visual clues, objective architectural features and interobserver. Agreement in prostate cancer. Am J. Clin Pathol., 1.991 Jul; 1: 70-5.
9. Epstein JI, Grignon DJ,Humprey PA,McNeal JE. Interobserver reproducibility in the diagnosis of prostatic intraepithelial neoplasia. Am J. Surg Pathol., 1.995Aug,19:8, 873-86.
10. Ozdamar SO, Sarikaya S. Intraobserver and interobserver reproducibility of WHO and Gleason histologic grading systems in prostatic adenocarcinomas. Int Urol. Nephrol, 1.996, 28; 1, 73-7.
11. Cintra ML, Billis A. Histologic grading of prostatic adenocarcinoma; intraobserver reproducibility of the Mostofi, Gleason and Bocking, grading systems. Int Urol. Nephrol, 1.991, 23:5, 449-54.
12. Galler MP, Ten Kate FJ, Mulder PG,Blom JH. Histological grading of prostatic carcinoma in prostatectomy specimens. Comparison of prognostic accuracy of five grading systems. Br. J Urol. 1.990;65:368-75.
13. Gleason DF. Histologic grading of prostate cancer; a perspective. Hum. Pathol. 1.992; 23: 273-79.
14. Chodak G, Steinberg D, Bibbo M. The role of transrectal aspiration biopsy in the diagnosis of prostatic cancer. J. Urol. 1.986; 135: 299-302
15. Carter B, Riehle R, Koizumi J. Fine needle aspiration of the abnormal prostate: A cytohistological correlation. J. Urol. 1.986; 135: 294-298.
16. Layfield L, Mukamel E. Cytological grading of prostatic aspiration biopsy; a comparison with the Gleason grading system. J. Urol 1.987; 138: 798-800
17. Bostwick DG. Gleason Grading of Prostatic Needle Biopsies. Correlation with grade in 316 matched prostatectomies. Am J Surg. Pathol 1.994; 18(8): 796-803.
18. Garnett JE. The accuracy of diagnostic biopsy specimens in predicting tumor grades by Gleason¨s classifications of radical prostatectomy specimens. J Urol. 1.984; 131: 690-693.
19. Reuter V.E. Male Reproductive System: Rosai J,ed. Ackermans Surgical Pathology. New York: Mosby, 1.993: 1221 – 1246.
20. Epstein. JI. The Prostate and Seminal Vesicles. Sternberg S.S, ed. Diagnostic Surgical Pathology. New York: Raven Press, 1.994: 1804 – 1847.
21. Steinberg. DM, Epstein JI, Piantadosi. S. Correlation of Prostate Needle Biopsy and Radical Prostatectomy Gleason Grade in Academic and Community Settings. J.Surg. Pathol. 1997, 21 (5): 566 – 576.