Tratamiento
Las principales indicaciones para manejo endoscópico del CCT de localización en el TUS son:
- Asociado a insuficiencia renal,
- Paciente monorreno,
- Compromiso bilateral,
- Contraindicaciones a la cirugía abierta,
- Preferencia del paciente.
También el manejo endoscópico definitivo esta indicado en aquellos que no tengan una enfermedad músculo invasora o de alto grado en el espécimen inicial y recientemente se esta evaluando otra indicación: Paciente con riñón contralateral normal19.
Para el manejo mínimamente invasivo existen dos alternativas: manejo ureteroscópico o percutáneo, la decisión depende del tamaño, localización exacta del tumor y el número de tumores presentes.
El consenso actualmente esta en que lesiones menores o iguales a un centímetro (1 cm), únicas en número y localizadas en el uréter son susceptibles de manejo ureteroscópicos, mientras que aquellas mayores a 1 cm o de localización piélica o intracaliceal a tratamiento percutáneo.
El tratamiento ureteroscópico se puede realizar con un equipo flexible, semirígido o rígido, en caso de utilizar electro-resección con asa de corte, solo se deben utilizar guías hidrofílicas y líquidos de irrigación como glicina 1.5% o dextrosa, que no son elementos conductores de electricidad.
Una vez identificada la lesión, se debe realizar su extracción, sea con pinza para biopsia fría, canastilla o asa de corte, luego se recomienda la fulguración de la base de la lesión. Algunos autores recomiendan el uso de camisas ure terales para evitar lesiones por el paso frecuente del equipo1 .
El uso del láser
Esta demostrando grandes beneficios y por ello su utilización en los principales centro de urología en el mundo. Es una herramienta altamente efectiva para el tratamiento y extirpación de lesiones tumorales localizadas en el TUS.
Se encuentran disponibles el Neodimium YAG láser y el Holmium YAG láser, el primero no requiere de contacto íntimo con la superficie a tratar, maneja una intensidad de 20 a 40 Watts y logra una ablación con una profundidad de hasta 6mm, es decir es buena para procedimientos con resección profunda; en cambio el Holmium requiere de 1 Joules, logra una ablación superficial de tan solo 0.4 mm de profundidad, por lo que se convierte en el ideal para su uso en uréter, donde la pared es muy delgada y puede realizarse una perforación fácil, además no requiere de contacto íntimo con la lesión a tratar.
Aunque existe controversia, el uso del láser tiene la gran ventaja de disminuir la posibilidad de estenosis ureteral17,18. Sin embargo lesiones con compromiso de la totalidad de la circunferencia ureteral no se debe tratar con este tipo de alternativas por alto riesgo de estrechez17.
En caso de resecciones extensas se recomienda uso de catéter doble J (stent ureteral) por 14 días y si existe perforación debe permanecer por 4 a 6 semanas.
Manejo ureteroscópico del CCT en el TUS
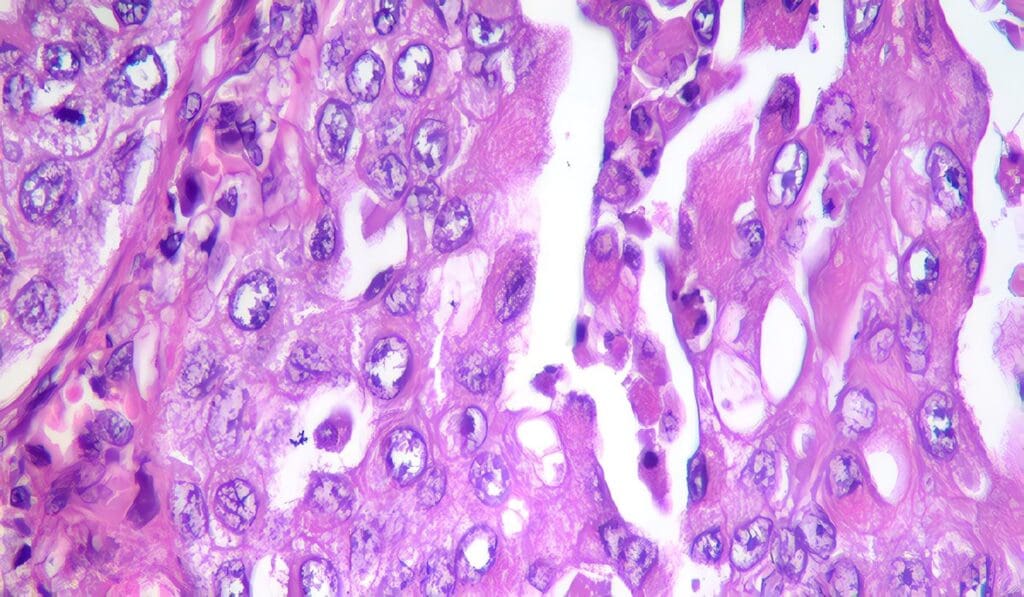
Múltiples series han demostrado la eficacia del manejo ureteroscópico del CCT en el TUS y los resultados de análisis estadísticos indican que no se compromete la sobrevida con este tipo de tratamiento conservador, pero su buen resultado depende de la existencia de ciertos factores pronósticos: el tamaño de la lesión (mayores de 1.5cm tienen alta tasa de recurrencia) y la presencia de multifocalidad versus lesión solitaria (recurrencia del 50% versus 19% respectivamente) debido a la alta probabilidad de resección incompleta.
También el grado histológico y el estadiaje de la enfermedad son considerados factores pronósticos, incluso los más importantes19, la literatura describe que lesiones de bajo grado tienen una sobrevida del 100%, mientras que en las de alto grado se disminuye al 60%. A su vez el grado del tumor es un fuerte predictor del estadio del tumor, Charbit et al encontraron que el 72% de los tumores grado 2 y 3 invadían ya la capa muscular o el parénquima renal al momento del diagnóstico.
Cuando se realizó la linfadenectomía en una serie, ésta fue negativa en todos los casos de tumores de bajo grado y positiva en el 39% de los tumores de alto grado22.
La tasa de recurrencia vesical luego de la realización de este tipo de procedimientos es en promedio del 36%, cuando se compara a la que sucede luego de la nefroureterectomía (25-30%) no existe una diferencia estadísticamente significativa.
La tasa de recurrencia total en el tracto urinario es del 34% luego de tratamiento endoscópico1 . En el estudio reportado por Murphy et al en la Cleveland Clinic Foundation la tasa de recurrencia vesical fue del 16.7%16.
Todos estos hechos son las razones que conllevan a promover hoy en día a conservar y preservar las unidades renales afectadas por un CCT.
Terapia Adyuvente
Existen múltiples estudios que hacen mención de la utilización de diversos agentes en instilación anterógrada o retrograda luego de la realización de un manejo endoscópico del CCT localizado en TUS, algunos son BCG, mitomicina C, Tiotepa, 5-fluoracilo e interferón23.
Aunque no existe hoy la real evidencia de su utilización, el soporte en la literatura es de ser un procedimiento seguro, bien tolerado y con baja tasa de complicaciones. Las respuestas más favorables son descritas con BCG y Mitomicina C. Esta última por su alto peso molecular, tiene una absorción muy limitada en la mucosa del tracto urinario24.
La dosificación, frecuencia y duración no han sido sistemáticamente evaluadas1 . Pacientes con alto riesgo de recurrencia, aque llos con un volumen tumoral importante (mayor 1cm), recurrencia o multifocalidad, la instilación de mitomicina C es recomendada; se realiza la noche o el día después del procedimiento endoscópico y una vez se encuentre sin hematuria.
La instilación a través de un catéter ureteral de una dosis de 40 miligramos de mitomicina C dividida en tres dosis, dejando clampado el catéter por un espacio de 10 minutos con cada aplicación y repitiendo cada 30 minutos, por aproximadamente 4 ciclos, demostró por Keeley et al, en su experiencia con 19 pacientes con una media de seguimiento de 30 meses, una tasa de respuesta del 58% y en el 62% de estos no se dió progresión de la enfermedad, por lo tanto sin requerir extirpación quirúrgica de la unidad renal tratada24.
Las complicaciones descritas, principalmente atribuibles al uso de inmunoterapia con BCG son sepsis bacteriana, fiebre (5%) y desarrollo de enfermedad granulomatosa (25%) y más raro con quimioterapia la agranulocitosis tóxica por mitomicina C (un caso reportado).
Seguimiento
Por la conocida recurrencia de esta enfermedad el seguimiento activo de este tipo de paciente es imperativo. Este debe ser siempre por medio endoscópico (evaluación directa), la imagenología no esta indicada, pues más del 75% de las recurrencias del CCT solo son posibles de diagnosticar endoscópicamente25. La ureteroscopia con biopsia/citología ha demostrado una sensibilidad y especificidad del 93.4% y 65.2% respectivamente; la citología urinaria sola del 50 y 100% respectivamente, por el contrario la pielografía retrograda una sensibilidad del 71.7% y una especificidad del 84.7%19.
Múltiples alternativas de seguimiento están propuestas en la literatura, la recomendada por Gupta et al es ureteroscopia cada 3 meses hasta lograr evaluar el trayecto ureteral sin lesiones, seguido por cistoscopia cada tres meses y ureteroscopia cada 6 me ses por los dos primeros años, continuando por el resto de la vida con cistoscopia cada 6 meses y ureteroscopia flexible cada año. Se recomienda también con igual intervalo de tiempo la realización de citología urinaria1 .
(Lea También: Una Teoría General de la Función y la Disfunción Erectil)
Conclusiones
Nuestra revisión de el manejo endoscópico del CCT localizado en el TUS nos permite ofrecer una guía para el tratamiento en diversos tipos de pacientes.
Con el advenimiento de las técnicas mínimamente invasivas el tratamiento de muchas de las patologías del tracto urinario son susceptible a un manejo conservador, es así como lesiones tumorales por CCT localizados en el TUS que sean de bajo grado, bajo estadiaje y únicas en número deben ser, idealmente llevados a este tipo de manejo.
Para esos pacientes quienes no son candidatos de esta opción terapéutica, la cirugía radical es la opción definitiva, aunque sugerimos sea por abordaje laparoscópico.
Bibliografía
- 1. Lam JS, Gupta M. Ureteroscopic management of upper tract transitional cell carcinoma. Urol Clin N Am 2004; 31: 115-28.
- 2. Clayman RV, Kavoussi LR, Figenshau RS, Chandhoke PS and Albala DM. Laparoscopic nephroureterectomy: initial clinical case report. J Laparoendosc Surg 1991; 1(6): 343-49.
- 3. Messing EM. Urothelial tumors of the urinary tract. En: Walsh PC, Retik AB, Vaughan ED Jr et al, editors. Campbell’s urology, 8ª Ed. Philadelphia: W.B. Saunders; 2002; 4: 2765–84.
- 4. Uchida T, Wang C, Wada C, et al. Microsatellite instability in transitional cell carcinoma of the urinary tract and its relationship to clinicopathological variables and smoking. Int J Cancer 1996;69:142-145.
- 5. McLaughlin JK, Silverman DT, Hsing AW, et al. Cigarette smoking and cancers of the renal pelvis and ureter. Cancer Res 1992; 52: 254-257.
- 6. Dodd LG, Johnston WW, Robertson CN, et al. Endoscopic brush cytology of the upper urinary tract: evaluation of its efficacy and potential limitations in diagnosis. Acta Cytol 1997; 41: 377–84.
- 7. Gittes RF. Retrograde brushing and nephroscopy in the diagnosis of upper tract urothelial cancer. Urol Clin North Am 1980; 11: 617–22.
- 8. Keeley FX, Kulp DA, Bibbo M, et al. Diagnostic accuracy of ureteroscopic biopsy in upper tract transitional cell carcinoma. J Urol 1997; 157: 33–7.
- 9. Skolarikos A, Griffiths TRL, Powell PH, Thomas DJ, Neal DE, Kelly JD. Cytologic analysis of ureteral washings is informative in patients with grade 2 upper tract TCC considering endoscopic treatment. Urology 2003; 61(6): 1146-50.
- 10. Liu JB, Miller LS, Bagley DH, Goldberg BB. Endoluminal Sonography of the Genitourinary and Gastrointestinal Tracts. J Ultrasound Med 2002; 21: 323–37.
Referencias
- 11. Shiraishi K, Eguchi S, Mohri J, Kamiryo Y. Role of ureteroscopic biopsy in the management of upper urinary tract malignancy. International Journal of Urology 2003; 10: 627–30.
- 12. El-Hakim A, Weiss Gh, Lee Br, Smith Ad. Correlation Of Ureteroscopic Appearance With Histologic Grade Of Upper Tract Transitional Cell Carcinoma. Urology 2004; 63: 647–50.
- 13. Keeley FX, Bibbo M, McCue PA, et al. Use of p53 in the diagnosis of upper tract transitional cell carcinoma. Urology 1997; 49: 181–6.
- 14. Tatu CA, Orem WH, Finkelman RB, Feder GL. The etiology of Balkan endemic nephropathy: still more questions than answers. Environ Health Perspect. 1998; 106(11): 689-700.
- 15. Stefanovi V. Balkan endemic nephropathy. A reaprrisal after forty years. Medicine and biology 1999; 6(1): 53– 58.
- 16. Murphy DP, Gill IS, Streem SB. Evolving management of Upper-tract transitional-cell carcinoma At a Tertiarycare Center. J Endourol 2002; 17(7): 483-7.
- 17. Keeley FX Jr, Bibbo M, Bagley DH. Ureteroscopic treatment and surveillance of upper urinary tract transitional cell carcinoma. J Urol 1997;157:1560-5.
- 18. Martinez-Pineiro JA, García Matres MJ. Endourological treatment of upper tract urothelial carcinomas: analysis of a series of 59 tumors. J Urol 1996;156:377-85
- 19. Lee D, Trabulsi E, McGinnis D, Strup S, Gomella LG, Bagley D. Totally endoscopic management of upper tract transitional-cell carcinoma. J Endourol 2002; 16(1): 37- 41.
- 20. El-Hakim A, Weiss GH, Lee BR, Smith AD. Correlation of uretersocopic appearance with histologic grade of upper tract transitional cell carcinoma. Urology 2004; 63(4): 647
- 21. Skolarikos A, Griffiths TRL, Powell PH, Thomas DJ, Neal DE, Kelly JD. Cytologic analysis of ureteral washings is informative in patients with grade 2 upper tract TCC considering endoscopic treatment. Urology 2003;61(6):1146-50.
Fuentes
- 22. Charbit L, Gendreau MC, Mee S, et al. Tumors of the upper urinary tract: 10 years experience. J Urol 1991;146:1243–6.
- 23. Patel A, Fuchs GJ. New techniques for the administration of topical adjuvant therapy after endoscopic abla tion of upper urinary tract transitional cell carcinoma. J Urol 1998;159:71–5.
- 24. Keeley FX Jr, Bagley DH. Adjuvant mitomycin C following endoscopic treatment of upper tract transitional cell carcinoma. J Urol 1997; 158(6): 2074-2077.
- 25. Chen GL, El-Gabry EA, Bagley DH. Surveillance of upper urinary tract transitional cell carcinoma: the role of ureteroscopy, retrograde pyelography, cytology, and urinalysis. J Urol 2000;165:1901–4.
Enviado para publicación: Noviembre de 2006
Aceptado para publicación: Noviembre de 2006