MENCIÓN DE HONOR
EN TRABAJOS DE ONCOLOGÍA UROLÓGICA
Análisis Clínico y Anatomopatológico de 202 casos tratados con Prostatectomía Radical
Drs. Arbeláez Arango S.1-3, Aguiló Lúcia F.1, Condom Mundó E.2, Escobar Jaramillo F.3, Suarez Novo J.1,
Vigués Julia F.1, Serrallach Mila N.1
Servicio de Urología1, Servicio de Patología2, Hospital Universitario de Bellvitge, Barcelona, España. Servicio de Urología3,
Clínica Medellín, Colombia.
Introducción
En los países de la Unión Europea el carcinoma de próstata ocupa el segundo lugar en frecuencia después del cáncer de pulmón.
La incidencia de esta patología para la población española, europea y mundial es de 120,1, 103,5 y 68,6 casos por 100.000 hombres respectivamente1. La posibilidad de desarrollar un carcinoma de próstata a lo largo de la vida se estima en un 17% (uno de cada 6 hombres), y en un 3% (uno de cada 30 hombres) la posibilidad de morir a causa de este2.
Holmberg y cols3 demostraron la efectividad de la prostatectomía radical en hombres con cáncer de próstata clínicamente localizado, tanto en la disminución de la mortalidad cáncer específica como en la menor posibilidad de desarrollar metástasis a distancia. Tal como lo demostró McNeal4,5,6 el carcinoma de próstata puede originarse en cualquiera de las distintas zonas de la próstata.
Dado que la prostatectomía radical tiene la ventaja sobre las demás técnicas terapéuticas para el carcinoma de próstata clínicamente localizado de poder disponer del espécimen quirúrgico, nos propusimos conocer las características clínicas y anatomopatológicas de los distintos tumores de acuerdo a su localización anterior o posterior en la glándula, tomando la uretra como eje longitudinal de referencia.
Materiales y Métodos
Del total de pacientes diagnosticados de carcinoma de próstata T1c en nuestro centro entre enero 01 de 1999 y diciembre 31 de 2002, se incluyeron en el estudio los 202 a quienes se les realizó una prostatectomía radical retropúbica con técnica ascendente y linfadenectomía iliobturatríz bilateral. Ninguno de los pacientes había tenido tratamientos previos tales como cirugía prostática, manipulación hormonal, radioterapia externa o braquiterapia prostática.
En todos los casos se habían obtenido al menos seis cilindros de biopsia prostática y todos habían tenido estudio de extensión negativo de acuerdo al protocolo de nuestro centro (Tomografía Computarizada abdominopélvica en todos los pacientes y Gammagrafía ósea cuando el PSA era mayor de 20 ng/ml).
Los 202 especímenes de prostatectomía radical y 130 de las biopsias diagnósticas fueron leídas por un único uropatólogo (ECM). Para la graduación tumoral y estadiaje TNM se siguieron los criterios de la American Joint Committee on Cancer (AJCC) de 1997 vigentes en el momento del estudio. En cada caso se analizaron los parámetros clínicos en el momento del diagnóstico y las características anatomopatológicas tanto de las biopsias como del espécimen de prostatectomía radical. En todos los casos se realizó inclusión total para el procesamiento del espécimen quirúrgico.
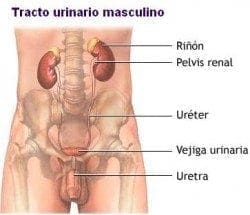
Se definió el diámetro tumoral máximo (DTM) como el diámetro máximo en centímetros del principal foco tumoral presente en la pieza quirúrgica. Tomando la uretra como eje longitudinal de referencia, se identificó donde se encontró el 75% o más del volumen tumoral y de acuerdo a ello se definió cada caso como tumor de predominio anterior, tumor de predominio posterior o tumor simétrico.
El número de focos tumorales se valoró macroscópicamente en la pieza cuando esto fue posible o microscópicamente en su defecto.
Los demás parámetros anatomopatológicos se hicieron siguiendo las recomendaciones del Uropathology Workshop realizado en junio 15 de 2003 en Florencia, Italia7. La información fue analizada con el paquete estadístico SPSS 9,0 para Windows, utilizando estadística descriptiva, análisis de la varianza (ANOVA) y el Test de Scheffe.
Resultados
De los 202 casos analizados, 27 (13,4%) fueron de localización anterior, 136 (67,3%) de localización posterior y 39 (19,3%) simétrica.
El promedio de edad para el grupo total fue de 63,8 años, sin que exista diferencia respecto a la localización del tumor. El promedio de PSA en el momento del diagnóstico fue de 8,8 ng/ml para los tres grupos, existiendo una diferencia estadísticamente significativa entre los tumores de localización anterior respecto a los de localización posterior (p<0,001) y a los de localización simétrica (p=0,021). Promedio de PSA para el grupo anterior, posterior y simétrico fue de 12,0, 8,1 y 9,4 ng/ml respectivamente.
Los tumores de predominio anterior precisaron más sesiones de biopsia para ser diagnosticados. Dentro del grupo de tumores de localización anterior, el 22,2% requirieron más de una sesión de biopsia para ser diagnosticados, mientras que los de localización posterior este hecho sólo se dio en el 10,2% de los casos, sin que existiera diferencia estadísticamente significativa. No se observó diferencia en el valor de Gleason de las biopsias respecto a la localización tumoral, siendo los valores más frecuentes el Gleason 6 (43,1%) y 7 (37,7%). El peso promedio de la pieza quirúrgica fue de 57,4 gr. sin evidenciarse diferencias entre los tres grupos.
El promedio de focos tumorales fue de 3,45 sin haber diferencias respecto a la localización tumoral.
Los tumores de localización anterior presentaron un DTM significativamente mayor que aquellos de predominio posterior (p=0,038), siendo estos 2,72 cm. y 2,26 cm. respectivamente. El Gleason 7 fue el valor más frecuente en el espécimen quirúrgico, sin apreciarse diferencias entre los grupos. No se observaron diferencias significativas en el número de márgenes positivos.
En total se objetivaron 185 episodios de extensión extraprostática en 103 pacientes.
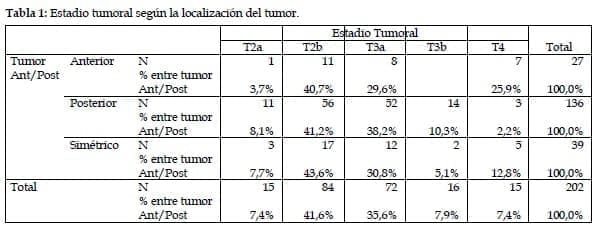
La distribución de los distintos episodios de extensión extraprostática comprometió distintas zonas de acuerdo a la localización tumoral (Figura 1). La distribución por estadio tumoral se presenta en la Tabla 1. Todos los casos pT4 corresponden exclusivamente a la afectación del cuello vesical. En total se observaron 5 casos pN1, correspondiendo todos ellos a tumores de localización posterior.

 Discusión
Discusión
El compartimiento anterior de la próstata incluye los cuernos laterales de la zona periférica, la zona de transición anterior y el estroma fibromuscular, conteniendo todas ellas tejido glandular susceptible de malignización8. En general, son pocas las publicaciones que hacen referencia a la localización del tumor tomando el eje uretral como referencia, hecho que consideramos fundamental en el momento de analizar los demás hallazgos anatomopatoló gicos de la pieza de prostatectomía radical.
Bott y cols.9 utilizando el mismo sistema de distribución, encontraron que los tumores de predominio anterior representaron el 21%, los de predominio posterior el 57% y distribución simétrica en el 22%. Hallazgos coincidentes con nuestra serie.
El PSA de los tumores de predominio anterior respecto al eje longitudinal de la uretra, presentó una diferencia estadísticamente significativa respecto a los de localización posterior y simétrica, siendo el valor de PSA 12,0, 8,1 y 9,4 ng/ml respectivamente. Esta diferencia de PSA está en relación con el mayor volumen tumoral hallado en los tumores de predominio anterior, y también puede estar influenciado por el hecho de que gran parte de los tumores de predominio anterior tengan su origen en la zona transicional de la próstata, que como es sabido, suelen cursar con PSA alto10. Vargas y cols.11, en una serie de 82 casos encontraron que el 94% de los pacientes que tenían PSA mayor ó igual a 9,7 ng/ml tenían tumores de localización anterior; mientras que el 56% de los que tenían PSA inferior a dicho valor tuvieron tumores de localización posterior.
La rentabilidad más baja de la primera sesión de biopsias:
Se dio en el grupo de localización anterior del tumor, donde ésta sólo detectó el 77,8% de los casos, si se compara con el 89,7% de casos con tumor de predominio posterior detectados en la primera sesión de biopsia. La necesidad de más de una sesión de biopsias para llegar al diagnóstico se dio el doble de veces en los casos de predominio anterior que en los de predominio posterior.
Los tumores anteriores tuvieron menos cilindros positivos, 1,9 si se compara con los 2,3 que fueron positivos en los tumores de predominio posterior. Si bien no se alcanzó un valor estadísticamente significativo, probablemente por el número insuficiente de casos, la tendencia es clara en cuanto a la menor rentabilidad de las biopsias en los casos con tumor de predominio anterior.
Técnicamente la toma de biopsias del compartimiento anterior de la próstata es más difícil por la angulación que es necesario dar a la aguja, siendo preciso incluso tocar fibras del esfínter anal en algunos casos, especialmente en próstatas de poco volumen, hecho que genera una marcada incomodidad al paciente.
Los hallazgos anteriores coinciden con los publicados por Bott y cols9, quienes encontraron que los tumores de predominio anterior también precisaron más sesiones de biopsia para ser diagnosticados; igualmente, ellos encontraron que, partiendo de biopsias por sextante, el promedio de cilindros positivos en los tumores de predominio anterior fue de 1,8 mientras que para los de predominio posterior fue de 2,5 cilindros.
Numerosos autores han demostrado que el volumen tumoral en el espécimen de prostatectomía radical se asocia con el pronóstico12,13,14,15,16,17.
Es factible medir el total del volumen tumoral con técnicas de ordenador, pero estas requieren tiempo, dinero y entrenamiento.
La medición macroscópica del DTM en el espécimen de prostatectomía radical, requiere solamente una regla, unos segundos de tiempo y precisa un mínimo entrenamiento, además, es una técnica habitualmente utilizada por los anatomopatólogos en otro tipo de tumores.
Tal como demostraron Renshaw y cols18, la medición macroscópica del diámetro tumoral máximo se correlaciona con la medición del volumen tumoral hecha con un programa de ordenador, mediante el cálculo del área de las imágenes digitales de los tumores.
De acuerdo a lo publicado por Renshaw y cols.19 y D’Amico y cols.20 el diámetro tumoral máximo predice en forma independiente la recidiva de PSA tras la prostatectomía radical.
Según sus hallazgos, en una serie de 434 pacientes con un promedio de PSA preoperatorio de 11,1 ng/ml, y con un seguimiento medio de 22,5 meses, sólo el 15% de los pacientes que tenían tumores con un DTM inferior a un centímetro presentaron recidiva bioquímica tras la prostatectomía radical, mientras que sí la presentaron el 73% de los pacientes con un diámetro tumoral máximo superior a 2 cm. En el artículo no se especifica la localización del tumor, el valor de Gleason ni el valor de PSA en los distintos casos.
El diámetro tumoral máximo encontrado en nuestra serie fue en promedio de 2,38 cm, valor muy elevado si se compara con la literatura, e implica teóricamente un alto riesgo de recidiva bioquímica para la mayoría de los pacientes. El valor real de esta diferencia es incierto y averiguarlo está fuera del objetivo de este trabajo, pero será sin duda un elemento interesante a tener en cuenta en el seguimiento de los pacientes incluidos en esta serie.
Igualmente, los tumores de predominio anterior también presentaron mayor volumen tumoral.
Se encontró una diferencia estadísticamente:
Significativa entre el DTM de los tumores de predominio anterior y los de predominio posterior, siendo estos de 2,2 cm y 2,7 cm respectivamente. La revisión de la literatura en este aspecto demuestra resultados dispares.
Bott y cols9 no encontraron diferencia significativa entre el volumen tumoral de los tumores anteriores o posteriores, a diferencia de Vargas y cols11 que sí encontraron diferencia estadísticamente significativa entre el volumen tumoral de los tumores con componente anterior o posterior (1,95 ml y 1,34 ml respectivamente).
Al estudiar en nuestra serie la variable extensión extraprostática en relación a la localización del tumor, se comprobó que, dentro del grupo de casos con tumor de predominio anterior, el 36,1% de los episodios de extensión extraprostática afectó la región anterior de la próstata, mientras que en los casos con tumor de predominio posterior esta región se afectó solamente en el 1,9%.
Igualmente, la extensión extraprostática a nivel del cuello vesical fue más frecuente en los casos con tumor de predominio anterior, en una proporción de 10 a 1 al compararlo con los casos con tumor de predominio posterior.
Como era predecible, en los casos con tumor de predominio posterior se observó una mayor tendencia a presentar extensión extraprostática en la zona posterolateral de la próstata (65,1%) cuando se comparó con los casos con tumor de predominio anterior (11,1%), dado que a este nivel existen factores anatómicos que facilitan la extensión extraprostática del tumor, como la casi inexistencia de cápsula prostática a este nivel y la menor cantidad de tejido prostático no neoplásico que pueda retrazar la exteriorización del tumor.
La extensión extraprostática a nivel del ápex se observó en una tercera parte del total de casos de afectación, sin que la localización anterior o posterior del tumor influyera en ello.
La valoración del estadio tumoral según la localización del tumor en nuestra serie, puso de manifiesto que los tumores de predominio anterior presentaron estadio pT4 en el 25,9% de los casos, mientras que éste solamente se dio en el 2,2% de los casos de predominio posterior, todos ellos por afectación del cuello exclusivamente.
Dadas las características anatómicas e histológicas de la próstata, es más probable la afectación del cuello vesical en los tumores de cara anterior. Debido al adelgazamiento y a veces casi inexistencia de la cápsula prostática a este nivel, los acinos glandulares están en íntimo contacto con el cuello vesical y cualquier foco microscópico de carcinoma puede pasar directamente del estadio pT2 al pT4. Por otra parte, es importante recordar la presencia de glándulas intraesfinterianas en la porción craneal de la próstata de acuerdo a la nomenclatura de S. Gil Vernet, que previamente habían sido descritas por Jores, Albarran y Motz99.
En esta serie no se analizó si durante la prostatectomía radical se conservó ó no el cuello vesical, pero en nuestro centro la técnica utilizada implica generalmente la preservación del mismo. Bianco y cols21, en el análisis de 555 prostatectomías radicales encontraron que la preservación del cuello vesical no incrementa el índice de margen quirúrgico positivo a dicho nivel.
De acuerdo a lo publicado por Wieder y Soloway22, alrededor del 15% de los márgenes tumorales positivos se deben al compromiso del cuello vesical. Para Blute y cols.23 y Sadek y cols.24 la posibilidad de recidiva bioquímica es mayor cuando el margen quirúrgico positivo se da a nivel del cuello vesical que cuando se da a nivel del ápex prostático.
Yossepowitch y cols.25:
Analizaron la evolución de los casos con compromiso del cuello vesical en una serie de 4.090 prostatectomías radicales y encontraron que los casos pT4 por compromiso exclusivo del cuello tenían mejor pronóstico en cuanto a recidiva bioquímica que aquellos con compromiso de vesículas seminales; y en el estudio multivariable no se asoció a peor pronóstico de recidiva el hecho de tener compromiso del cuello vesical.
Por todo ello los autores proponen revisar la clasificación TNM para los casos con afectación única del cuello vesical, idea que compartimos de acuerdo a nuestros resultados. El crecimiento de los tumores de la zona transicional ocurre principalmente hacia la región anterior de la próstata.
Noguchi y cols.26 compararon 79 casos de prostatectomía radical en pacientes con tumores de zona transicional con 79 casos que solamente tenían tumor en la zona periférica, durante el seguimiento a 5 años, el 72% de los pacientes con tumor de zona transicional estuvieron libres de recidiva bioquímica, mientras que sólo lo estuvieron el 49,2% de los pacientes con tumor de la zona periférica, a pesar de que los primeros presentaron mayor volumen tumoral y compromiso extraprostático.
Si bien en nuestra serie los casos con tumor de predominio anterior presentaron unas características que los sitúan en mayor riesgo de progresión de la enfermedad, será la evolución en el tiempo la que determinará el verdadero valor pronóstico de las mismas.
Conclusión
La localización de la mayor masa tumoral respecto al eje longitudinal de la uretra es una medida útil dentro de los parámetros a tener en cuenta en el análisis anatomopatológico de la pieza de prostatectomía radical.
Los tumores con localización de predominio anterior presentan mayor PSA en el momento del diagnóstico, precisan un mayor número de biopsias para ser diagnosticados, presentan más volumen tumoral, y mayor presencia de estadio pT4 por afectación del cuello vesical exclusivamente que aquellos casos con tumor de predominio posterior o simétrico. La posterior evolución de estos pacientes permitirá sacar conclusiones respecto a que tanto influyen estas características anatomopatológicas como factor pronóstico.
Bibliografía
- 1. Herranz F, Arias F, Arrizabalga M, y cols. El cáncer de próstata en la comunidad de Madrid en el año 2000. Actas Urol Esp. 2003; 27:323-334.
- 2. Jemal A, Thomas A, Murria T, Thun M. Cancer Statistics, 2002. J. Clin 2002; 52:181-182.
- 3. Holmberg L, Bill-Axelson A, Helgessen F, et al. A randomized trial comparing radical prostatectomy with watchful waiting in early prostate cancer. N Engl J Med 2002; 347:781- 789.
- 4. McNeal JE: The zonal anatomy of the prostate. Prostate 1981; 2: 35-49.
- 5. McNeal JE, Redwine EA, Freiha FS, Stamey TA: Zonal distribution of prostatic carcinoma. Correlation with histologic pattern and direction of spread. Am J Sur Pathol 1988; 12: 897-906.
- 6. McNeal JE. The prostate and prostatic uretra: a morphological sintesis. J Urol 1972; 107:1008-1012.
- 7. Monitoring R, van der Kats T, Boccon-Gibod L, et al. Handling and pathology reporting of radical prostatectomy specimens. Eur Urol 2003; 44:626-636.
- 8. Tiguert R, Kabbani W, Sakr W, et al. Origin and racial distribution of glandular tissue in the anterior compartment of the prostate: an autopsy study. Prostate 1999; 39:310-315.
- 9. Bott SRJ, Young MPA, Kellett MJ, Parkinson MC. Anterior prostate cancer: is it more difficult to diagnose? BJU Int 2002; 89:886-889.
- 10. Stamey TA, Dietrick DD, Issa MM. Large, organ confined, impalpable transition zone prostate cancer: Association with metastatic levels of PSA. J Urol 1993; 149:510-515.
- 11. Vargas SO, Jiroutek M, D’Amico AV, Renshaw AA. Distribution of carcinoma in radical prostatectomy specimens in the era of serum PSA testing: Implications for delivery of localized therapy. Am J Clin Pathol 1999; 112: 373-376.
Referencias
- 12. Humphrey PA, Vollmer RT. Intraglandular tumor extent and prognosis in prostate carcinoma. Hum Pathol 1990; 21:799-804.
- 13. Humphrey PA, Frazier HA, Vollmer RT, Paulson DF. Stratification of pathologic features in radicalprostatectomy specimens that are predictive of elevated initial postoperative serum PSA levels. Cancer 1993; 71:1821-1827.
- 14. McNeal JE, Villers AA, Redwinw EA, Stamey TA. Capsular penetration in prostate cancer: significance for natural history and treatment. Am J Surg Pathol 1990; 14:240-247.
- 15. Stamey TA, McNeal JE, Redwine E. Morphometric and clinical studies on 68 consecutive radical prostatectomy. J Urol 1988; 139:1235-1241.
- 16. Epstein JI, Partin AW, Walsh PC. Is tumor volume an independent predictor of progression following radical prostatectomy? A multivariate analysis of 185 clinical stage B adenocarcinomas of the prostate with 5 years of followup. J Urol 1993; 149:1478-1481.
- 17. Partin AW, Epstein JI, Walsh PC. Morphometric measure of tumor volume and percent of gland involvement as predictors of pathological stage in clinical stage B prostate cancer. J Urol 1989; 141:341-345.
- 18. Renshaw AA, Chang H, D’Amico AV. Estimation of tumor volume in radical prostatectomy specimens in routine clinical practice. Am J Clin Pathol 1997; 107:704-708.
- 19. Renshaw AA, Richie JP, D’Amico AV. The greatest dimension of prostate carcinoma is a simple, inexpensive predictor of PSA failure in radical prostatectomy specimens. Cancer 1998; 83:748-752.
- 20. Renshaw AA, Richie JP, D’Amico AV. Maxium diameter of prostatic carcinoma is a simple, inexpensive, and independient predictor of PSA failure in radical prostatectomy specimens. Validation in a cohort of 434 patients. Am J Clin Pathol 1999; 111:641-644.
Fuentes
- 21. Bianco FJ, Grignon DJ, Sakr EA, et al. Radical prostatectomy with bladder neck preservation: Impact on positive margins. Eur Urol 2003; 43:461-466.
- 22. Wieder JA, Soloway MS. Incidence, etiology, location, prevention and treatment of positive surgical margins after radical prostatectomy for prostate cancer. J Urol 1998; 160:299-315.
- 23. Blute ML, Bostwick DG, Bergstralh EK, et al. Anatomic site-specific positive margins in organ-confined prostate cancer and its impact on outcome after radical prostatectomy. Urology 1997; 50:733-739.
- 24. Sadek S, Obek C, Lai S, et al. Positive surgical margins with radical retropubic prostatectomy: Anatomic site-specific pathological analysis and impact on prognosis. J Urol 1999; 161:356-360
- 25. Yossepowitch O, Sircar K, Scardino PT, et al. Bladder neck involvement in pathological stage pT4 radical prostatectomy specimens is not an independient prognostic factor. J Urol 2002; 168:2011-2015.
- 26. Noguchi M, Stamey TA, McNeal J, Yemoto CE. An analysis of 148 consecutive transition zone cancers: clinical and histological characteristics. J Urol 2000; 163:1751-1755.
Notas
- 1 Herranz F, Arias F, Arrizabalga M, y cols. El cáncer de próstata en la comunidad de Madrid en el año 2000. Actas Urol Esp. 2003; 27:323-334.
- 2 Jemal A, Thomas A, Murria T, Thun M. Cancer Statistics, 2002. J. Clin 2002; 52:181-182.
- 3 Holmberg L, Bill-Axelson A, Helgessen F, et al. A randomized trial comparing radical prostatectomy with watchful waiting in early prostate cancer. N Engl J Med 2002; 347:781-789.
- 4 McNeal JE: The zonal anatomy of the prostate. Prostate 1981; 2: 35-49.
- 5 McNeal JE, Redwine EA, Freiha FS, Stamey TA: Zonal distribution of prostatic carcinoma. Correlation with histologic pattern and direction of spread. Am J Sur Pathol 1988; 12: 897-906.
- McNeal JE. The prostate and prostatic uretra: a morphological sintesis. J Urol 1972; 107:1008-1012.
- 7 Montironi R, van der Kwast T, Boccon-Gibod L, et al. Handling and pathology reporting of radical prostatectomy specimens. Eur Urol 2003; 44:626-636.
- 8 Tiguert R, Kabbani W, Sakr W, et al. Origin and racial distribution of glandular tissue in the anterior compartment of the prostate: an autopsy study. Prostate 1999; 39:310-315.
- 9 Bott SRJ, Young MPA, Kellett MJ, Parkinson MC. Anterior prostate cancer: is it more difficult to diagnose? BJU Int 2002; 89:886-889.
- 10 Stamey TA, Dietrick DD, Issa MM. Large, organ confined, impalpable transition zone prostate cancer: Association with metastatic levels of PSA. J Urol 1993; 149:510-515.
- 11 Vargas SO, Jiroutek M, D’Amico AV, Renshaw AA. Distribution of carcinoma in radical prostatectomy specimens in the era of serum PSA testing: Implications for delivery of localized therapy. Am J Clin Pathol 1999; 112: 373-376.
Apunte
- 12 Humphrey PA, Vollmer RT. Intraglandular tumor extent and prognosis in prostate carcinoma. Hum Pathol 1990; 21:799-804.
- 13 Humphrey PA, Frazier HA, Vollmer RT, Paulson DF. Stratification of pathologic features in radicalprostatectomy specimens that are predictive of elevated initial postoperative serum PSA levels. Cancer 1993; 71:1821-1827.
- 14 McNeal JE, Villers AA, Redwinw EA, Stamey TA. Capsular penetration in prostate cancer: significance for natural history and treatment. Am J Surg Pathol 1990; 14:240-247.
- 15 Stamey TA, McNeal JE, Redwine E. Morphometric and clinical studies on 68 consecutive radical prostatectomy. J Urol 1988; 139:1235-1241.
- 16 Epstein JI, Partin AW, Walsh PC. Is tumor volume an independent predictor of progression following radical prostatectomy? A multivariate analysis of 185 clinical stage B adenocarcinomas of the prostate with 5 years of follow-up. J Urol 1993; 149:1478-1481.
- 17 Partin AW, Epstein JI, Walsh PC. Morphometric measure of tumor volume and percent of gland involvement as predictors of pathological stage in clinical stage B prostate cancer. J Urol 1989; 141:341-345.
- 18 Renshaw AA, Chang H, D’Amico AV. Estimation of tumor volume in radical prostatectomy specimens in routine clinical practice. Am J Clin Pathol 1997; 107:704-708.
- 19 Renshaw AA, Richie JP, D’Amico AV. The greatest dimension of prostate carcinoma is a simple, inexpensive predictor of PSA failure in radical prostatectomy specimens. Cancer 1998; 83:748-752.
Mensaje
- 20 Renshaw AA, Richie JP, D’Amico AV. Maxium diameter of prostatic carcinoma is a simple, inexpensive, and independient predictor of PSA failure in radical prostatectomy specimens. Validation in a cohort of 434 patients. Am J Clin Pathol 1999; 111:641-644.
- 21 Bianco FJ, Grignon DJ, Sakr EA, et al. Radical prostatectomy with bladder neck preservation: Impact on positive margins. Eur Urol 2003; 43:461-466.


 Discusión
Discusión