En las tres últimas décadas la disección de los ganglios linfáticos retroperitoneales había sido hecha para estadificar y con propósitos terapéuticos. Inicialmente el concepto de “más es mejor” fue adoptado. El resultado fue la expansión de los límites de la L.R.P. hasta abarcar la presencia de tejidos desde el diafragma hasta las arterias ilíacas en la pelvis y desde uréter a uréter (fig.1) Donohue y col. de la universidad de Indiana popularizaron la vía línea media anterior transabdominal. El retroperitoneo fue expuesto por incisión del peritoneo a lo largo de la raíz del mesenterio del intestino delgado, alrededor del ciego y a lo largo de la gotera cólica derecha (fig,2). 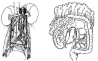
Fig.1 Fig. 2
El intestino fue colocado sobre el tórax envuelto en una compresa. Los ganglios son localizados circunferencialmente alrededor de los grandes vasos (fig. 3)
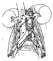
Fig. 3
Basados en esta disposición circunferencial, Donohue desarrolló una técnica de “fraccionar y envolver” (fig.4)
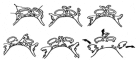
Fig. 4
Esto produce pequeños paquetes de ganglios paracavales e interaórticos paraaórticos izquierdos. Completa disección bilateral producía una completa “limpieza” del retroperitoneo evidenciado por un muy bajo porcentaje de recaída (1-2%) “en el campo”.
Esta cuidadosa disección resultaba en una impotencia eyaculatoria por lesión de las cadenas simpáticas lumbares y ramas simpáticas postganglionares. Al comienzo de los años 80 se iniciaron esfuerzos en varios centros para limitar la extensión de la disección, basándose en el conocimiento de las mas frecuentes áreas con ganglios positivos en pacientes con bajos volúmenes de enfermedad ganglionar. Fraley, antes de la U. De Minnesota, fue el primero en descubrir las “Zonas primarias de aterrizaje” para tumores del lado derecho e izquierdo (fig. 5).
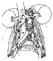
Fig. 5
Estudios de distribución de ganglios positivos de la U. De Indiana en pacientes con estado Clínico II B y II C proporcionaron entendimiento, del consecutivo compromiso de grupos ganglionares en individuos con alto volumen metastásico. En las figuras 6a y 6b se enseñan las posibles rutas de diseminación del tumor.
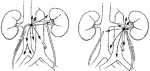
Fig. 6a Fig.6b
Basados sobre estas observaciones y en un mayor conocimiento de la localización del sistema nervioso simpático lumbar, y esfuerzos iniciales tomados en el concepto de que “lo menor puede ser mejor”; se fijaron los modelos de disección para incluir únicamente las zonas que más probablemente contenían los ganglios positivos en aquellos pacientes, con TAC evidente, de bajo volumen o no-compromiso metastásico ganglionar. Estos “modelos modificados” separaban la cadena simpática contralateral y sus fibras postganglionares, lo cual preservaba la eyaculación en un alto porcentaje.
A mediados de los 80 los esperados procedimientos de separación fueron realizados usando unas técnicas de “mini hendiduras” y “rollos”, para los ganglios con relación a los tejidos de los nervios simpáticos. Los modelos fueron virtualmente idénticos a los modelos de disección modificados.
La disección dentro de cada zona fue habitualmente un bloque completo. Las figuras 7ª y 7b ilustran los límites de disección para los tumores laterales derecho e izquierdo. La arteria mesentérica inferior y el tejido del nervio alrededor de su origen son separados. Como se ha ganado mas experiencia, un mejor conocimiento del curso de las fibras simpáticas postganglionares se ha alcanzado.

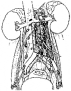
Fig. 7a Fig. 7b
La cadena simpática lumbar derecha corre posterior a la vena cava. Sus ramas postgangliónicas viajan posterior a la vena cava y usualmente son localizadas justamente hacia la cabeza de las venas lumbares. Las ramas emergen desde el costado de la vena cava y cursa anterior y caudalmente a la superficie anterior de la aorta. Las ramas postganglionares hacia el lado izquierdo, cursan anterior y caudalmente a la superficie anterior de la aorta y se une con las ramas del lado derecho. Un plexo nervioso, (hipogástrico) está localizado alrededor del origen de la arteria mesentérica inferior. Las ramas viajan sobre la bifurcación de la aorta al plexo pélvico (fig.8)
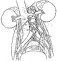
Fig. 8
La figura 9 muestra las ramas simpáticas postganglionares ddderechas derechas emergiendo por detrás de la vena cava. Por otra parte obsérvese la relación de las ramas del nervio con las venas lumbares.

Fig. 9
La figura 10 muestra las ramas simpáticas postgangliónicas izquierdas viajando por las superficies anteriores de la arteria aorta.
Fig. 10
Debido a la carencia de predecibilidad en la ubicación del envolvimiento ganglionar canceroso, en pacientes quienes habían tenido un más alto volumen de enfermedad metastásica, un modelo completo bilateral sería usado (fig.11). Las zonas derechas e izquierdas suprahiliares mostradas por la línea de áreas sombreadas son removidas en bloques con los paquetes enteroaortocavales y paraaórticos respectivamente.
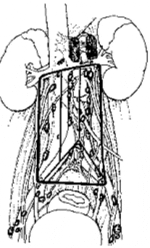
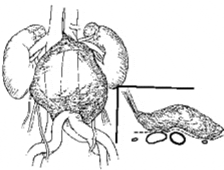
Fig. 11 Fig. 12
En aquellos pacientes quienes tenían enfermedad voluminosa, pero esta había sido confinada a una zona ganglionar en particular, a menudo será posible practicar por lo menos una limitada disección de separación de nervios para preservar la normal eyaculación. El grupo de Indiana reportó que cerca del 20% de pacientes podrían tener L.R.P. con separación del nervio y que el 76.5% reportaron preservación de la función eyaculatoria. Una inclinación quirúrgica para pacientes teniendo L.R.P. postquimioterapia para enfermedad residual voluminosa, es separar la salida de la masa a lo largo de un plano, el cual roza la superficie anterior de los grandes vasos y los uréteres para asegurar la completa disección.
La resección de la vena cava es raramente necesaria durante la L.R.P. pero debe ser considerada para alcanzar completa resección de enfermedad residual. En un estudio, el 61% de los pacientes estuvieron sin evidencia de enfermedad, dos años después de la cirugía. Unicamente el 25% experimentaron moderada o severa incapacidad a dicha resección.
Se recomienda que el cordón espermático debe ser removido en su totalidad durante la L.R.P., ya que en un 5% se encontró cáncer viable o teratoma del espécimen.
Hay un riesgo de daño vascular durante la L.R.P., especialmente después de la quimioterapia. De 400 pacientes, 30 sufrieron lesión de los grandes vasos llevando a los autores a recomendar, angiografía con resonancia magnética antes de la L.R.P., la cual puede facilitar una segura y completa resección de todos los tumores.
Todavía la resección y sustitución de la aorta pueden ser ejecutadas con seguridad después de previa quimioterapia por experimentados cirujanos. En una serie de 12 pacientes ningún injerto presentó complicaciones y no ocurrieron muertes durante el perioperatorio.
En los últimos años, algunos centros han reportado el uso de técnicas laparoscópicas para la L.R.P. Janetschek y col. reportaron una serie de 29 L.R.P. laparoscópicas en 1996 con ventajas sobre la vía abierta. No reportaron recurrencias retroperitoneales en 16 meses de seguimiento.
Gerber y Ruskstalis percibieron que la vía laparoscópica puede ser aplicada a aquellos pacientes con mínimo riesgo de metástasis, para poder reducir la necesidad de estudios de vigilancia. El estadiaje laparoscópico fue evaluado para la exacta información patológica y disminuir la morbilidad en 35 pacientes con estadio I, quienes tenían alto riesgo de tener metástasis oculta.
Ganglios positivos fueron identificados en 15 pacientes (43%) los cuales permitieron una inmediata terapia adyuvante. La conversión a L.R.P. abierta fue requerida por hemorragia en dos casos y la eyaculación fue preservada en 34. Sin embargo la L.R.P. abierta sigue siendo la terapia modelo para el C.T.
Manejo de masas post quimioterapia
Aproximadamente el 70% de pacientes con estado II c/III de la enfermedad alcanzarían una taza de curación con quimioterapia primaria (q.p) única, aproximadamente el 10% de pacientes que logran una curación total finalmente recaerán. Estos son tratados como sí ellos tuvieran una recaída después de la q.p.
Históricamente pacientes quienes solamente alcanzaron, una recaída después de la q.p. y aún tienen marcadores positivos fueron tratados con una quimioterapia de salvamento. Desafortunadamente muchos de estos pacientes tampoco consiguieron una tasa de curación y si la alcanzaron volvieron a recaer. Dos propuestas han sido hechas para esta situación: una es hacer L.R.P. posquimioterapia en pacientes seleccionados quienes tienen una enfermedad bien localizada y solamente moderada elevación de marcadores (alfa-feto-proteínas menor a 100ng/ml y gonadotrofinas beta criónicas menores a 50 ng/ml). La otra opción sería una alta dosis de quimioterapia con trasplante de médula ósea. De aquellos pacientes quienes solamente alcanzaron una recaída después de la q.p. tenían marcadores negativos y fueron sometidos a L.R.P., solamente el 10 al 12% tenían carcinoma activo en su espécimen. El resto tenían uno u otro tejido cicatrizal o teratoma en iguales proporciones. De aquellos pacientes con resecciones incompletas de su cáncer a la L.R.P.Q. la mayoría irían a transplante medular más quimioterapia.