Estructura Protéica del TNF-α
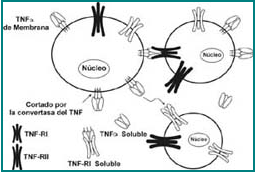
La glicoproteína TNF-a madura se encuentra expuesta en la superficie de la membrana celular, contiene 233 aa, pesa 26 kDa, es biológicamente activa y participa en la citotoxicidad e inflamación por interacción celular1-3. El TNF-a soluble corresponde a una proteína de 17 KDa, conformada por 157 aminoácidos (aa), producida a partir del TNF-α de membrana, el cual es procesado por cortes a nivel del residuo 76 por acción de la enzima convertasa del TNF-α (TACE), una metaloproteína que está también en la membrana celular (Figura 4). Estudios cristalográficos muestran que el TNF-α está conformado por tres monómeros asociados no covalentemente y cuyo extremo N-terminal se encuentra expuesto en la superficie. Esta fracción N-terminal no parece importante en la interacción con el receptor (TNFR)1-4.
Figura 4. Procesamiento y señalización intracelular del TNF-α.
El TNF-a humano es sintetizado como una proteína de 233 aminoácidos, con un peso de 26 kD, la cual está asociada a la membrana celular y presenta actividad biológica. La proteína de membrana es enzimáticamente cortada por la enzima convertasa de TNF-α (TACE), y desintegrada a una proteína soluble de 57 aminoácidos, con un peso de 17 kD, que conforma homotrímeros.
Regulación de la síntesis del TNF-α
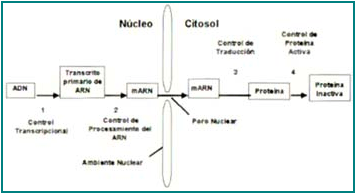
Característicamente, los genes son secuencias de ADN que de manera unidireccional son utilizados para producción de proteínas, previa trascripción en el núcleo, trasporte hacia el citoplasma y traducción a proteína en los ribosomas (Figura 5). Dentro de estos mecanismos, la regulación post-transcripcional es el mecanismo de control más importante en la síntesis de esta citoquina22.
Figura 5. Expresión y regulación génica.
El dogma central de la genética es el proceso ordenado para la expresión de los genes y la producción de proteínas, el cual va del ADN, pasando al RNA mensajero, o transcrito primario, y finalmente la traducción a proteínas.
La mayor cantidad de proteína del TNF-α es elaborada en células del sistema inmune, aunque su ARNm es expresado en otros tipos de células, como fibroblastos, astrositos, osteoblastos3, 22. La regulación trascripcional (ver glosario) del gen del TNFa no tiene un papel importante en la síntesis de la proteína; en cambio, este gen tiene un proceso de regulación denominado “represión de la traducción” que consiste en el control de la cantidad y estabilidad de ARNm antes de que éste sea convertido en proteína en los ribosomas22.
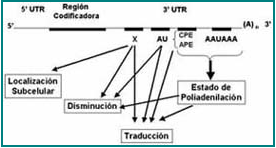
La regulación post-transcripcional es un sistema de control bastante importante en el sistema inmune y común a muchas citoquinas. Este sistema de control consta de una secuencia rica en Adenosina-Uridina (AU) y de elementos de control en la región 3′ no-traducida (3’UTR). Esta región 3’UTR es la encargada de la regulación por degradación o traducción del ARNm a nivel del citoplasma celular. La región 3’UTR está conformada por repeticiones de secuencias AUUUA, cuya función es promover la fragmentación rápida del ARNm en el citoplasma22. La rápida fragmentación del ARNm busca limitar la producción del TNF-α, para que éste se genere únicamente cuando el sistema inmune lo necesite. Este proceso se da por la detección de señales celulares en la región AURE del ARNm (Figura 6).
Figura 6. Esquema de la región 5′ y 3′, sus regiones no traducidas (UTRs) y las regiones codificadoras.
El mRNA tiene una cola de poli A [(A)n] en el extremo 3′ UTR. En el extremo 3′ UTR se muestra las secuencias que regulan la poliadenilación (CPE/APE), la localización del ARNm (X) y las regiones AURE.
En los macrófagos, luego de una señal extracelular adecuada, como el caso de la endotoxina bacteriana, el ARNm para el TNF-α puede acumularse e incrementarse hasta 100 veces y la biosíntesis hasta en 10.000 veces, gracias a la habilidad para hacer que el ARNm existente se estabilice, aumente y se traduzca a proteína22. Cuando la señal extracelular ha pasado, se reinicia la represión en la traducción conduciendo a la célula a un rápido decline en la tasa de biosíntesis de TNF-α.
Proteínas de unión al AURE (AURE-BPs) en el control post-transcripcional del TNFα
La región AURE es importante en el control de la producción de TNF-α, tanto en procesos fisiológicos como en procesos patológicos. Muchos estudios han generado líneas celulares o animales transgénicos que expresan mutaciones a nivel de esta región AURE, para observar los efectos en la biosíntesis del TNFα. Así se ha podido determinar que la síntesis del TNF-α en patologías tales como la AR es originada principalmente del macrófago22.
Las AURE-BPs son factores trans que se unen al ARNm para el control de la transducción del TNF-α. Entre estas proteínas están el Hel-N1 y el HuR23 que se comportan como estabilizadores de los transcritos que contienen AUREs. Otros AURE-BPs son el AUF1 y el tristetraprolin (TTP), proteína con dedos de zinc, encargada de desestabilizar estos transcritos y promover la degradación del ARNm para el TNF-α23. De otro lado están los TIA-1 y el TIAR, ambos homólogos estructural y funcionalmente, pertenecientes a la familia de las proteínas con motivos de reconocimiento del ARN (RRM), que están encargados de unirse a regiones ricas en uridina y se comportan como silenciadores transduccionales que regulan selectivamente la expresión del TNFa. El TIA-1 parece estar involucrado en la inhibición del ensamblaje del ARNm del TNF-α y promover su desintegración a nivel lisosomal. Tanto el TIA-1 como el TIAR pueden actuar como reguladores de la expresión de diferentes proteínas reguladoras de la liberación del ARNm-TNF-α al citoplasma23 (Tabla 2).
Tabla 2. Proteínas de unión al ARNm (AURE-BPs) y su función en la regulación postranscripcional del TNF-a
| PROTEÍNA | FUNCIÓN |
| HeL-N1 HuR AUF1 TTP TIA-1 TIAR |
Estabilizador de transcritos de ARNm que contienen regiones AURE en el TNF-α. Estabilizador de transcritos de ARNm que contienen regiones AURE en el TNF-α. Desestabilizador de transcritos de ARNm que contienen regiones AURE en el TNF-α. Desestabilizador de transcritos de ARNm que contienen regiones AURE en el TNF-α. Silenciador trancripcional y regulador selectivo de la expresión del TNF-α. Silenciador trancripcional y regulador selectivo de la expresión del TNF-α. |
Mecanismos efectores del TNF-α (Transducción)
El TNF-a es una citoquina pleiotrópica, ya que posee receptores de al menos una clase (ver más adelante) en todos los tipos de células. El efecto que puede desencadenarse por la unión ligando (TNF) receptor (TNFR) en los diferentes tipos de células ha sido ampliamente estudiado (Figura 2). Se han identificado una serie de proteínas de señal que participan en forma de cascada para enviar los mensajes del TNF-α a nivel intracelular (Transducción). Esto se logra por medio de al menos uno de los receptores pertenecientes a la familia del TNF (Tabla 1). Las proteínas que participan en esta cascada de señales no son específicas, al contrario, pueden actuar con cualquier receptor de la familia del TNF y, por intermedio de ellos, enviar sus señales. Estas proteínas pueden actuar como potenciadores de la respuesta celular al TNF mediada por receptores22, 24.
La cascada de señales puede iniciarse con la interacción de varios miembros de la familia de receptores del TNF como son el CD14, CD40,Fc o los RTNF24, junto a factores de transcripción como son el NF-kb, el API, las proteínas quinasas activadas por mitógenos (MAPK), la quinasa reguladora de señales extracelulares (ERK); la quinasa jun del extremo N-terminal (JNK) y la p38 (Figura 7)23. También participan de esta cascada proteasas y otros miembros conocidos como “proteínas de dominio mortal”24, las cuales se unen a receptores que activan la apoptosis por la vía de la familia de las caspasas. Estos dominios mortales presentan una interacción proteína-proteína, causando un efecto apoptótico indistinguible del generado por la interacción Fas-Fas ligando (FasL). Por último se han involucrado recientemente un grupo de proteínas denominadas “factores asociados al receptor TNF” (TRAFs), las cuales parecen funcionar como activadores de las proteínas quinasas24.
Figura 7. Cascada de señales para la expresión del gen TNF-α. La cascada de señales, como respuesta a un estímulo (ej. LPS, CD40, Fc, y el mismo TNF). Este estímulo, en la membrana, conlleva a la activación de las diferentes vías de las quinasas, y cada una de ellas genera un efecto específico en la inducción de la expresión del gen para el TNF-α.
Regulación de la Traducción del TNF-α
Tal como se mencionó anteriormente una gran variedad de estímulos pueden generar la síntesis del TNF-a, tales como virus, bacterias y citoquinas, entre otros, así como también el mismo TNF-α, que de manera autocrina puede comportarse como un estímulo para potencializar su producción. Estos estímulos ingresan a la célula a través de diferentes receptores que incluyen a miembros de la superfamilia del TNF y que convergen en señales intracelulares que inician la síntesis de esta citoquina. Entre ellas están la activación de factores de transcripción como el NF-kB y la vía de la proteínas quinasas activadas por mitógenos (MAP quinasas), (Figura 7). Es importante mencionar que estas vías de activación intracelular son inespecíficas y participan tanto en la transcripción del ARNm del TNF-α, como en la transducción de la misma (Ver mecanismos efectores del TNF-α).
CLIC AQUÍ Y DÉJANOS TU COMENTARIO