Bases Moleculares para el Estudio del TNFa en la Artritis Reumatoidea
Dra. Paula A. Correa
Investigadora, Unidad de Reumatología
Corporación para Investigaciones Biológicas (CIB)
Dr. Juan-Manuel Anaya
Jefe, Unidad de Reumatología, CIB
Medellín
Resumen
La artritis reumatoidea (AR), una enfermedad sistémica, se caracteriza por una inflamación crónica en la sinovial articular, asociada con degeneración del cartílago y erosión del hueso yuxta-articular. Muchas citoquinas pro-inflamatorias, entre ellas el TNFa, quemoquinas y factores de crecimiento, son expresadas en las articulaciones afectadas. Entre éstas, el TNFa juega un papel primordial en su regulación. En este artículo son revisados los mecanismos de producción del TNF-a, su control y regulación génica así como su papel patogénico en la AR.
Palabras Claves: Citoquinas, TNF, polimorfismo, microsatélites, artritis reumatoidea
Summary
Rheumatoid arthritis (RA), a systemic disease, is characterized by a chronic inflammatory reaction in the synovium of joints and is associated with degeneration of cartilage and erosion of juxta-articular bone. Many pro-inflammatory cytokines including TNFa, chemokines, and growth factors are expressed in diseased joints. Among all, TNFa plays a central role in regulating these molecules. Herein, TNFa physiology including regulatory mechanisms of production and genetic control as well as its pathogenic role in RA are reviewed.
Key words: cytokines, TNF, polymorphism, microsatellites, rheumatoid arthritis.
Introducción
El factor de necrosis tumoral (TNF), es una citoquina proinflamatoria, descubierta inicialmente en el suero de ratones luego de la infección con endotoxinas bacterianas. Más tarde esta misma citoquina fue encontrada igualmente en ratas, conejos y en el hombre1. Posteriormente se identificaron dos formas moleculares denominadas TNF-α o Caquexina y el TNF-b o Linfotoxina1-2. El TNF pertenece a la superfamilia de mediadores que llevan su nombre y a la cual pertenecen al menos 15 citoquinas (Tabla 1). Entre las similitudes que comparten los miembros de esta superfamilia están el ser proteínas monotriméricas (excepto la Linfotoxina), estar principalmente expresadas en la membrana celular y participar en la regulación de la proliferación celular y la apoptosis; aunque varios miembros, como el TNF-a, tienen una importante actividad proinflamatoria3. En esta revisión nos ocuparemos del TNF-α, citoquina secretada principalmente por células del sistema inmune, como los monocitos, macrófagos, neutrófilos, células NK y linfocitos T CD4+. Otras células pueden producirlo como respuesta a un estímulo, tales como astrocitos, microglías, miocitos y fibroblastos1-2.
Tabla 1. Miembros de la superfamilia del TNF y sus receptores
| Ligandos de la superfamila TNF Factor de necrosis tumoral alfa Factor de necrosis tumoral beta (Linfotoxina)Fas Ligando (FasL), Ligando APO 1 Ligando de CD30 Ligando de CD40 Ligando de CD27 Ligando de OX40 Ligando inductor de apoptosis relacionado al TNF (TRAIL)Citoquinas de activación inducida por la relación con el TNF (trance), Ligando osteoprotector (OPGL), Ligando RANK (RANKL) Ligando A inductor de la proliferación (APRIL) LIGHTWEAK inductor de apoptosis y moléculas similares a TNF Ligando 1 expresado en leucocitos y relacionado con el TNF y ApoL (TALL-1) Homólogos de TNF que activan apoptosis, NF-kB y La quinasa jun (THANK) |
Receptores de la superfamilia TNF TNF-RI (p55, p60), TNF-RII (p75, p80) TNF-RI (p55, p60), TNF-RII (p75, p80) Linfotoxina bR. Fas, CD95, Apo1 CD30 CD40 CD27 OX40 TRAIL-RI, Apo 2, TRID, TRAIL-R3, TRAIL-R4, TRUNDD, KILLER, TRICK-2OPG, RANKDesconocido Linfotoxina-bR., Mediador de entrada del herpes virus (HVEM), CD27TRAMP, Apo3DesconocidoDesconocido |
El TNF-α tiene una potente actividad citotóxica, capaz de asesinar células tumorales y de actuar como un mediador letal en la respuesta inmune aguda o crónica de enfermedades inflamatorias e infecciosas. Las principales actividades biológicas del TNF-α han podido ser reproducidas utilizando la proteína purificada o recombinante3:
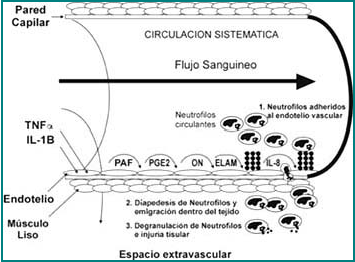
· Producir necrosis hemorrágica de tumores, en injuria tisular y shock, gracias a sus propiedades proinflamatorias sobre el endotelio vascular (Figura 1).
· Inducir apoptosis en algunos tumores y líneas celulares transformadas.
· Producir caquexia, al estimular la lipólisis, inhibir la actividad de la lipoproteína lipasa en los adipositos y estimular la lipogénesis hepática.
Figura 1. El TNF-a y la IL-1b activa el endotelio vascular en inflamaciones sistémicas.
El TNF-a y la IL-1b en la circulación sistémica, actúan sinérgicamente para estimular la producción de factor activador de plaquetas (PAF), prostaglandina E2 (PGE2) y óxido nítrico (ON) en el endotelio, cada uno de estos factores lleva a la vasodilatación y la disminución del flujo sanguíneo.
El TNF-α y la IL-1b también incrementan la capilaridad de proteínas y el fluido dentro del espacio extravascular. Las moléculas de adhesión de los leucocitos al endotelio (ELAM) son estimuladas por el TNF-a y la IL-1b ; facilitan la adherencia de leucocitos sanguíneos [polimorfonucleares neutrófilos (PMN)] a la superficie endotelial. La IL-8 también es estimulada por el TNF-α y la IL-1; activa las células endoteliales y contribuye en la migración (diape-desis) de PMN al espacio extravascular, donde éstos liberan sus gránulos y producen enzimas responsables de la injuria tisular.
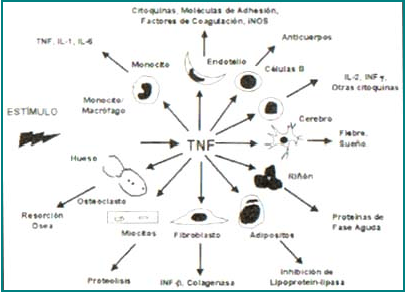
La síntesis del TNF-α puede ser inducida por virus, parásitos, bacterias, células tumorales, isquemia, trauma e irradiación, así como por citoquinas tales como el interferón-gamma (IFN-g), la interleuquina (IL)-1, IL-2, IL-12, el factor estimulante de colonias de granulocitos-macrófagos (GM-CSF), el factor activador de plaquetas (PAF) y el mismo TNF-α,1, 3. El efecto pleitrópico del TNF-α tiene como resultado la síntesis de citoquinas [IL-1, IL-2, IL-4, IL-6, IL-10, IL-12, IL-18, IFN-g, factor de crecimiento y trasformación-beta (TGF-b)], PAF, leucotrienos, proteínas de fase aguda y hormonas (cortisol, epinefrina, glucagón, insulina, norepinefrina)1-3 (Figura 2). Muchos de los mediadores inducidos por el TNF-α actúan a su vez como inhibidores de su expresión, tales como la IL-6, IL-10, la prostaglandina E2 y el cortisol1-3.
Figura 2. Principales efectos biológicos del TNFα
Las características moleculares del TNF-a han generado un interés particular en el desarrollo de nuevos medicamentos que están siendo empleados en el tratamiento de enfermedades autoinmunes (AR, LES, SS) e infecciosas (Malaria, Tuberculosis).
En este artículo serán resumidos los mecanismos de producción del TNF-a, su control y regulación génica así como su papel patogénico en la AR. Un glosario, al final del texto, permitirá una mejor comprensión del mismo.
Características génicas del TNF-α
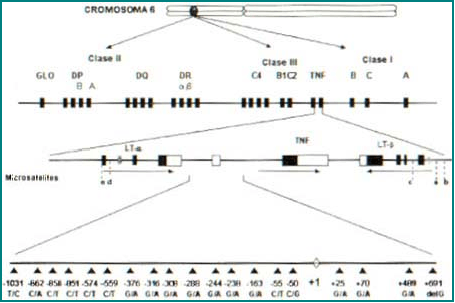
El locus para el TNF se encuentra ubicado en el brazo corto del cromosoma 6 en 6p21.3, dentro de la región del complejo mayor de histocompatibilidad (CMH) clase III, entre los genes HLA-B y el del factor C del Complemento1. El locus para el TNF está conformado por un grupo de genes denominados linfotoxina (LT-b) y los genes TNF1-2, 4. El gen TNFα tiene un tamaño de 3.6 Kb y está conformado por cuatro exones; el primero se encarga de codificar una proteína precursora de 233 aminoácidos, mientras que los tres restantes codifican para cada uno de los monómeros que conforman la proteína activa. Además este gen posee tres intrones cuya función es desconocida2. El gen que codifica para el TNF b está ubicado a 1.2 Kb del TNFa, ambos genes son regulados de forma independiente1 (Figura 3).
Figura 3. Conformación génica del TNF-a.
El gen del TNF es representado en la parte superior, en el brazo corto del cromosoma 6, en la posición 6p21.3, haciendo parte del complejo mayor de histompatibilidad clase III. En esta región se encuentran genes que codifican para las moléculas TNF-α y TNF-b, además están los genes para la linfotoxina. Cada uno de estos genes es codificado en la dirección que indican las flechas y son regulados de forma independiente. Además, se indica la ubicación de las regiones polimórficas, hasta ahora identificadas para el gen TNF, las cuales comprenden 5 microsatélites (denominados con las letras a, b, c, d, e) y 19 mutaciones puntuales (SNP). Estas SNP están representadas con un cambio, o deleción, de sus respectivas bases en la parte inferior de la figura. En la +691 el polimorfismo está dado por una deleción de G.
Polimorfismo del TNF-a. El gen del TNF-α es altamente polimórfico. Este polimorfismo se encuentra en los microsatélites (STPRs), en los fragmentos de restricción (RFLPs) y en nucléotidos simples (SNPs)5. Se han identificado 5 microsátelites denominados TNF a, b, c, d, e6-9, cada uno de los cuales presenta diferentes variables así, TNFα AC/GT, que origina 13 alelos diferentes, TNFb TC/GA con 7 alelos, TNFc TC/GA con 2 alelos diferentes, el TNFd TC/GA con dos alelos diferentes y el TNFe TC/GA con 4 alelos, y cuyas ubicaciones son señaladas en la figura 310.
Se han registrado 19 SNPs dentro del gen del TNF, ubicados tanto en regiones promotoras como en sitios de trascripción y regiones no trascritas (UTR). Entre los SNPs hay uno ubicado en el primer intrón, en la posición +489 con dos alelos dados por las bases G®A11-12. Otro sitio importante es la posición +70 en el extremo 5′ de la región no codificadora13 donde se pueden dar sustituciones entre la G y la A. Recientemente se han identificado dos sitios igualmente polimórficos correspondientes a +2513 y +6916,14, donde se presentan variaciones alélicas por el cambio de G®A para el primero, y una deleción de G en el segundo10. En cuanto a las mutaciones en la región reguladora, la más importantes corresponde al cambio de G®A en el sitio _308 del promotor, lo que genera dos alelos conocidos como TNF1 (G) y TNF2 (A)13, 15-16. También se encuentra la posición _238 en la cual se presenta el mismo cambio de bases (G®A)15, 17. Junto a estos polimorfismos se encuentran otros en las regiones _1031,-862(*-863), -856 (*-857), -851 donde se da el polimorfismo C®T, -559 C®T, -574, -376 G®A, -288 G®A, -244 G®A, -238 G®A, -163 G®A, -55 C®T, -50 C®G (Figura 3). El interés que tiene determinar el polimorfismo del TNFa radica en la influencia que éste tiene sobre los niveles de expresión de la citoquina11, 14, 18-21.
CLIC AQUÍ Y DÉJANOS TU COMENTARIO