Efector de la Glucosamina
Dr. Rito Alfonso López Uribe*,
Dr. Raúl Fernando Gamarra A.**,
Dra. María Consuelo París De Rugeles***
* Ortopedista y Traumatólogo, Pontificia Universidad
Javeriana.Ortopedista y Traumatólogo Hospital
Regional San Juan de Dios del Socorro y San Gil-Santander.
** Médico General Escuela de Medicina Juan N. Corpas.
*** Jefe del Departamento de Morfología Pontificia
Universidad Javeriana y Servicio de Patología Hospital Simón Bolívar.
Introducción
El cartílago hialino pese a ser un tejido metabólicamente activo posee una limitada capacidad de reparación, eventualmente lesiones traumáticas y osteoartríticas degenerativas causan severa y progresiva inestabilidad de las articulaciones, culminando en la degradación del cartílago y destrucción de la superficie articular; en estos casos se requiere de un remplazo total o parcial de la articulación para eliminar el dolor y restaurar la movilidad2, 3, 4, 5, 6, 7, 8.
Las nuevas investigaciones acerca del cartílago articular buscan entender la biología, composición, metabolismo, organización ultraestructural y molecular, propiedades biomecánicas con la esperanza de desarrollar un procedimiento de reparación biológico, como una alternativa a las artroplastias en el tratamiento de las enfermedades degenerativas de las articulaciones.
La meta es lograr hallar un sustituto biológico viable y con las propiedades bioquímicas y biomecánicas del cartílago articular normal24, 25, 29, 30, 38, 40, 41. El cartílago articular al no tener una capacidad de curación adecuada, generalmente y en las mejores condiciones lo hace con fibrocartílago, sin embargo, algunos estudios experimentales han demostrado regeneración del cartílago hialino12, 14, 15, 16, 18, 19, 20, 22, 24.
En 1851 Redfern realizó el primer estudio de cicatrización de cartílago en caninos hallando curación con tejido conectivo, Fisher en 1922 encontró cierta proliferación de fibrocartílago en la periferia de las lesiones, Bucher y Meachin en 1955 propusieron abrasión del hueso subcondral, con el objeto de exponer células mesenquimales que facilitaran la curación del cartílago.
En 1965 Mankin y Boyle encontraron como la síntesis de proteínas y glucosaminoglicanos aumentaba al lesionarse el cartílago; en 1972 Salter reporta las ventajas para la cicatrización del cartílago articular, dadas por la movilidad pasiva continua máxime si se practicaba además abrasión del hueso subcondral29, 30, 32.
También se ha promulgado el uso de la proteína morfogénica ósea, matriz ósea decalcificada e injertos de periostio para la curación de lesiones del cartílago11, 25, 27, 28, 29, 30, 33, 34, 35, 36, 37; otro autor, Kato apreció efectos mitóticos del Vanadate en el cartílago17.
Los monosacáridos que constituyen los glucosaminoglicanos se derivan de la glucosa pero su síntesis puede provenir de la glucosamina; autores como Drovanti, Dambrosio, Hans, Muller han utilizado la glucosamina para promover cicatrización cartilaginosa y afirman tener buenos resultados clínicos al respecto en cuanto a dolor, edema, movilidad articular.
Más aún, en biopsias efectuadas transartroscópicas han documentado regeneración de cartílago en este grupo de pacientes1, 10, 13, 17, 19, 21, 23, 26, 31, 34, 39, sin embargo, corresponde a un fibrocartílago el cual no posee las mismas propiedades bioquímicas que el cartílago normal pues no sintetiza proteoglicanos, colágeno o matriz, tampoco posee iguales propiedades biomecánicas puesto que no tolera cargas como el cartílago normal38, 40, 41.
Los reportes revisados de la literatura, por sus vacíos en ciertas áreas del conocimiento de este tema y los criterios controvertidos, motivaron a los autores del presente trabajo a diseñar un estudio experimental, que evaluara la acción de la glucosamina en la cicatrización del cartílago hialino.
Material y Métodos
El estudio se efectuó con 20 conejos machos de la raza Nueva Zelanda con un peso promedio de 3.000 gramos cada uno. Los conejos se dividieron en dos grupos, 10 a los cuales se les aplicó glucosamina y 10 a los cuales no se les aplicó ningún fármaco.
Metodología
Criterios de inclusión
1. Peso aproximado de 30000 gramos.
2. Edad-madurez esquelética.
3. Raza Nueva Zelanda.
4. Sexo masculino.
5. Técnica anestésica, quirúrgica, histopatológica estándar o unificada.
Criterios de exclusión
1. Infección clínica en el posoperatorio.
2. Muerte del conejo.
3. Patología intraarticular previa, traumática o degenerativa.
Variables
Variables dependientes: Es la capacidad de cicatrización o reparación del cartílago articular.
Variables independientes: Sulfato de glucosamina a dosis de 1 cc (40 mg) cada semana por 5 dosis.
Variables control
1. Raza.
2. Peso.
3. Edad.
4. Técnica anestésica, quirúrgica, histopatológica, etc.
Técnica anestésica
En los miembros de la población a estudio se utilizó la siguiente técnica anestésica:
| Maleato de acepromazina Ketamina |
2 mg por kg. |
Los dos fármacos se aplicaron en mezcla y por vía IM, en caso de requerir refuerzos se utilizó la misma dosis inicial .
Técnica quirúrgica
En los conejos se eligió la articulación de la rodilla, con base en estudios previos que han demostrado amplia similitud con la especie humana, y por ser excelente modelo de experimentación.
El procedimiento se realizó en el Hospital San Juan de Dios del Socorro-Santander, con las técnicas de asepsia convencionales; no se rasuró la pierna del conejo, se lavó exhaustivamente con solución de isodine y se vistió el animal con campos estériles. Se realizó profilaxis con cefalotina a dosis de 100 mg por kg en dos dosis, una hora antes y dos horas después de cirugía.
La incisión se realizó parapatelar interna en la rodilla izquierda del conejo, comprometiendo tejidos blandos hasta llegar al retináculo, el cual se incidió exponiendo el cóndilo externo sobre el cual se creó un defecto en la zona de apoyo con broca de 2.0 mm. Figura 1. Una vez creado el defecto en el cartílago, se lavó la articulación y se cerró por planos con vicryl 3-0.
Los conejos se agruparon en forma aleatoria, randomizados, así:
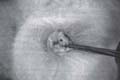
Fig 1. Se aprecia el defecto
creado en el cóndilo femoral por
una broca de 2.0 mm.
Los conejos permanecieron enjaulados con todos los cuidados necesarios, se les administró acetaminofén 5 cc en cada 50 cc de agua por los dos primeros días, es importante aclarar que el conejo no consumía más de 50 cc de agua por día.
Como complicación dos conejos murieron por efecto de la anestesia, los cuales fueron remplazados de inmediato para completar el tamaño de la muestra; ningún conejo se infectó o presentó alguna otra patología.
No se inmovilizó su extremidad operada, se les aplicó 1 cc de glucosamina (40 mg) semanal por 5 dosis y al completar 12 semanas posoperatorias, se sacrificaron y se procedió a la evaluación del estudio por dos métodos, macroscópico y microscópico o histológico:
|
CON GLUCOSAMINA |
SIN GLUCOSAMINA |
|
1 |
3 |
Análisis macroscópico
Se tomaron todas las piezas macroscópicas con el objeto de evaluar si el defecto había cicatrizado o no, para ello se analizaron dos parámetros:
| Cicatrización: | Llenado completo del defecto |
| No cicatrización: | Llenado parcial del defecto. No llenado del defecto |
Luego se calculó en porcentaje el número de casos que cicatrizaron con respecto al número de casos totales (x/10), definiéndose así cual de los dos grupos presentó mayor porcentaje de cicatrización.
CON GLUCOSAMINA ——————————-SIN GLUCOSAMINA
X/10 ————————————————–.X/10
Se buscó asociación estadística agrupando los resultados en tablas de 2×2 o tablas de contingencia, para determinar en cada subgrupo si existió cicatrización o no.
|
CON |
SIN |
||
| CICATRIZACIÓN NO CICATRIZACIÓN |
A |
B |
A B |
Análisis microscópico
Las muestras de cartílago articular obtenidas de cada grupo se fijaron en formol neutro al 10% durante tres días, luego se procedió a decalcificar el hueso dejándolo una semana en ácido nítrico y ácido glacial acético para su inclusión en parafina y realizar los cortes, posteriormente se colorearon los cortes con hematoxilina y eosina. La evidencia
histológica de la cicatrización del defecto se evaluó también a la décimo segunda semana, tomando los siguientes parámetros:
| Cicatrización: | Presencia de fibrocartílago maduro. |
| Presencia de cartílago hialino. | |
| No cicatrización: | Presencia de tejido de granulación inmaduro. Presencia de cualquier otro tejido |
En forma similar al análisis de las piezas macroscópicas, se calculó el número de casos que cicatrizaron respecto al número de casos totales, se incorporaron los resultados en tablas de 2×2 o de contingencia.
