Fundamentos y recomendaciones técnicas para su potencial aplicación en el ámbito asistencial
Introducción
En los últimos años se ha dado énfasis a la evaluación funcional de los músculos respiratorios en humanos justificado por motivos clínicos e investigativos. El presente artículo busca difundir y resaltar la relevancia clínica de evaluar la función muscular respiratoria en el ámbito de la especialidad médica neumológica.
De esta forma, se incluyen una serie de fundamentos técnicos y recomendaciones prácticas sobre la metodología de evaluación funcional (fuerza y resistencia) in-vivo y no-invasiva de los músculos respiratorios en seres humanos.
El resumen de estos conceptos ha estado basado en la experiencia de alrededor de una década en este tipo de evaluaciones funcionales e incluye las bases fisiológicas y fisiopatológicas de los cambios en la función de estos músculos en pacientes con enfermedades respiratorias.
Los autores consideran viable la aplicación de estas técnicas tanto en la evaluación clínica de pacientes seleccionados como en el baremo de criterios para la asignación de estrategias específicas de intervención (p.ej., entrenamiento inspiratorio, entrenamiento espiratorio, tratamiento anabolizante, intervención nutricional, etc).
Asignación de esquemas de entrenamiento muscular
En este sentido, una de las propuestas actuales es la asignación de los esquemas de entrenamiento muscular y fisioterapia de una forma individualizada, de acuerdo a los resultados de las pruebas de función muscular respiratoria.
Específicamente, se ha sugerido hacer entrenamiento de fuerza (cargas elevadas, corta duración) o de resistencia (cargas moderadas, períodos prolongados) en aquellos pacientes que tengan deteriorada una u otra característica.
De esta forma la asignación de los esquemas de entrenamiento podrán ser personalizados de una forma más racional, optimizando los recursos, e incidiendo de una forma específica sobre las prioridades que denota la disfunción muscular de cada paciente.
La eventual realización de estudios epidemiológicos multicéntricos permiten evaluar el valor predictivo de la función muscular respiratoria respecto al deterioro funcional global, calidad de vida e inclusive mortalidad de pacientes con enfermedades respiratorias crónicas. (Lea también: Evaluación pre-operatoria para cirugía de tórax)
Autores
Alba Ramírez-Sarmiento 1, MD., Margarita Barrero 2,3, MD., Mauricio Orozco-Levi1, 4 MD.
1. Grup de Recerca de Pneumologia, Institut Municipal d’Investigació Mèdica (I.M.I.M), Barcelona. Facultad de Ciencias de la Salut i de La Vida. CEXS-Universitat Pompeu Fabra. Barcelona. ESPAÑA.
2. Unidad de Investigación Básica y Clínica, Fundación Neumológica Colombiana. Santa Fe de Bogotá. COLOMBIA.
3. M. Barrero (Fisioterapeuta) fue fellow visitante en el Grup de Recerca de Pneumologia, IMIM (Barcelona, ESPAÑA), subvencionada por la Beca de Formación Continuada FNC-2001.
4. Servei de Pneumologia del Hospital Universitari del Mar. Barcelona, ESPAÑA.
Efectos secundarios de la evaluación funcional de los músculos respiratorios
La evaluación funcional de los músculos respiratorios se fundamenta en la realización de un ejercicio específico (inspiratorio o espiratorio) por parte del paciente bajo unas condiciones experimentales rigurosas.
El fundamento es similar a lo aplicado en pruebas de esfuerzo general, por cuanto se somete al grupo muscular evaluado a una situación controlada de sobrecarga. Antes de entrar en materia hemos considerado importante resaltar la relación que tiene la evaluación funcional de los músculos respiratorios con la aparición eventual de efectos secundarios sobre los músculos evaluados.
Estos efectos pueden ser agrupados en dos conceptos principales:
Evaluaciones de fuerza y resistencia
En primer lugar, las evaluaciones de fuerza y resistencia de los músculos respiratorios pueden precipitar daño de los músculos respiratorios. Existe la evidencia reciente que el ejercicio respiratorio específico es capaz de inducir daño celular a nivel de las fibras musculares del diafragma y demás músculos respiratorios, como lo hemos demostrado en una investigación reciente1.
Estas alteraciones estructurales ocurren tanto a nivel de la membrana celular (sarcolema), como a nivel de la unidad funcional (miofilamentos de las sarcómeras) y los organelos encargados de la producción de energía (mitocondrias).
Este daño puede acompañarse de necrosis celular e inflamación, como se ha demostrado en modelos animales. Clínicamente estos defectos tras el ejercicio se manifiestan como disminuciones significativas de la fuerza y la resistencia del músculo evaluado y eventualmente pueden precipitar falla ventilatoria en pacientes susceptibles1.
Sobrecarga de los músculos respiratorios
En segundo lugar, la sobrecarga de los músculos respiratorios es capaz de precipitar fenómenos de remodelamiento estructural (condicionamiento). Recientemente, los trabajos de Ramírez-Sarmiento y cols. han demostrado, en un grupo de pacientes seleccionados, que los músculos inspiratorios y espiratorios tienen la capacidad de remodelarse ante los períodos de sobrecarga2 ,3.
Específicamente, hemos demostrado cambios estructurales tanto en los músculos intercostales externos (tras esquemas de entrenamiento inspiratorio) como en el músculo oblicuo externo (tras esquemas de entrenamiento espiratorio).
Estos cambios han sido de índole adaptativa y representados estructuralmente como incrementos del tamaño de las fibras, incremento de la densidad capilar, cambios a nivel de la maquinaria energética (incremento de la capacidad aeróbica del músculo) y cambios a nivel molecular (isoformas de cadenas pesadas de miosina, depósitos de aminoácidos, etc). Clínicamente, estos cambios celulares se han relacionado con incrementos significativos de la fuerza y resistencia de los músculos entrenados.
Teniendo en cuenta lo anterior, el lector podría considerar contradictorias las evidencias de que el ejercicio específico puede precipitar daño o adaptación de los músculos respiratorios.
Sin embargo, las evidencias obtenidas a partir de modelos animales sugieren que el efecto de entrenamiento muscular (mejoría en la fuerza y resistencia) es el resultado de fenómenos repetidos de daño que se siguen de eventos de remodelación molecular y subcelular.
En la actualidad estamos desarrrollando un estudio multicéntrico para definir con precisión las formas de optimizar los esquemas de entrenamiento de los músculos respiratorios para obtener el máximo beneficio clínico en los pacientes.
Es por lo anterior que sugerimos que la evaluación funcional respiratoria en términos de tolerancia ante cargas experimentales externas debe ser restringida a un entorno de manejo clínico especializado y con experiencia en este campo.
Los músculos esqueléticos de pacientes con enfermedades respiratorias: ¿qué importancia tienen?
La mayor parte del conocimiento que se tiene en la actualidad de las relaciones entre la presencia de enfermedades respiratorias y alteraciones funcionales de los músculos esqueléticos se ha derivado del estudio de pacientes con enfermedad pulmonar obstructiva crónica (EPOC).
En gran medida este abordaje está justificado por la alta prevalencia de la enfermedad, su historia natural (años de evolución) y el impacto que tiene tanto a nivel individual como los elevados costos que implica para el sistema sociosanitario4.
Disfunción de los músculos en EPOC
Los pacientes con EPOC presentan diversos grados de limitación ante el esfuerzo físico general o específico (p.ej., músculos respiratorios). Sin embargo, este deterioro funcional correlaciona débilmente con las variables de función pulmonar convencional, por lo cual se ha deducido que existen otros factores limitantes del esfuerzo físico, y entre ellos, los músculos esqueléticos y respiratorios.
La disfunción de los músculos esqueléticos en la EPOC tiene importancia clínica por su asociación con características individuales de los pacientes (p.ej., grado de disnea), e importancia social por su asociación con la demanda de servicios de atención en salud y mortalidad de estos pacientes.
La mayoría de los estudios previos respecto a la estructura de los músculos esqueléticos en pacientes respiratorios se realizaron sobre músculos de las piernas (vasto lateralis). De forma consistente los músculos cuádriceps de pacientes con EPOC muestran una menor masa muscular5 , un menor número de capilares, menor concentración de mioglobina y un contenido mitocondrial normal o bajo6.
Además, las fibras tanto tipo I como tipo II disminuyen su tamaño (fenómeno conocido como atrofia)7 , cambian su frecuencia relativa (disminuye el porcentaje de fibras tipo I e incremento en las isoformas de miosina tipo IIb).8
Este mismo patrón se ha encontrado en el músculo bíceps de estos pacientes en relación directa con la pérdida de peso y el grado de obstrucción al flujo aéreo9 . La traducción funcional de estos cambios es una menor fuerza y un metabolismo anaeróbico precoz durante el ejercicio (menor resistencia)10 ,11
Atrofia por desuso o esteroides
Lo anterior ha justificado que algunos autores generalizaran equívocamente a los demás músculos (respiratorios o no) el concepto de atrofia por desuso o esteroides. Se creyó que lo observado en los músculos de las piernas debería estar reflejando lo que sucede en otros músculos del tronco o extremidades superiores de los pacientes con EPOC.
Así por ejemplo, otros músculos como el deltoides (hombro) o el tibial anterior (pierna) muestran cambios diferentes (preservan las enzimas y el tamaño de sus fibras) a los que se observan en los cuádriceps.6
Especialmente en la última década, se ha incrementado de forma muy significativa el interés por estudiar las causas y posibles métodos de intervención sobre la disfunción muscular en pacientes con EPOC.
Recientemente, nuestro grupo y otros autores han podido demostrar que:
1) los músculos esqueléticos (como sistema) disfuncionan en los pacientes con EPOC;
2) que el grado de deterioro funcional no es homogéneo para todos los grupos musculares;
3) que el grado de alteración puede ser diferente cuando se comparan pacientes entre sí;
4) que existen cambios estructurales de índole “degenerativa” (p.ej., atrofia, decondicionamiento) pero, interesantemente,
5) coexisten cambios adaptativos (hipertrofia e incremento de mitocondrias en algunos músculos) y que
6) los músculos preservan capacidad para responder ante el entrenamiento.
A continuación se reseñan brevemente los principales conceptos derivados de los estudios estructurales de los músculos respiratorios.
Eventos moleculares de la contracción de los músculos respiratorios
Los músculos respiratorios corresponden embriológica, funcional y estructuralmente a músculos esqueléticos estriados12 . La estructura de estos músculos está especializada para realizar una tensión (contracción muscular) al contener complejos moleculares capaces de cambiar tanto su conformación como la fuerza de unión de forma reversible (“moléculas contráctiles”).
El conjunto de fascículos que constituyen un músculo está envuelto por una fascia de tejido conectivo denominada epimisio. Cada uno de esos fascículos está formado por cientos de fibras musculares agrupadas por el perimisio.
Cada fibra corresponde a una célula muscular que característicamente es multinucleada cuya membrana celular se denomina sarcolema13. Las fibras musculares son las unidades funcionales básicas del músculo.
Cada fibra muscular la conforman, entre otros, cientos de miofibrillas embebidas en una matriz de soporte (sarcoplasma). En el sarcoplasma se encuentran diversas moléculas iónicas (sodio, potasio, calcio, magnesio, fosfatos), los diversos organelos subcelulares (mitocondrias, lisosomas, etc), y un sistema especializado de membranas que conforman una red de túbulos llamada retículo sarcoplásmico.
Esta red se organiza en un sistema de túbulos longitudinales cuyos extremos se rematan por unas estructuras vesiculares denominadas cisternas terminales, las cuales almacenan altas concentraciones de calcio necesarias para la contracción muscular13.
Para que la despolarización de la membrana sea casi simultánea (no solo en toda la extensión sino también en el grosor de la célula) existen unas comunicaciones por membrana celular con disposición tubular transversa, el sistema de túbulos T.
Tríada
El punto de contacto del retículo sarcoplásmico con el túbulo T se conoce con el nombre de tríada y es el responsable de la propagación de la despolarización de la membrana hacia el interior de la fibra y la liberación del calcio13.
La generación de tensión (contracción) muscular es un evento molecular complejo y reversible regulado por múltiples factores, tanto intra- como extra-celulares. Esta característica contráctil esta dada por la existencia de las llamadas “moléculas contráctiles” y sus complejos relacionados.
De hecho, cada fibra muscular está consituída por miles de miofibrillas que contienen los miofilamentos de miosina y actina. La proporción entre estos miofilamentos aparenta ser constante (1500 filamentos de miosina por 3000 filamentos de actina)13 y su organización es geométrica, una al lado de la otra, en sentido longitudinal constituyendo la unidad funcional del músculo: la sarcómera.
Las sarcómeras se unen en serie mediante los extremos de los filamentos de actina, lo cual constituye los discos o bandas Z.
Los miofilamentos de miosina están formados por cadenas de polipéptidos (dos cadenas pesadas y cuatro livianas). Los miofilamentos de actina están íntimamente organizados con las moléculas de tropomiosina y troponina.
La actina se organiza conformacionalmente en forma de hélice sobre su eje longitudinal, similar a las moléculas de miosina, y sobre ella se enrollan las moléculas de tropomiosina. Por su parte, la troponina cuenta con tres subunidades (I, T, y C) y constituye el cuarto complejo molecular participante en la contracción y relajación musculares13.
Contracción muscular
La contracción muscular se inicia siempre a partir de un potencial de acción que se transmite por los nervios hasta la unión neuromuscular. En este punto se libera la acetilcolina que activa los canales iónicos de la membrana muscular para el paso de sodio, potasio y calcio que intervienen en el evento. Esto ocasiona un cambio en el potencial de la membrana que se propaga a toda la fibra y el sistema tubular T.
Este al encontrarse en contacto con las cisternas terminales hace que se libere el calcio almacenado que se unirá con las moléculas de troponina C. Este complejo es capaz de desplazar a la tropomiosina con lo cual los canales de actina se descubren y se unen a las cabezas de los filamentos de miosina.
Esta unión induce un cambio conformacional en la miosina que cambia el ángulo entre su cabeza y eje (movimiento de bisagra) produciendo así una tensión longitudinal sobre los miofilamentos conocida como contracción o tensión musculares. La relajación implica los eventos en forma inversa.
Etapas de consumo de la contracción muscular
La contracción muscular, en todas sus formas, consume energía. Esta energía se obtiene a partir del ATP que se consume en las diferentes etapas de:
1) bombeo de iones a través del sarcolema (potencial de acción);
2) cambios conformacionales de la miosina;
3) liberación y recuperación del calcio por el retículo sarcoplásmico;
4) unión del complejo troponina-tropomiosina;
5) desplazamiento de los filamentos (contracción propiamente dicha);
6) separación de las cabezas de miosina (relajación)13.
Por esta razón, la reserva de ATP a nivel de la fibra muscular es apenas suficiente para mantener la contracción durante unos pocos segundos y se hace necesario acudir a las reservas energéticas con el fin de producir nuevas moléculas de ATP. Estas reservas corresponden a las fuentes de fosfocreatina, glucógeno y el metabolismo oxidativo que finalmente es el más efectivo aportando el 95% de la energía total utilizada.
Todos los músculos esqueléticos, entre los cuales se cuentan los respiratorios, están conformados por tres tipos de fibras musculares: Tipo I, IIa y IIb. Las fibras tipo I se caracterizan por tener gran capacidad para el metabolismo aeróbico, alta densidad capilar y mitocondrial, y tener tolerancia a contracciones repetidas durante períodos prolongados de tiempo.
Es por lo anterior que se les define como “resistentes a la fatiga”. Las fibras tipo IIa presentan metabolismo aeróbico más rápido. Tienen menor densidad capilar y mitocondrial pero son igualmente resistentes a la fatiga. Las tipo IIb son fibras de glicólisis rápida, con fatigabilidad rápida, pero capaces de generar alta tensión.
El mayor o menor predominio de determinado grupo de fibras en un músculo puede ser modificado (plasticidad molecular). Este cambio depende, básicamente, del tipo de trabajo al que sea sometido (condicionamiento modulado).
Estructura de los músculos respiratorios en individuos sanos
El estudio de la estructura de los músculos respiratorios es difícil de realizar en individuos sanos, y la información disponible se basa en dos modelos de toma de muestras musculares. El primero, discutible desde el punto de vista metodológico, a partir de muestras musculares procedentes de modelos necrópsicos.
El segundo, a partir de pacientes portadores de neoplasia pulmonar de pequeño tamaño pero en ausencia de enfermedad respiratorias asociadas, o aquellos pacientes llevados a laparotomía o laparoscopia por patología no-neoplásica (p.ej., colecistectomía por litiasis).
Nuestro grupo está desarrollando actualmente un estudio multicéntrico para definir las características estructurales de los músculos inspiratorios (intercostales) y espiratorios (oblicuo externo) en individuos sanos voluntarios.
Diafragma
El diafragma es el principal músculo respiratorio y representa el plano de separación de la caja torácica y el abdomen.
Es un músculo estriado cuyas fibras se orientan de forma radial desde su zona central tendinosa a las estructuras óseas de la periferia y que al ser comparado con músculos periféricos muestra una mayor tolerancia a la fatiga, mayor flujo sanguíneo, mayor densidad capilar y mayor capacidad oxidativa14.
Su contracción produce un descenso de su cúpula lo cual lleva a un aumento de los diámetros anteroposterior y transverso de la caja torácia. El diafragma de un adulto sano tiene un 80% de fibras resistentes a la fatiga (55% de tipo I, 25% de tipo IIa) comparado con el 40% de un músculo periférico15 . Esto capacita al músculo para realizar trabajos de baja intensidad pero de larga duración.
Músculos intercostales externos
Los músculos intercostales externos son músculos delgados que se encuentran situados en el plano más superficial de los espacios intercostales. Sus fibras están orientadas de forma oblicua hacia la línea media anterior.
Su acción inspiratoria se fundamenta en la capacidad de traccionar la costilla inmediatamente inferior en sentido caudo-cefálico y aumentar así el diámetro del tórax. Al igual que el diafragma presenta un predominio de fibras tipo I (60%).
Del 40% de fibras tipo II un 25% corresponde a las de tipo IIb. En cuanto a la histomorfometría básica de los intercostales internos se observa que un 40% de las fibras son de tipo I y un 60% del tipo II (un 35% IIb y un 25%IIa).
Músculos intercostales para-esternales
Los músculos intercostales para-esternales corresponden a la porción condro-esternal bilateral de los músculos intercostales internos. Su activa participación durante la fase inspiratoria ha sido comprobada electromiográficamente.
Su contracción contribuye con el acortamiento de los espacios intercostales y la elevación de las costillas. En ausencia de enfermedad se ha encontrado que un 50-60% de sus fibras corresponden a tipo I y un 40-50% a fibras tipo II.
Músculos accesorios de la inspiración
Músculos accesorios de la inspiración. La mayoría de los músculos de la región del cuello, cintura escapular y región superior del tórax participan en la inspiración durante circunstancias especiales. Entre ellos destacan los siguientes.
Músculos escalenos
Los músculos escalenos que se extienden desde las apófisis transversas de las últimas cinco vértebras cervicales hasta la superficie anterior de la primera y segunda costillas. Su contracción colabora con el ascenso de las costillas superiores y se evidencia como la retracción del cuello y espacio supraclavicular durante la inspiración forzada.
Músculo esternocleidomastoideo
El músculo esternocleidomastoideo se extiende desde la apófisis mastoides hasta la parte anterior del tórax, insertándose en la clavícula y esternón. Su contracción igualmente ayuda a la elevación de la caja torácica superior.
Músculo dorsal ancho
El músculo dorsal ancho se extiende desde la cara externa de las últimas cuatro costillas, la cresta ilíaca y apófisis espinosas de las últimas vértebras dorsales y lumbares hasta la corredera bicipital del húmero. Si se fija en este lugar su contracción colabora con la elevación de las costillas ayudando en la inspiración.
Músculos espiratorios
La espiración es un fenómeno pasivo en condiciones de reposo y en ausencia de enfermedad. Sin embargo, en condiciones de ejercicio o en presencia de enfermedades obstructivas del flujo aéreo, los músculos intercostales internos y de la pared abdominal (transverso, recto anterior, y oblícuo mayor y menor) se reclutan y activan con tal de incrementar la presión intratorácica y abdominal, descender las costillas y desplazar al diafragma en sentido cefálico.
Todo ello se traduce en la posibilidad de realizar esfuerzos espiratorios como la tos, el estornudo, o la espiración contra una sobrecarga mecánica (p.ej., broncoespasmo). Por su parte, los músculos abdominales han sido menos estudiados. Nuestros datos preliminares demuestran que el oblicuo externo del abdomen muestra, en promedio, 30-60% de fibras tipo I.
Estructura de los músculos respiratorios en presencia de enfermedades respiratorias
Convencionalmente se ha considerado que el diafragma y demás músculos respiratorios sufrían atrofia e involución en pacientes portadores de enfermedades respiratorias como la EPOC. Este concepto era erróneo, cuando menos parcialmente.
Nuestro grupo, en el año 1996, describió por primera vez la evidencia de cambios de remodelamiento (a los que llamamos “adaptación”) tanto en el diafragma como en los intercostales externos de pacientes con EPOC.
Dos trabajos publicados recientemente han permitido profundizar en estos hallazgos estructurales que, desde el punto de vista funcional, se traducen en unos músculos adaptados a la sobrecarga crónica que implica la enfermedad. Así por ejemplo, tenemos que:
Diafragma en pacientes con EPOC o asma bronquial
El diafragma de pacientes con EPOC o asma bronquial se desplaza caudalmente (es decir, se aplana) como consecuencia de la hiperinflación pulmonar y el atrapamiento aéreo. Sin embargo, sus sarcómeras presentan una menor longitud comparándolas con el diafragma de individuos sanos16.
Este cambio representa una adaptación estructural que permite al músculo restaurar en parte la capacidad de generar tensión a pesar que la longitud total de la fibra se encuentra disminuída17 . Desde el punto de vista de organelos, se ha documentado una mayor densidad mitocondrial y capilar18 ,19 ,20 .
Estos cambios reflejan un incremento de su capacidad oxidativa (mayor tolerancia a cargas prolongadas) similar a lo que se puede observar en músculos de las extremidades de atletas de fondo. En el mismo sentido, se ha demostrado la existencia de cambios moleculares a nivel de las cadenas pesadas de miosina a expensas de un incremento de la isoforma I en comparación con sujetos sanos, lo que confirma su adaptación ante la sobrecarga aeróbica crónica21.
Aún existe controversia sobre la capacidad enzimática (aeróbica y anaeróbica) en el diafragma de pacientes con EPOC por lo cual se continúan realizando los estudios pertinentes.
Intercostales externos en pacientes con EPOC
El tamaño de las fibras de los músculos intercostales externos se ha encontrado preservado en pacientes con EPOC.22 Sin embargo, a nivel molecular el cambio es en contrasentido con lo observado en el diafragma: se aumenta el contenido de miosina II en relación directa con la gravedad de la EPOC23 . Esto podría atribuírse a un reclutamiento intermitente y de alta intensidad, probablemente asociado a la tos o a incrementos ventilatorios durante el ejercicio en actividades cotidianas.
Músculos accesorios con EPOC
Los pacientes con EPOC con frecuencia muestran activación de músculos del cuello y del abdomen, inclusive en situación de reposo. Un estudio previo ha demostrado incremento en el tamaño de las fibras del músculo dorsal ancho, lo cual confirma su capacidad de remodelamiento y el potencial reclutamiento durante situación de sobrecarga (p.ej., la tos, la hiperinflación pulmonar).
Músculos espiratorios en pacientes con EPOC
Aunque la fuerza y resistencia de los músculos espiratorios ha cobrado importancia recientemente, se dispone de muy poca información al respecto. Se sabe que dichos músculos en pacientes con EPOC muestran disminución de la fuerza y resistencia espiratorias.
El tamaño de las fibras del músculo oblicuo externo (uno de los principales músculos espiratorios) no se ha encontrado disminuído significativamente. Por ello se asume que el déficit que presentan sea secundario a alteraciones intracelulares más que a una disminución de la masa muscular detectable por índices como el tamaño de sus fibras6.
Evaluación de la fuerza muscular respiratoria
Cuando se evalúa la fuerza de los músculos respiratorios se debe tener en cuenta que estamos enfocándonos básicamente a la capacidad que presentan estos músculos para generar tensión durante una maniobra inspiratoria o espiratoria máxima y forzada.
El resultado de la maniobra se puede medir en boca, esófago o estomago en términos de presión (cmH2O o mmHg). Esto refleja básicamente un conjunto de variables como la masa muscular (capacidad de generar fuerza), relaciones de longitud-tensión, frecuencia de estimulación y velocidad de acortamiento que presenten dichos músculos.
La fuerza de los músculos respiratorios se puede evaluar de dos formas clasificadas según según las técnicas o maniobras que se utilicen. Las maniobras dinámicas son aquellas que se acompañan de flujo aéreo por tanto la vía aérea debe estar permeable y la medida puede realizarse a diferentes volúmenes pulmonares.
Por su parte, las maniobras estáticas son aquellas en las que no hay flujo aéreo lo cual implica que la contracción muscular es de tipo isométrico y se realiza a isovolumen pulmonar. Las maniobras más ampliamente utilizadas incluyen:
Medición global de la fuerza muscular inspiratoria y espiratoria
El registro de la presión máxima en boca durante las maniobras de Müller o de valsalva, respectivamente, permite evaluar la fuerza máxima de los músculos inspiratorios (PImax) y espiratorios (PEmax) como grupo.
Las maniobras están basadas en la descripción por Black y Hyatt24 y consisten en medir la presión que se genera en la boca tras un esfuerzo inspiratorio o espiratorio máximo, voluntario o no, ante un circuito cerrado.
Al no existir flujo de aire la presión que se genera en el tórax a consecuencia de la acción de los músculos inspiratorios o espiratorios es transmitida a la boca donde es fácilmente registrada. Técnicamente debe tenerse en cuenta que las maniobras pueden realizarse a diferentes volúmenes pulmonares y por ello los resultados deben ser interpretados cuidadosamente.
Se ha determinado que la PIM debe ser realizada desde volumen residual (VR) ya que a medida que se aumenta el volumen pulmonar esta tiende a ser menor a consecuencia de la disminución de la longitud de los músculos inspiratorios especialmente el diafragma.
De la misma forma la PEM debe ser realizada desde capacidad pulmonar total (CPT). Deben realizarse un mínimo de 5 a 8 maniobras y reproducibles, con un breve descanso de intervalo. La diferencia entre las tres mejores maniobras no debe ser mayor al 5%. Para minimizar la participación de los músculos de la boca (especialmente los buccinadores) se debe conectar el paciente a una boquilla fenestrada con un agujero de 2 mm de diámetro.
Algunas de las desventajas que presenta estas maniobras incluyen: variabilidad de los resultados con relación al volumen pulmonar, dependencia al esfuerzo y motivación del paciente, evalúan globalmente musculatura inspiratoria sin discriminación de cada músculo participante, y puede ser influenciada por la acción de musculatura facial.
Medición específica de la fuerza del diafragma
La presión trans-diafragmática (Pdi) refleja la presión generada por el diafragma durante un esfuerzo inspiratorio.
En cada contracción el diafragma genera un cambio de presión en el ámbito de tórax (presión negativa) y abdomen (presión positiva) como resultado de su desplazamiento como émbolo en sentido cefalo-caudal. La evaluación de la Pdi es posible en los laboratorios de función respiratoria mediante la introducción de un catéter con balón distal en la cavidad gastrica y otro en la luz del esófago.
Los catéteres se introducen por la nariz y se conectan a sendos transductores de presión y a un sistema de registro previamente calibrados. La presión medida en esófago (Pes) es representativa de la presión pleural, miesntras que la presión intra-gástrica (Pga) refleja la de la cavidad abdominal. Fácilmente se puede establecer la presión transdiafragmática (Pdi) a partir de la diferencia de los dos componentes según la fórmula:
Pdi = Pga – Pes
La Pes permite evaluar la función de los músculos inspiratorios en general. Es posible calcular el cociente Pes/Pdi que indicaría la fracción de Pdi que corresponde a presión pleural. La determinación de las presiones puede realizarse a volumen corriente, sin esfuerzo, o con maniobras forzadas (por ejemplo Müller que correspondería a la maniobra estática de Pdimax).
Otra forma de evaluación es la maniobra de inspiración rápida forzada con vía aérea permeable o “sniff” (maniobra dinámica de la Pdimax). Es bastante reproducible, sencilla para el paciente y por estudios no se han encontrado diferencias significativas con la maniobra de Müller. Es útil también realizar medidas de Pes, Pga y Pdi durante maniobras de espiración forzada como la tos.
En estudios previos hemos demostrado que puede reflejar la participación del diafragma como trasductor de presión intrabdominal en pacientes post-operados de abdomen (galart et al.). En general las principales desventajas de la técnica son el carácter invasivo del procedimiento y la dependencia de la calidad de la maniobra voluntaria del paciente.
Por ello se ha propuesto la estimulación eléctrica del nervio frénico o de los centros respiratorios para obviar el carácter volutivo, pero su aplicación en la actualidad la recomendamos solo para el ámbito especializado e investigativo.
Evaluación de la resistencia múscular respiratoria
Cuando hablamos de resistencia muscular nos referimos a la capacidad que tienen los músculos para generar y mantener altos niveles de tensión o presión. Esta capacidad depende directamente del numero de capilares y mitocondrias, como de la capacidad enzimática oxidativa de cada músculo. Existen varias técnicas para la evaluación de la resistencia muscular respiratoria. Algunas son más especificas que otras y logran evaluar cada grupo respiratorio con relación a su función. Sin embargo las más comúnmente utilizadas son las siguientes.
Pruebas inespecíficas de resistencia muscular respiratoria
Pruebas de esfuerzo físico general
Algunos autores han propuesto que las pruebas de marcha de 6 o 12 minutos, cicloergometría, cinta rodante o el sentarse/levantarse pueden evaluar la resistencia de los músculos respiratorios en los pacientes portadores de EPOC, asma, secuelas post-tuberculosas, u otras enfermedades.
Su aplicación está bien definida cuando se desea evaluar íntegramente la adaptación y reserva al esfuerzo físico general. Sin embargo, el carácter multisistémico de estas pruebas involucra la participación del aparato cardiovascular y muscular esquelético global, lo cual dificulta la evaluación específica de los grupos musculares inspiratorio o espiratorio.
Pruebas de ventilación voluntaria máxima
Es la máxima ventilación que un individuo puede mantener durante un período de al menos 15 segundos, con una frecuencia respiratoria mayor de 80 por minuto. Durante esta prueba el paciente se conecta a un neumotacógrafo que permite registrar el volumen corriente, la frecuencia respiratoria y el patrón respiratorio durante al menos 12-15 segundos.
El paciente debe respirar lo más rápido y profundo como le sea posible. Es una maniobra de carácter volutivo e inespecífica en lo que respecta a la evaluación funcional muscular puesto que implica el reclutamiento simultáneo de la musculatura inspiratoria y espiratoria.
En pacientes con enfermedades obstructivas como la EPOC o el asma la variable resultado dependerá en forma importante del grado de obstrucción del flujo aéreo y no solo de la función muscular.
Pruebas específicas de resistencia muscular respiratoria
Para evaluar específicamente la resistencia de los músculos respiratorios es necesario disponer de un circuito diferencial o válvula de dos vías. Esto permite que la sobrecarga mecánica se pueda aplicar exclusivamente sobre el grupo muscular que se desea evaluar, inspiratoio o espiratorio según el caso.
El fundamento para evaluar específicamente la resistencia muscular respiratoria implica contar con un sistema de sobrecarga mecánica de estos músculos. Este sistema puede ser logrado con varios instrumentos pero que se clasifican fundamentalmente en dos tipos:
1. Sistemas resistivo (elástico, resortado o de orificio) por medio del cual se obstruye la entrada del aire hacia la válvula de dos vías. Tiene la ventaja de ser sistemas simples desde el punto de vista técnico, pero por el contrario, muy irregulares en cuanto a la reproducibilidad de las cargas.
Esta falta de reproducibilidad se observa no solo interindividualmente sino en un mismo individuo y se justifica, fundamentalmente, por la dependencia entre carga impuesta y flujo. Esto hace que los pacientes puedan incrementar o disminuir el esfuerzo respiratorio según se modifique la frecuencia y los tiempos inspiratorio o espiratorio.
2. El segundo sistema es el que incluye mecanismos de apertura umbral. Su nombre se deriva de su comportamiento mecánico, pues implica la necesidad de establecer un presión mínima (y de ahí su nombre umbral) para que la válvula se abra y permita establecer el flujo aéreo.
El fundamento mecánico es la existencia de un émbolo sobre el cual se colocan pesos externos calibrados y que permiten mantener una carga experimental controlada e independiente del patrón respiratorio.
Esto permite evaluar además las estrategias ventilatorias de cada individuo durante la ejecución de la prueba. Este sistema fue descrito originalmente por Nickerson et al. para los músculos inspiratorios25 y por Orozco-Levi et al. para los músculos espiratorios.26
Medición de la resistencia ante cargas respiratorias incrementales
Para la evaluación de la resistencia inspiratoria Nickerson y Keens describieron un prototipo de válvula con mecanismo de apertura umbral en el año 1982. Posteriormente, Martyn propuso la evaluación funcional de la resistencia muscular inspiratoria al imponer cargas incrementales cada 2 minutos, emulando una prueba cicloergométrica.
Recientemente Orozco-Levi y Maldonado describieron una válvula con mecanismo de apertura umbral para ser aplicada en la evaluación de la resistencia de los músculos espiratorios.26 La variable resultado representativa de la resistencia muscular respiratoria está definida como la carga máxima (en términos de presión) contra la que el individuo es capaz de respirar al menos un minuto antes de claudicar.
Este valor se ha definido como carga o presión máxima tolerada (PMT, en cmH2O) o sostenible (SIP, del inglés sustainable inspiratory pressure, o SEP, de sustainable expiratory pressure).25,26 En sujetos normales la PMT corresponde aproximadamente al 60% de la PImax o Pemax, según el caso.
Se ha demostrado que la PMT puede ser un 50% mayor si la carga inspiratoria es aplicada en forma progresiva (p.ej., 50 gr. cada 2 minutos). Para la ejecución de la prueba el individuo se coloca en posición sedente, con un clip de obstrucción nasal y respira espontáneamente a través de una boquilla de tipo submarinista.
Esta boquilla se conecta a la válvula dos vías que permite independizar los dos circuitos, inspiratorio y espiratorio, mientras se registra de forma continua a nivel de la boca la presión generada en cada esfuerzo respiratorio.
Medición de la resistencia ante cargas respiratorias constantes
Fiz et al.27 propuso aplicar cargas submáximas constantes para realizar la evaluación de la resistencia de los músculos inspiratorios. Esta modalidad ha sido también adoptada por nuestro grupo. Recientemente, Ramírez-Sarmiento et al. publicó la aplicación de una prueba de carga espiratoria constante en pacientes con EPOC. Consideramos que el ejercicio ante carga constante ofrece una información complementaria a la que se obtiene con la anterior prueba incremental.
Probablemente esta sea la prueba por excelencia que mejor refleja un ejercicio de resistencia. La variable resultado se interpreta en términos de tiempo (minutos) durante el cual el individuos es capaz de respirar ante la carga impuesta.
Se conoce como tiempo de aguante o límite de tiempo (Tlim). El paciente debe estar en posición sedente, cómodo, utilizando un clip nasal y respirando a través de una boquilla de tipo submarinista conectada a la válvula de dos vías a través de la cual se aplicara la carga. Se ha decidido normalizar la carga como el 80% de la PMT.
Criterios de claudicación
Uno de los puntos más críticos para considerar válida una prueba de esfuerzo de los músculos respiratorios es el criterio de claudicación o final de la prueba. Involucra, por una parte, la experticia del examinador y, por otra, la función muscular propiamente dicha y el grado de colaboración del paciente.
En este sentido cabe anotar que las sensaciones que se precipitan durante la ejecución de la prueba son similares a la disnea que se genera durante las pruebas de esfuerzo general, por cuanto incluye además las variables de perceptuales de disnea, esfuerzo muscular y fatiga. La integración de todos estos factores es lo que se expresará como variable resultado en las pruebas de resistencia.
En nuestro laboratorio el final de la prueba lo determinan variables subjetivas (disnea limitante) y objetivas (evidencia de incapacidad para continuar abriendo la válvula durante 3 o más esfuerzos consecutivos).
Uno de los puntos que representa una línea de investigación con interés clínico es la realización de estudios para establecer valores de referencia para las variables de resistencia muscular respiratoria en relación con la edad y género (masculino y femenino) de individuos sanos.
De hecho, las variables de presión máxima tolerada y límite de tiempo se analizan convencionalmente en términos de valor absoluto por la ausencia de valores de referencia publicados. Sin embargo, es habitual que se hagan normalizaciones expresándolas como un porcentaje de la PImax o del valor observado en sanos.
Figura No 1. Registro típico de la curva de presión en boca (Pboca) generada durante la respiración contra una carga espiratoria constante y utilizando el sistema de válvulas de dos vías.
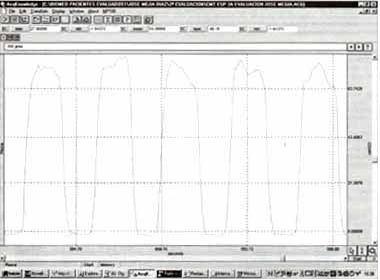
En este caso, se ha conectado a su circuito espiratorio una segunda válvula con mecanismo de apertura umbral de acuerdo al diseño original de Orozco-Levi et al (Lung, 2001). Abreviaturas: (TE ): tiempo espiratorio durante un ciclo respiratorio; (TI ): tiempo inspiratorio.
Figura No 2. Registro típico de la curva de presión en boca (Pboca) generada durante la respiración contra una carga inspiratorias constante y utilizando el sistema de válvula de dos vías.
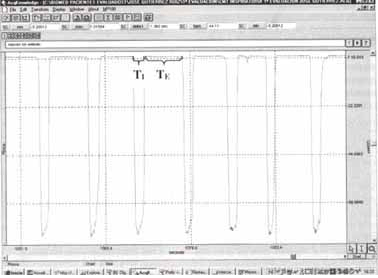
En este caso, se ha conectado una segunda válvula con mecanismo de apertura umbral en su circuito inspiratorio de acuerdo al diseño de Nickerson et al. Modificado por los autores. Abreviaturas: (TE ): tiempo espiratorio, y (TI ): tiempo inspiratorio durante un ciclo inspiratorio.
Figura No 3. Registro típico de la curva de presión en boca (Pboca ) generada durante la respiración contra cargas espiratorias incrementales (aprox. 10 cmH2O de presión media cada 2 minutos) hasta la claudicación.
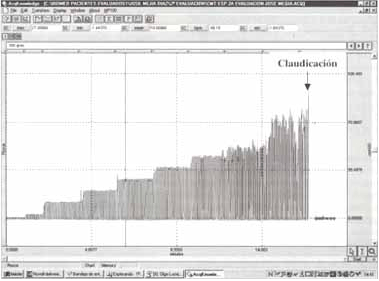
Se ha utilizado un sistema de válvulas de dos vías conectando a su circuito espiratorio una segunda válvula con mecanismo de apertura umbral de acuerdo al diseño original de Orozco-Levi et al. Para sus especificaciones técnicas, favor remitirse al texto.
Figura No. 4 Registro típico de la curva de presión en boca (Pboca ) generada durante la respiración contra cargas inspiratorias incrementales (aprox. 10 cmH2O de presión media cada 2 minutos) hasta la claudicación.
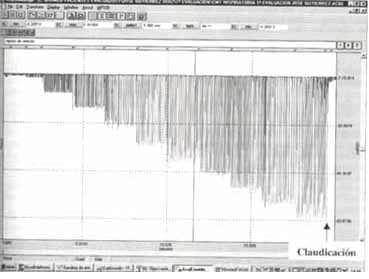
Se ha utilizado un sistema de válvulas de dos vías conectando a su circuito inspiratorio una segunda válvula con mecanismo de apertura umbral de acuerdo al diseño original de Nickerson et al. Para sus especificaciones técnicas, favor remitirse al texto.
Agradecimientos
A los pacientes que han participado como voluntarios en los estudios de evaluación incluídos en la presente revisión; al Dr. Joaquim Gea por su liderazgo colaborativo y sus sugerencias sobre el presente manuscrito; al Dr. Joan Mª Broquetas, Dr. Carles SanJuas, Dr. Victor Curull, Dr. Miquel Félez y Dra. Eva Balcells por sus sugerencias respecto a la logística de algunos estudios; al Dr. Carlos Coronell y Biol. Raúl Méndez por su asistencia científica; al Dr. Jose Palacio y Dra. Carme Casadevall por su participación en estudios estructurales musculares; a las Enfermeras Nuria Soler y Angela Roig por su asistencia técnica.
Bibliografía
1. Orozco-Levi M, Lloreta J, Minguella J, Serrano S, Broquetas JM, Gea J. Injury of the Human Diaphragm Associated with Exertion and Chronic Obstructive Pulmonary Disease. Am J Respir Crit Care Med 2001;164:1734-1739.
2. Ramírez-Sarmiento AL, Orozco-Levi M, Barreiro E, Güell R, Méndez R, Hernández N, Casan P, Broquetas JM, Gea J. Structural adaptation of inspiratory muscles following specific inspiratory training in patients with COPD 2002 (enero, en revisión).
3. Ramírez-Sarmiento AL, Orozco-Levi M, Barreiro E, Güell R, Méndez R, Hernández N, Coronell C, Casan P, Broquetas JM, Gea J. Expiratory muscle training in patients with severe COPD: Funtional and structural effects. Eur Respir J 18: (supplement); A1262.
4. National Heart, Lung, and Blood Institute. Morbidity & Mortality: Chartbook on Cardiovascular, Lung and Blood Diseases. U.S. Department of Health and Human Services, Public Health Services. National Institutes of Health, Bethesda, MD. 1998. Available from: URL: www.nhlbi.nih.gov/nhlbi//seiin//other/cht-book/htm.
5. Schols A, Wouters E, Soeters PB,Westertep KR. Body composition by bioelectrical impedance analysis compared to deterium dilution and skinfold anthropometry in patients with chronic obstructive pulmonary disease. Am J Clin Nutr 1991; 53: 421-424.
6. Simard C, Maltais F, Leblanc P, Simard PM, Jobin J. Mitochondrial and capillarity changes in vastus lateralis muscle of COPD patients: electron microscopy study. Med Sci Sports Exerc 1996; 28: 95.
7. Whittom F, Jobin J, Simard PM, Leblanc P, Simard C, Bernard S et al. Histochemical and morphological characteristics of the vastus lateralis muscle en COPD patients. Med Sci Sports Exerc 1998; 30: 1467-1474.
8. Satta A, Migliori GB, Spanevello A, Neri M, Bottinelli R, Canepari M el al. Fibre types in skeletal muscles of chronic obstructive pulmonary disease patients related to respiratory function and exercise tolerance. Eur Respir J 1997; 10: 2853-2860.
9. Sato Y, Asoh T, Honda Y, Fujimatso Y, Higuchi I, Oizumi K. Morphologic and histochemical evaluation of muscle in patients with chronic pulmonary emphysema manifesting generalized emaciation. Eur Neurol 1997; 37: 116-121.
10. Maltais F, Simard A, Simard C, Tobin J, Desgagnés P, Le Blanc P. Oxidative capacity of the skeletal muscle and lactic acid kinetics during exercise in normal subjects and in patientes with COPD. Am J Respir Crit Care Med 1996; 153: 288-293.
11. Patessio A, Casaburi R, Carone M, Appendini l, Donner CF, Wasserman K. Comparison of gas exchange , lactate, and lactic acidosis thersholds in patients with chronica obstructive pulmonary disease. Am Rev Respir Dis 1993; 148: 622-626.
12. Orozco-Levi M. Cambios adaptativos en la estructura subcelular del diafragma humano. Asociaciones con la Enfermedad Pulmonar Obstructiva Crónica. Barcelona Tesis doctoral, Universidad Autónoma de Barcelona, 1995.
13. Guyton Arthur, Hall John, Eds. Tratado de fisiología Médica. 9ª Edición. MacGraw-Hill Interamericana, 1996.
14. Brooke MH, Englels WK. The hytographic analysis of human biopsies with regard to fibre types. 1. Adult male and female. Neurology 1969;Vol:221-233.
15. Rochester DF. The diaphragm contractile properties and fatigue. J Clin Invest 1985;75:1397-1402.
16. Orozco-Levi M, Gea J, Lloreta J, Félez M, Minguella J, Serrano S, JM Broquetas. Subcellular adaptation of the human diaphragm in chronic obstructive pulmonary disease. Eur Respir J 1999;13:371-378.
17. Orozco-Levi M, Gea J. Cambios musculares en la enfermedad pulmonar obstructiva crónica: la teoria de los compartimientos. Arch Bronconeumol 1999
18. Lloreta J, Orozco-Levi M, Gea J, Corominas KM, Serrano S. Selective diaphragmatic mitochondrial abnormalities in severe airflow obstruction. Ultrastructural Pathology 1996; 20: 67-71.
19. Orozco-Levi M, Gea J, Lloreta J, Minguella J, Broquetas JM. Changes in the capillary content of the diaphragm in COPD patients: a sort of muscle remodeling? Am J Respir Crit Care Med 1996; 153 (Supl): A298.
20. Orozco-Levi M, Jimenez MA, Gea J, Corominas JM, Broquetas JM. Capillary supply of the respiratory muscles in COPD. Eur Resp J 1996; 9:158.
21. Levine F, Kaiser L, Leferovich J, Tikunov B. Cellular adaptation in the diaphragm in chronic obstructive disease. N Engl J Med 1997; 337:1799-1806.
22. Sauleda J, Orozco-Levi M, Coraminas J, Minguella J, Aguar MC, Broquetas J et al. Structure and function relationships of the respiratory muscles. Eur Respir J 1998; 11: 906-911.
23. Orozco-Levi M, Gea J, Aguar MC, Martín-Campos J, Broquetas JM. Changes in myosin expression in the external intercostal muscles of COPD patients. Am J Respir Crit Care Med 1997; 155: A510.
24. Black LF, Hyatt RE. Maximal respiratory pressures: normal values and relationship to age and sex. Am Rev Respir Dis 1969;99: 696-702.
25. Nickerson BG, Keens TG. Measuring ventilatory muscle endurance in humans as sustainable inspiratory pressure. J. Appl Physiol 1989;67:1311-1318.
26. Orozco-Levi M, Gea J, Ferrer A, Méndez R, Ramírez-Sarmiento AL, Maldonado D, Broquetas J. Expiratory muscle endurance in middle-aged healthy subjects. Lung 2001;179:93-103.
27. Fiz JA, Romero P, Gómez R, Hernández MC, Ruiz J, Izquierdo J, Coll R, Morera J. Indices of respiratory muscle endurance in healthy subjects. Respiration 1998;65:21-7