Paciente de 45 años, con diagnóstico de artritis reumatoidea desde los 43 años, asintomática, sin tratamiento, y antecedentes de tabaquismo de los 15 a los 35 años de 3 a 10 cigarrillos diarios. Casada, nulípara. Refiere de 7 meses de evolución episodios de disnea moderada con ejercicios y tos seca con ocasional expectoración mucosa.
Cinco meses antes de su consulta, presentó episodio de decaimiento por lo cual se le practicó radiografía de tórax que demostró opacidad parenquimatosa derecha interpretada como neumonía y tratada con antibióticos con mejoría sintomática.
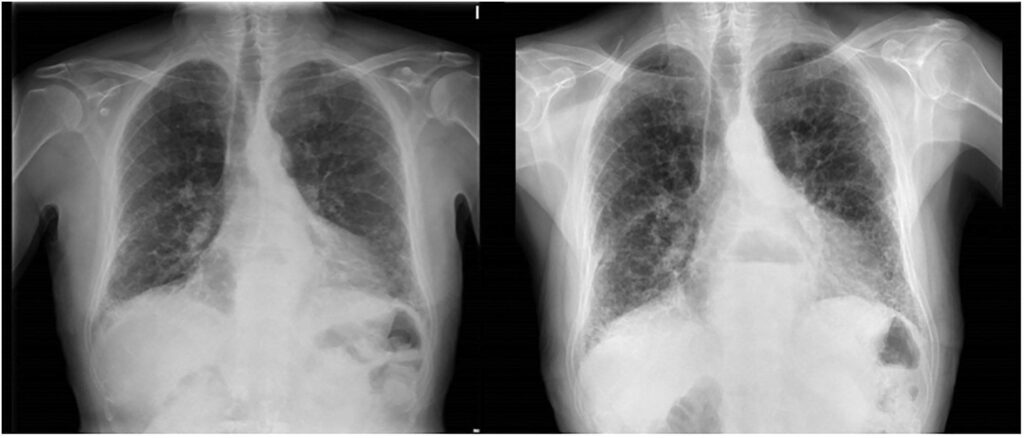
Tres meses después una radiografía de control demostró persistencia de la opacidad en la base pulmonar derecha e infiltrados intersticiales perivasculares sin modificación con la anterior, por lo cual se solicitó TAC de tórax que mostró una tumefacción sólida de bordes mal definidos, sin broncograma aéreo en su interior, infiltrativa, en lóbulo medio e inferior derechos y tumefacción en el receso pleuro-ázigo-esofágico con nódulos en los lóbulos inferiores e infiltrados en el intersticio perivascular en los lóbulos inferiores.
Los bronquios del lóbulo superior e intermediario se observaron ocluídos. Se observó además una opacidad hiliar derecha con imágenes nodulares bilaterales, interpretadas como lesión maligna con metástasis por lo cual la envían para broncofibroscopia.
Revisión por sistemas
A la revisión por sistemas refiere sudoración nocturna profusa los últimos 3 meses. Al examen clínico: TA: 120/70 FC: 107x´ FR: 22 x´ SaO2: 84% al aire. Peso: 59 Kg. Escurrimiento muco-purulento posterior, pequeñas adenopatías axilares izquierdas. Disminución de ruídos respiratorios en el hemitórax derecho. Resto del examen fue normal.
El cuadro hemático demostró Hb: 14.1 g /dl Htc: 43% Leucocitos: 5.200/mm3 N: 67% L: 23% E: 2% M: 4% Plaquetas: 240.000 /mm3. Glicemia: 90 mg/dl Creatinina: 0.7 mg/dl DHL: 362 mg/dl. PT: 15” PTT: 26” INR: 1.0
Las pruebas de función pulmonar demostraron: Capacidad Vital: 1.45 L (47%), con VEF1”: 1.31 L (51%) y relación VEF1”/CV: 91% compatible con trastorno restrictivo, y los Gases Arteriales al aire: pH: 7.478 PaCO2: 24.9 mm Hg., PaO2: 56 mm Hg., HCO3: 18.6 mEq/L SaO2: 91.3%. (Ver también: Nódulo pulmonar)
Resultados fibrobroncoscopia
En la Fibrobroncoscopia se encontró una masa friable que obstruía el bronquio del lóbulo superior derecho y el bronquio intermediario, de la cual se tomaron varias biopsias que demostraron una neoplasia constituída por células pequeñas de origen linfoide, de tipo intermedio, redondas, de tamaño uniforme, con núcleo reniforme y nucléolo, compatibles con Linfoma pulmonar.
Se practicaron estudios de inmunohistoquímica, informados positivos para CD45, CD20, CD43 y expresión monoclonal Lambda, hallazgos que permiten diagnósticar Linfoma de células B compatible con Linfoma de zona marginal, extranodal, con focos de transformación a Linfoma de célula grande, estadío IIEb en la clasificación internacional de Ann Arbor.
No se pudo efectuar estudio con galio como marcador de la actividad tumoral previo al tratamiento, por severa dificultad respiratoria; se realizó quimioterapia 6 ciclos de tipo CHOP (ciclofosfamida, adriamicina, vincristina y prednisona) con marcada mejoría clínica. La radiografía de tórax 3 meses después del tratamiento demuestra mejoría casi completa de los infiltrados (Fig. 3), y una broncoscopia de control mostró la presencia de puentes mucosos sin presencia de tumor en la biopsia.
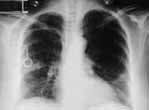
Figura No.3 Mejoría radiológica posterior a la quimioterapia.
Discusión
Los Linfomas malignos del pulmón son tumores raros. La mayoría de ellos están constituídos por células B de bajo grado de malignidad. Por su buen pronóstico y peculiaridades morfológicas han sido erróneamente denominados seudo linfomas, por esta razón su verdadera incidencia no ha sido fácil de establecer.
Varios nombres han sido propuestos para denominarlos, como Linfoma linfocítico, Linfoma Linfoplasmático, Inmunocitoma, Macroglobulinemia de Waldenstrom, Linfoma centrocítico o intermedio, y Linfoma centrofolicular.
El advenimiento de la inmunohistoquímica ha permitido establecer que la gran mayoría de Linfomas pulmonares son de tipo MALT. Otros Linfomas Primarios pulmonares de bajo grado, incluyendo el Linfoma linfocítico, Linfoma folicular y Linfoma centrocítico de células mantle son extremadamente raros.
Linfomas de alto grado tipo MALT
Los Linfomas de alto grado son igualmente muy raros y una gran proporción de ellos se debe a transformación de los Linfomas tipo MALT de bajo grado. El Linfoma Hodgkin primario pulmonar es extremadamente raro.
En 1973 Bienenstock describió la presencia de Tejido Linfoide Asociado a Mucosas (MALT), en pulmón de conejos, denominado Tejido Linfoide asociado a Bronquios (BALT). Posteriormente otros autores no han podido demostrar este tipo de tejido en humanos o animales de experimentación.
El tejido linfoide es muy difícil de encontrar en pulmones humanos normales, pero agregados linfoides peribronquiales muy similares a las placas de Peyer se han encontrado en fetos y recién nacidos con evidencia de infección.
La bronquiolitis folicular ocurre en el pulmón del adulto a menudo asociado con el síndrome de Sjogren y otras enfermedades autoinmunes.
Así como en el estómago y en las glándulas animales, en el pulmón puede adquirirse MALT. La asociación de MALT con el síndrome de Sjogren sugiere que estos Linfomas pueden asentarse en condiciones bronquiales de base como la Bronquiolitis folicular.
La mayoría de los Linfomas del pulmón son de células B de tipo MALT. Generalmente ocurren en la sexta y séptimas décadas y la incidencia por sexos es igual. La presentación más común es la de nódulo solitario bien definido que se encuentra en una radiografía de tórax de un chequeo. Es menos frecuente que se presente como nódulos múltiples asociados a derrame pleural. La mayoría pacientes están en el estadío IE con pocos casos en estadio IIE que se asocian a linfadenopatía hiliar.
La mayoría de pacientes son asintomáticos o pueden presentar tos, dolor en el tórax y disnea, y algunos de ellos pueden tener síntomas como fiebre, pérdida de peso y sudor nocturno.
Desde el punto de vista patológico hay un infiltrado difuso de células linfoides pequeñas que contienen un número variable de folículos reactivos de células B identificables. En los extremos de la lesión hay folículos aislados y un infiltrado linfoide intersticial que puede ser tomado por una Neumonía Intersticial Linfoide.
Diagnóstico diferencial
El diagnóstico diferencial se debe hacer con:
a) la Neumonía Intersticial Linfoide, la cual usualmente se presenta como infiltrado intersticial difuso, a diferencia del Linfoma MALT que frecuentemente forma masas sólidas
b) con la Bronquiolitis folicular, la cual se presenta en pacientes con enfermedades autoinmunes, como parte de un síndrome de hipersensibilidad con eosinofilia en sangre periférica, y en pacientes con inmunode-ficiencia incluyendo el SIDA. Ocasionalmente se requiere de inmunohistoquímica o métodos moleculares para demostrar monoclonalidad.
c) Otra serie de trastornos con infiltrados linfocíticos severos, tales como el Granuloma de células plasmáticas, enfermedad de Castleman, Granuloma hialinizante pulmonar y nódulos linfáticos intraparenquimatosos.
El pronóstico no es diferente de la población general. En el estudio de Li y cols2 se analizan 43 pacientes, clasificados 33 de ellos en estadío IE y 7 en estadío IIE. Los otros 3 pacientes no se pudieron clasificar. El tratamiento consistió en resección quirúrgica, o resección + quimioterapia o radioterapia.
Veinte casos (46%) tuvieron recaída, la mayoría en pulmón, pero también en ganglios linfáticos mediastinales, cervicales, axilares e inguinales. En 3 casos el tumor se transformó a lesión de alto grado. Aún así, la sobrevida fue similar al grupo pareado por edad de la población general.
Bibliografia
1. Gould S, Isaacson PG. Bronchus associated lymphoid tissue (BALT) in human fetal and infant lung. J Pathol 1993; 169:229-234
2. Koss MN. Hochholzer L, Nichols PW, et al. Primary non-Hodgkin’s lymphoma and pseudolymphoma of the lung: a study of 161 patients. Human Pathol 1983; 14: 1024-1038
3. Gephardt GN, Tubbs RR. Pulmonary Lymphomas and other Lymphoproliferative lesions. In Saldana MJ. Pathology of pulmonary disease. JB Lippincott Company, Phyladelphia 1994; pp 631-643