Esta técnica de biopsia transbronquial, realizada inicialmente por Andersen en 1963 con el broncoscopio rígido, y perfeccionada posteriormente en el decenio de los 70 a través del fibrobroncoscopio1-2, constituye en la actualidad un valioso método diagnóstico de muy baja morbimortalidad, con su mayor rendimiento en ciertas categorías de infiltrados pulmonares difusos y en lesiones periféricas entre 2-6 cms de diámetro.
La hipertensión pulmonar importante, la hipoxemia severa, diátesis hemorrágica, ventilación mecánica con presión positiva y el infarto reciente de miocardio, contraindican de manera absoluta el procedimiento, mientras que la hipertensión pulmonar moderada, el enfisema buloso, la terapia anticoagulante, la angina, historia de asma o tos no controladas, falta de consentimiento del paciente y un conteo plaquetario inferior a 50.000, se consideran contraindicaciones relativas. (Ver también: Decaimiento e infiltrado pulmonar)
Paulina Ojeda,MD*,
José G. Bustillo, MD**,
Juvenal Baena P, MD***
* Jefe dpto de Patología Hospital Santa Clara. Bogotá –
Profesora asistente Universidad El Bosque. Bogotá.
Patóloga Fundación Cardio Infantil.
** Coordinador Departamento de Medicina Interna Hospital Juan N Corpas.
Docente Universidades La Sabana, Javeriana y El Bosque.
*** Médico Neumólogo Endoscopista. Hospital Universitario La Samaritana
Preparación y procedimiento de biopsia transbronquial
En presencia de lesiones difusas no es indispensable el concurso de imágenes, las cuales son de mucha ayuda en los casos de lesiones focales. Los equipos de fluoroscopia biplana con brazo en C permiten comprobar la posición de la pinza dentro de la lesión, evitando tomar muestras anteriores o posteriores a la misma3.
Una vez introducido y acuñado el broncoscopio en el bronquio elegido, se introduce y se hace avanzar lentamente la pinza de biopsia por el canal respectivo, hasta tener la sensación de resistencia. Si el paciente acusa dolor, la pinza se encuentra muy cerca de la pleura parietal, lo cual obliga a retirarla 0.5 a 1 cm.
Hecho esto, se abre y se hace progresar nuevamente hasta notar resistencia moderada; en ese momento se cierra firmemente y se retira en forma suave para evitar desgarro y sangrado del tejido pulmonar; en caso de observar sangrado al retirar la pinza, se debe dejar acuñado el broncoscopio en el sitio de la biopsia, realizando succión continua por unos minutos, buscando colapsar las paredes del bronquio (maniobra de Zabala) o instilar 2-4cc de xilocaína con epinefrina si no existe contraindicación.
Algunos endoscopistas tienen en cuenta los movimientos de inspiración y espiración durante el paso y apertura de la pinza. Si se realiza bajo visión fluoroscópica, el procedimiento es el mismo, con la ventaja que puede visualizarse la apertura y el cierre de la pinza.
Complicaciones y selección de pacientes para biopsia transbronquial
Una buena selección del paciente disminuye el riesgo de complicaciones, dentro de las cuales se destacan las denominadas generales, como laringoespasmo, broncoespasmo, hipoxemia, bacteremia y fiebre, y las inherentes al procedimiento, que son básicamente el neumotórax, el cual se presenta en menos del 3% de los casos, y el sangrado, presente también en el 3%, con pequeñas a moderadas cantidades (menores de 100 ml).
Estas cantidades son más comunes que sangrados que amenazan la vida, los cuales son el resultado de biopsias accidentales de arterias bronquiales o pulmonares de considerable tamaño. La muerte se ha informado en el 0.03% de los casos. Los trastornos de la coagulación, la hipertensión pulmonar y la ventilación mecánica, aumentan el riesgo de sangrado; el neumotórax se ve también favorecido en casos de ventilación mecánica4
Con el procedimiento se obtienen fragmentos de tejido pulmonar que varían entre 0.1 y 0.3cm. de acuerdo al tamaño de la pinza.
Diagnóstico apropiado
Un buen rendimiento diagnóstico requiere de un apropiado manejo de la muestra, tanto de parte del broncoscopista como del patólogo . Una vez tomada la muestra, se debe colocar inmediatamente en un fijador o medio de preservación con el fin de evitar el colapso de la misma, utilizando formol bufferizado al 10% para estudio histológico, solución salina para cultivos, o inmunofluorescencia y glutaraldehído para microscopía electrónica5. Los fragmentos deben sumergirse directamente en el medio sin que sea necesario el uso de papel.
Por estudios a nivel mundial, que muestran resultados muy similares a los nuestros6, una muestra es representativa cuando tiene más de 90 alvéolos ño de la pinza, por lo cual se recomienda la toma de 4-6 fragmentos, con lo que se obtiene un rendimiento del 81%, el cual desciende a 36% cuando se toma tan solo un fragmento. Se debe tener en cuenta que el compromiso pulmonar no siempre es uniforme y por lo tanto unos fragmentos pueden mostrar cambios y otros no (Fig 1) .
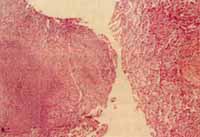
Figura No.1 Biopsia Transbronquial de paciente con TBC Pulmonar. Fragmento de la izquierda muestra cambios específicos de TBC, el de la derecha no muestra cambios.
Otro punto importante en el estudio de la biopsia transbronquial es la presencia de artefactos, que se producen durante la toma y manipulación de la muestra, que consisten principalmente en colapso y hemorragia.
El colapso no permite una buena diferenciación entre el intersticio y el alvéolo, dando una falsa impresión de engrosamiento septal e hipercelularidad del mismo, con un rendimiento diagnóstico del 42% cuando lo presenta y de un 86% cuando no existe (Fig 2).
Dicho colapso se previene mediante la sumersión inmediata del tejido en el fijador o medio, como se mencionó previamente. Cuando se presenta hemorragia es importante descartar trauma con la presencia de hemosiderófagos.
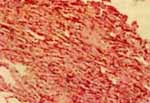
Figura No.2 Biopsia Transbronquial . Colapso total de la muestra.
Indicaciones y limitaciones del método de biopsia transbronquial
La escogencia de la BT como método diagnóstico, ha sido motivo de controversias, sobre todo en el diagnóstico de procesos infiltrativos, difusos o localizados, particularmente al compararla con la biopsia abierta y últimamente con la cirugía torácica videoasistida.
La escogencia de uno u otro método podría depender en la práctica de la experiencia local de cada sitio, de la población de pacientes, de la urgencia de obtener un diagnóstico y de la disponibilidad de los métodos citados.
Así por ejemplo, se sabe que en general, la BT tiene un alto rendimiento en procesos infecciosos agudos como tuberculosis y coccidioidomicosis, siendo de bajo rendimiento en neumonía por citomegalovirus y en aspergilosis invasiva7, (reflejando en esta última probablemente la dificultad de tomar muestras de áreas perivasculares, en forma similar a lo que sucede con las metástasis de diseminación hematógena)
Rendimiento en la neumonía bacteriana
De igual manera, su falta de rendimiento en la neumonía bacteriana, es de todos conocido. En la población de pacientes con SIDA se prefiere la BT o mejor aún, el lavado bronquioloalveolar para el diagnóstico de infecciones, pero en pacientes inmunosuprimidos por malignidades hematológicas o por quimioterapia, quienes tienden a presentar alta incidencia de infecciones virales, aspergilosis invasiva o infiltrados leucémicos, es preferible la biopsia abierta4.
Para el caso de pacientes con VIH el solo LBA tiene, como ya se señaló, un alto rendimiento8 , alcanzando, para el caso del P carini una sensibilidad entre 79 a 98%, recomendándose por algunos autores, que se realice, sin BT, en esta población.
En el caso de tuberculosis y VIH , se recomienda el uso de la BT más lavado bronquial solo en casos en que el esputo expectorado o inducido sean negativos para Bk9. Pitchenik y cols también constataron el alto rendimiento diagnóstico del LBA en la detección del bacilo, aunque consideran que la BT puede ocasionalmente mostrar un granuloma cuando todas las coloraciones para BK han sido negativas10.
El rendimiento de la BT en el inmunosuprimido disminuye a un 60% cuando la sospecha clínica es de patología no infecciosa , existiendo informes de eficiencia diagnóstica de 76% en no inmunosuprimidos11.
La urgencia de obtener un diagnóstico puede también influir en el método a escoger, puesto que será preferible la biopsia abierta a la BT en pacientes que se están deteriorando rápidamente, particularmente en aquellos en quienes hay riesgo de sangrado. Así mismo, en pacientes inmunosuprimidos con fiebre y neumonía, el LBA con o sin BT será el paso inicial, considerándose la biopsia abierta solo si los resultados son negativos.
Aplicaciones diagnósticas en enfermedades pulmonares intersticiales y casos de lesiones periféricas
En cuanto a enfermedades pulmonares intersticiales, (fig.3) la BT es más diagnóstica en patologías que muestran distribución broncovascular, como la sarcoidosis, entidad en la cual la BT muestra un rendimiento diagnóstico que varía de 60% a 97% de acuerdo al número de biopsias y al estado radiológico de la enfermedad.
Lynch y colaboradores señalan un rendimiento que excede el 85% cuando realizan de 4-6 biopsias en el lóbulo superior e igual número en el lóbulo inferior del mismo pulmón, con pinzas cocodrilo y obteniendo buena cantidad de muestra12.
La literatura señala, que además de la sarcoidosis, la BT es capaz de detectar carcinomatosis linfangítica, proteinosis alveolar, sindrome de Goodpasture, granulomatosis de Wegener y granuloma eosinófilo4-13.
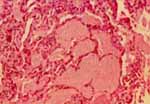
Figura No.3 Biopsia transbronquial de paciente con Proteinosis alveolar. Llenamiento alveolar por material proteináceo.
En casos de lesiones periféricas, el perfeccionamiento de la cirugía torácica videoasistida y/o la biopsia transtorácica bajo TAC, han venido constituyéndose en una buena alternativa para ciertos casos seleccionados14-15.
La tabla Nº 1 muestra, de acuerdo a nuestra experiencia, el grado de rendimiento diagnóstico de la BT. Siempre será necesario el concurso de la clínica y la imagenología, con el fin de complementar datos que pueden en ciertas circunstancias, obviar la biopsia abierta de pulmón; en otras ocasiones, aunque no tenga un buen rendimiento, la BT se realiza rutinariamente como paso previo a la biopsia abierta, con el fin de excluir procesos infecciosos o neoplásticos.
Tabla No 1. Biopsia transbronquial. Rendimiento diagnóstico.
| ALTO | MEDIO | BAJO |
| Tuberculosis Sarcoidosis Carcinomatosis Linfangítica Ca. Bronquialveolar Proteinosis alveolar Silicoantracosis |
Alveolítis alérgica ext. Neumonía Eosinofilica Neumonía I. Linfoide Hemorragia Pulmonar BOOP |
Histiocitosis Lonfangioleiomiomatosis Colagenosis ND UP |
En la Bronquiolitis Obliterante con Neumonía de Organización (BOOP), es importante aclarar que la biopsia transbronquial, cuando es diagnóstica, no especifica la causa, la cual en lo posible debe ser establecida antes de rotular la BOOP como idiopática.
Bibliografia
1. Andersen HA, Fontana RS. Transbronchoscopic lung biopsy for diffuse pulmonary diseases: technique and results in 450 cases. Chest 1972; 62: 125-8
2. Levin DC, Wicks AB, Ellis JH. Transbronchial lung biopsy via the fiberoptic bronchoscope. Am Rev Resp Dis. 1974; 110: 4-12
3. Baena PJ. Enfermedades del tórax. Hospital Santa Clara. Ediciones médicas Zambon. 1992; 125-126
4. Shure D. Transbronchial biopsy and needle aspiration. Chest. 1989; 95 : 1130-38
5. Nobunjico et al. Step section preparation of transbronchial lung biopsy. Chest 1991; 100: 959-62
6. GarridoVG, Hernández FJ, Ojeda LP, Baena PJ. Biopsia transbronquial. Asociación entre características morfológicas y diagnóstico histopatológico. Rev. Colombiana de Neumología, 1998; 10: 22-27.
7. Albelda SM, Talbot GH, Gerson SI, Miller WT, Cassileth pa. Role of fiberoptic bronchoscopy in the diagnosis of invasivepulmonary aspergillosis in patients with acute leukemia. Am J Med 1984; 7
8. Salzman SH. Bronchoscopic techniques for the diagnosis of pulmonary complications of HIV infection. Semin Respir Infect 1999; 14 (4):318-26
9. Raoof S, Rosen MJ, Khan FA. Role of bronchoscopy in AIDS. Clinics in Chest Medicine. 1999; 20: 63-76
10. Pitchenik AE, Fertel D, Bloch A. Mycobacterial desease: Epidemiology, diagnosis, treatment and prevention. Clinics in Chest Medicine. 1988; 9:425-441
11. Feldman NT, Pennington JE, Ehrie G. Transbronchial lung biopsy in the compromised host. JAMA 1977; 238: 13771379
12. Lynch JP, Kazerooni EA, Gay SE. Pulmonary Sarcoidosis. In: OM P Sharma. Clinics in Chest Medicine. 1997; 18: 755-85
13. Jenkins et al. Diagnostic yield of transbronchoscopic biopsies. Am J Clin Pathol 1979; 72: 926-930
14. Ramírez JC, Monroy M. Cirugía torácica videoasistida. Experiencia con 114 casos. Rev Colomb Neumol 1999; 11:153-9
15. Rudd RM, Gellert AR, Boldy DAR, Studdy PR, Pearson MC, Geddes DM, Sinha G. Bronchoscopy and percutaneus aspiration biopsy in the diagnosis of bronchial carcinoma celkl type. Thorax 1982; 37: 462-65