RENATO GUZMÁN*
* Medicina Interna – Reumatología. Jefe de la Sección de Inmunoreumatología, Departamento de Medicina Interna. Clínica Saludcoop 104 Jorge Piñeros Corpas. Bogotá, D.C.
Resumen
La Osteoporosis (OP) es una enfermedad metabólica, caracterizada por disminución de la calidad del hueso, como consecuencia de una alteración en el proceso de la formación y reabsorción óseas. Por su alta prevalencia, por su elevada morbimortalidad, por su marcado impacto negativo sobre la calidad de vida y por sus elevados costos, la OP es considerada un problema de salud pública.
En los procesos metabólicos del hueso intervienen de manera muy importante múltiples factores, por ejemplo: minerales como el calcio, el fósforo y el magnesio; estímulos hormonales diversos, receptores hormonales; proteínas solubles de señales intracelulares; factores de crecimiento; citoquinas y algunas vitaminas, entre muchos otros. Los factores genéticos tienen especial importancia, ya que el pico de masa ósea está genéticamente determinado en un 80%. Estudios recientes sobre inmunología, inmunogenética y biología molecular, han demostrado un papel muy importante de estos factores en el metabolismo óseo y han permitido un mejor conocimiento de la etiopatogenia de la OP.
Palabras clave: osteoporosis, factores Inmunológicos, factores genéticos, factores celulares, minerales y vitaminas.
Abstract
Osteoporosis (OP) is a metabolic disorder characterized by a decrease in bone quality and resistance, mainly due to disturbances in the intimate mechanisms of bone formation and resorption. Due to its high prevalence, morbimortality, high negative impact on quality of life and high costs, OP is considered a public health problem.
The mechanisms of bone metabolism are regulated by numerous determining factors such as minerals, like calcium, phosphorus and magnesium, hormonal stimuli, hormone receptors, cells and cell products, enzymes, growth factors, prostaglandins, some vitamins and cytokins, among others. Genetic factors are also of great importance, since bone-mass peak is 80% genetically determined. Recent immunology, immunogenetic and molecular biology studies have pemitted a much better understanding of the ethiopathogenesis of bone metabolism and OP.
Key words: Osteoporosis, immunology factors, genetic factors, cell factors, cytokins, prostaglandins, minerals and vitamins.
Introducción
En los últimos años un número creciente de profesionales de la salud se han dedicado al estudio y seguimiento de la OP, enfermedad que genera grandes consecuencias en la Salud Pública. La Osteoporosis (OP), discutida como un síndrome de daño o alteración, es una enfermedad caracterizada por producción de hueso de mala calidad, cuantitativamente deficiente y frágil, la cual genera fracturas e incrementa en forma considerable la morbimortalidad;
la OP, reconocida probablemente desde la edad de bronce1-4, se considera ahora una enfermedad en la que participan múltiples factores: elementos minerales esenciales para el esqueleto, (calcio, fósforo y magnesio), estímulos hormonales, células, productos celulares, enzimas, receptores hormonales, proteínas solubles de señales intracelulares, factores de crecimiento y citoquinas, entre otros5,6. El proceso del remodelado óseo se pierde por aumento en la actividad resortiva de los osteoclastos o por disminución en la actividad formadora por los osteoblatos, lo cual en últimas, conlleva a la OP7-9. Esto permitió a Melton y Riggs hacer la ya clásica y conocida clasificación de la Osteoporosis Involucional en tipo 1 y tipo II10,11.
Aspecto genético
Existe suficiente evidencia, desde los trabajos iniciales de Morinson en 1994, acerca del papel protagónico que juegan los aspectos genéticos en la génesis de la OP e incluso hay quienes consideran que es una enfermedad genética. El concepto de pico de masa ósea refuerza lo anterior ya que el 80% de éste está genéticamente determinado y realmente sólo podemos actuar sobre un 20% para modificar el estilo de vida y para lograr efectos tanto profilácticos como terapéuticos. Los últimos avances en inmunología, inmunogenética y biología molecular han permitido conocer más a fondo la etiopatogenia de la OP y vislumbrar un futuro más promisorio en lo referente al tratamiento. Desde los trabajos de Prockop, quien planteó la OP como una enfermedad genética, hasta los últimos publicados recientemente, se identifican múltiples genes potenciales, como los del Colágeno tipo I, los del receptor de la vitamina D3 y su polimorfismo, así como el polimorfismo del gen para el receptor estrógenico y otros, cuyas mutaciones influyen directamente en la génesis de la OP12-16. Recientemente, la identificación de mutaciones en la LRP-5 y el fenotipo del torus palatinus han reforzado estos conceptos.
Con el reciente descubrimiento de la secuencia total de aminoácidos del genoma humano, se esperan grandes avances en su comprensión.
Aspectos nutricionales
Nutrición y hueso / Aspectos moleculares de las vitaminas
Los aspectos nutricionales en la salud ósea están bien establecidos. El papel del calcio como elemento esencial en el desarrollo, crecimiento, mineralización y mantenimiento esquelético, se ha afianzado a través de los años17-20. Recientemente se han descubierto nuevas acciones de las vitaminas, especialmente de la vitamina D, recalcándose que trabajan a nivel óseo en sus células, con acciones directas o indirectas sobre éstas produciendo cambios con repercusiones clínicas evidentes y, la identificación de receptores para ella en el músculo estriado abre compuertas excitantes en terapéutica y amplía las estrategias para la prevención de caídas, especialmente en los ancianos 21-23. A la vitamina D se le conoce como substancia hormonal más que como vitamina, con acciones inmunomoduladoras, las cuales actúan directamente sobre el osteoblasto con estímulo anábolico sobre este, con acciones a nivel de la CFU-F (Unidad formadora de colonias del fibroblasto) estimulando las células mesenquimales para producir osteoblastos, e igualmente con acciones en la pro-mineralización ósea, mediadas por efecto en prostaglandinas.
La vitamina D tiene también un efecto potente inhibidor de la resorción ósea in vivo, diferente a las acciones opuestas in vitro. Depleta la producción de precursores del osteoclasto a nivel medular. In vitro se ha descrito estimulación de la resorción ósea a través del osteoclasto por estimulación primaria en los osteoblastos y en la producción del OCIF (Factor inhibidor de osteoclastogénesis, hoy considerado como la misma Osteoprotegerina)24-27. Las acciones de la vitamina D a nivel inmunológico son múltiples. Es conocida su labor en la presentación antigénica a través del macrófago, así como sus acciones antiproliferativas sobre los ciclos celulares y la detección de receptores para ésta en la fibra muscular estriada, lo cual ha permitido conocer nuevas bondades en el tratamiento de la psoriasis; y como agente antineoplásico en la mejoría del tono muscular, lo cual previene la fractura de cadera al disminuir el riesgo de caídas28-36.
En el Japón se ha trabajado mucho en la relación entre la vitamina K y el hueso, generando grandes expectativas en la comunidad médica en general. La vitamina K, sus isoformas, K1 y K3, filoquinona y menatenetrona, actúan también estimulando el osteoblasto e inhibiendo al osteoclasto, con acciones mediadas por prostaglandinas in situ y con repercusiones en la mineralización. Hay estudios que correlacionan niveles bajos de vitamina K en la sangre y aumento de incidencia en fracturas de cadera37,38.
Desde hace años, también se conoce una relación directa de hipervitaminosis A y sintomatología articular. Estudios recientes corroboran que sus altos niveles séricos predisponen a riesgo de fractura probablemente por una acción estimuladora en los osteoclastos e inhibitoria en osteoblasto. Las cifras séricas de retinol de 86 mcg serían el umbral para el efecto nocivo sobre el tejido39-41. La importancia de estos hallazgos se relacionan, concepto que se trabaja con la fortificación de los alimentos con vitamina A. Se sabe que en las etapas tempranas de la vida ésta vitamina es fundamental para el desarrollo y bienestar del nervio óptico, pero en etapas tardías prevalecen los efectos deletéreos sobre el hueso, al disminuir especialmente su diámetro42-44. El papel de las vitaminas y el tejido óseo se resume en la Tabla 1. Algunos han considerado que el efecto nocivo de la vitamina
A en el hueso obedece a su acción inhibitoria sobre el papel de la vitamina D en la absorción intestinal del calcio, pero esto no se ha demostrado claramente45-47.
Aspectos inmunológicos
En la OP participan factores celulares con acciones benéficas en el hueso y otros con acciones nocivas. De acuerdo con las características propias de los pacientes se determina hacia que lado se desplazaría la balanza y sí se generaría la enfermedad. Las prostaglandinas, derivadas del ácido araquidónico juegan un papel importante en el hueso con un efecto dual: a bajas dosis son anábolicas y a altas dosis tienen propiedades resortivas. La E2, es la más importante y sus cifras elevadas in situ median la actividad resortiva en sitios muy localizadoscomo ocurre en enfermedades inflamatorias articulares como la artritis reumatoide (AR) y lapresencia de osteopenia yuxta-articular, igualmente actúa en las señales intracelulares paraestimular el osteoclasto a través del osteoblasto.
Su acción celular es muy similar a la Pth y a la 1.25 (oh) 2D3 y se concentra especialmente en el osteoblasto. La Interleukina-1 y el TNF-alfa estimulan su producción48-51. Esta prostaglandina juega igualmente un papel fundamental en la osteopenia encontrada en los casos de síndromes dolorosos complejos regionales52-56.
Recientemente se ha revisado el papel del mastocito y se clarifica un poco el papel de las prostaglandinas en éstas enfermedades57,58.
Factores de crecimiento
Referente a los factores de crecimiento, podemos dividirlos en dos grupos de acuerdo al sitio de acción: los de acción local y los de acción sistémica. Los primeros, de acción local, son producidos por los osteoblastos e incluyen el SEF (factor de crecimiento esquelético), el cual aumenta la producción y síntesis de colágeno; el BDGF (factor de crecimiento derivado del hueso), el cual actúa como la somatomedina estimulando la producción de matriz ósea; el BMP (proteina morfogenetica básica), el cual forma cartílago y hueso de células mesenquimales, muy importantes en los efectos reparativos de hueso, especialmente en fracturas y la cual se ve afectada por el uso de glucocorticoides y efectos inhibitorios en las IGF-1-3. Todos estos factores son polipéptidos secretados por células que tienen una acción tisular de manera autocrina y paracrina. Últimamente, se ha destacado el papel de la BMP en el uso crónico de glucocorticoides por su acción inhibitora generando la OIG.
De los factores de acción sistémica hay unos con franca actividad estimuladora del osteoclasto, entre los cuales destacamos el PDGF (factor de crecimiento derivado de plaquetas) producido por los gránulos alfa de las plaquetas, por macrófagos y células endoteliales. Este actúa estimulando la proliferación de osteoblastos y favoreciendo la resorción ósea a través de la PGEZ; el FGF, EGF, el TGF alfa, los cuales actúan a través de la PGE2 y aceleran fenómenos de angiogénesis. El TGF alfa es importante porque se asocia a enfermedades inflamatorias sistémicas como el LES, la AR, y las enfermedades inflamatorias intestinales, entre otras. Actúa de manera muy similar a la Il-1 y a la PTH, y es un potente estimulador de los osteoclastos. Por otro lado, existen antagonistas naturales a nivel óseo como los IGF 1-3, (actúan en la angiogénesis y en la síntesis de colágeno mediado por el osteoblasto), el GM-CSF, el MM-CSF y el TGFbeta, los cuales han generado interés como armas terapéuticas. Este último favorece la diferenciación del pre-osteoblasto al osteoblasto maduro. Otros factores que se han discutido incluyen la Lipocortina II, el LIF, y el gama Interferon que podrían tener un efecto estimulante y de diferenciación en el osteoblasto, inhibe la síntesis de PGE2, actúa como inmunomodulador, bloquea la producción de células gigantes tipo osteoclasto-like inducidas por la PTH y la IL-159-62. El conocimiento de las acciones de los factores de crecimiento y su participación en enfermedades metabólicas óseas es cada día mayor, como recientemente se discute con el FGF 23 (factor de crecimiento del fibroblasto) y la presencia de osteomalacia osteogénica63,64.
El concepto de citoquinas y hueso es fascinante. Se plantea que un imbalance de estas lleva a la enfermedad. Algunas estimulan la osteoclastogénesis directamente como la IL-1, la IL-6 y la IL-11 y otras tienden a contrarrestar este efecto, como la IL-4 y el IL.1 Rs. La IL-1 es muy importante en la génesis de la OP;[se le conoció en sus inicios como OAF (factor activador del osteoclasto)], aumenta su número, tiene acción similar a la PTH en el hueso, disminuye la síntesis de colágeno y estimula la producción de la PGE2, mediando su actividad resortiva. Mención especial merece el concepto reciente de un miembro de la superfamilia del receptor del TNF alfa, el RANK y el RANK-ligando (activador del receptor del factor nuclear kB), básico en la maduración, diferenciación y activación de los osteoclastos y la osteoprotegerina (OCIF) (la cual actúa como un decodificador que regula la activación de señales intracelulares para su accionar) y los efectos de los glucocorticoides sobre estos y la inhibición de la apoptosis del osteoclasto por freno de estos mecanismos65,66. (Gráfica 1). El RANK participa activamente en los estadíos iniciales y de activación y diferenciación del osteoclasto y ya se conoce una relación directa entre sus acciones exageradas y las enfermedades metabólicas óseas como la osteoporosis, la enfermedad de Paget juvenil, la hiperfosfatasia familiar y la osteolisis expansiva, entre otras. (Gráfica 2). Esto convierte a la osteoprotegerina en un blanco terapéutico ideal para el manejo de esta enfermedad, como también se vislumbra su actividad terapéutica en enfermedades inflamatorias autoinmunes articulares como en la AR, en la cual existe una relación directa entre pannus, cartílago y hueso67-70. Se piensa que los glucocorticoides ejercen un efecto inhibitorio sobre el osteoblasto, determinando su síntesis y maduración al afectar la producción de BMP y de IGF 1-3; inhibe la síntesis de la matriz osteoblástica, favorece la apoptosis de ésta célula y modula expresión de genes. Las BMP conectan esta acción celular con fenómenos de osteoclastogénesis a través de Cbfa1/Osf 2, un factor de transcripción osteoblástica y la cascada del RANK ligando. Recordamos que los osteoclastos derivan de la línea hemopoyética y los blastos de la mesenquimal, interacción clave para el futuro de la homeóstasis en el hueso. Las CFU juegan un papel de regulador del remodelado óseo y su accionar de manera armónica y coordinada garantizan la homeóstasis del hueso.
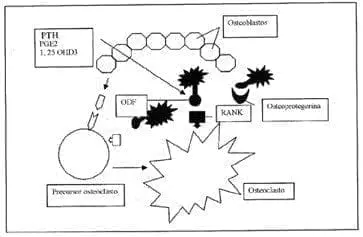 Gráfica 1. Osteoclastos: activación y diferenciación
Gráfica 1. Osteoclastos: activación y diferenciación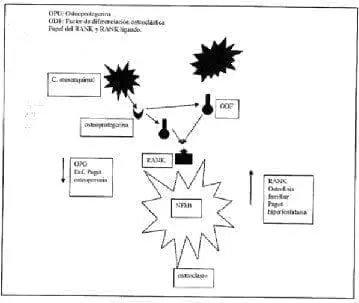 Gráfica 2. Osteopatías: vías intracelulares
Gráfica 2. Osteopatías: vías intracelularesLa relación menopausia, hipoestrogenismo y expresión exagerada de la IL-6 explican la génesis de la OP tipo 1; el envejecimiento disminuye las células precursoras del osteoblasto y se presenta la osteoporosis tipo 2. Por eso se cree que un cambio en el número de células óseas es más importante que el grado de actividad de éstas y probablemente sea la base patogénetica de la enfermedad.
Las modificaciones de la nutrición y el ejercicio adecuado en el estilo de vida de los pacientes son importantes y se resalta el beneficio en la niñez. Los estudios de Sainz sobre el receptor de la vitamina D son muy intrigantes y plantean que la absorción del calcio se determina genéticamente de acuerdo al genotipo del receptor de la vitamina D, similar a lo hablado en los estudios de Tatcher en osteomalacia referente al genotipo y el desarrollo ulterior de la enfermedad. Reiteramos el concepto reciente de que el status de la vitamina D es fundamental para la estabilidad, para la marcha, para el balanceo corporal y para evitar las caídas, disminuyendo el riesgo de fracturas no vertebrales. La probable relación de elevados niveles de calcio y fósforo sérico con suplementos de vitamina D en pacientes renales y enfermedad coronaria es un temor bien difundido y se ha tratado en los últimos años de evitarlo utilizando análogos de vitamina D como el paricalcitol, el cual induce menos hipercalcemia, con resultados halagadores.
Recientemente, Boyden describe otro posible gen para la OP. Se habla del receptor LDLr proteína 5 y sus mutaciones en la génesis de la enfermedad mediados por proteínas intracelulares de señales óseas como la wnt/dkk. Igualmente cada día se reconocen nuevos factores que contribuyen desde el punto de vista genético a la génesis de la OP así como de otras enfermedades metabólicas óseas. Entre esos nuevos destacamos las proteínas reguladoras transportadoras del sodio a nivel tubular renal y una vez más, la osteoprotegerina y su papel modulador en la acción de activación de osteoclastos. El uso de los bisfosfonatos se ha posicionado como terapia de primera línea en los últimos años para la OP, independiente de la edad de los pacientes, pero se han registrado algunos efectos serios en los niños, con desarrollo de osteopetrosis, y en adultos, de acuerdo con las condiciones basales de vitamina D, crisis hipocalcémicas severas. De los últimos años se conocen estudios y avances sobre las hormonas y su mecanismo de acción sobre el hueso a través de receptores celulares en osteoblasto y elementos de respuesta estrogénica con elementos estimuladores y corepresores. Al igual que la acción de los SERMs y su acción agonista en tejidos específicos, recordando al clomifeno el cual se ha utilizado por muchos años como inductor de ovulación y conociendo que inhibe la resorción ósea in vitro y protege contra la osteoporosis en ratas ovariectomizadas, y el posterior advenimiento de otros SERMs, entre los cuales se tiene mayor experiencia con el raloxifene y sus acciones sobre el tejido óseo y más recientemente acciones de mecanismo específico como los ANGELs (activadores no genotrópicos estogenos-like signaling). El conocimiento de hace pocos años referente a la terapia hormonal y sus beneficios en la salud de la mujer han cambiado mucho según estudios recientes, así por ejemplo las complicaciones cardiovasculares precluyen su uso rutinario en las mujeres postmenopáusicas, donde se considera que sólo tratan síntomas y afectan seriamente su calidad de vida. El efecto de los estrógenos a nivel óseo es muy bien conocido.
TABLA 1. VITAMINAS Y HUESO
| Vitamina | Acción celular | Mecanismo |
| D | Osteoblasto.(anabólico);CFU. Osteoclasto. (in vivo) |
Prostaglandinas.(mineralización). Inhibe precursores |
| K | Osteoblasto (estimula) Osteoclasto (frena) |
Prostagalandinas. Mineralización.(Fxt) |
| A | Osteoblasto Osteoclasto |
Inhibitoria Lo aumenta. (Fxt) |
Las mutaciones del gen de la aromatasa los cuales producen una ganancia en su función, así lo demuestran, pero no son suficiente argumento para utilizarlos hoy en día en pacientes con OP porque existen otras alternativas terapéuticas más eficaces y con menores riesgos, como los bisfosfonatos. Sin embargo, aún no se ha dicho la última palabra al respecto y existen poblaciones y etapas de la vida que probablemente se beneficien de la terapia como se discute en trabajos recientes, donde se exploran los efectos de la TRH en la progresión de la ateroesclerosis coronaria y se demuestra que los vasos coronarios se dilatan por acción de los estrógenos si son sanos y jóvenes. Es probable que genéticamente se identifique cuáles pacientes podrían beneficiarse de la TRH.
La ambigüedad existente en las acciones de las hormonas y en el sistema cardiovascular derivan de los aspectos contradictorios generados por un lado, con la disminución de las LDL, aumento de las HDL, mejoría en la función endotelial y, por el otro, el aumento, a pesar de lo anterior, de eventos trombóticos vasculares, probablemente por sus acciones a nivel de factores de coagulación y de fibrinolisis. Definitivamente nunca se conoce de un tema tanto como se quisiera y esto aplica indiscutiblemente a la TRH y a sus efectos a nivel cardiovascular. El otro asunto en el que se trabaja mucho es en la evaluación del tejido óseo y el riesgo de fractura, ya que sabemos que la DMO dista de ser un método perfecto para tal evaluación. El concepto de calidad ósea se viene trabajando y se quieren diseñar nuevos índices de resistencia que evalúen la aposición perióstica para predecir más expresamente el riesgo de fractura, lo cual se ha evaluado ya en mujeres postmenopáusicas y pretende valorarse en el tejido óseo de manera tridimensional. Es muy probable que los avances en las ciencias básicas a nivel celular, a nivel bioquímico, a nivel genético, a nivel inmunológico permitan entender un poco mejor la fisiopatología de la OP y tengan gran importancia clínica y terapéutica.
Es un buen momento para recordar la importancia de los aspectos básicos a nivel celular y su entorno que nos actualizan en el estado del arte de la OP. Considero que mucho está aún por escribirse referente a esta patología. Pero en nuestro medio el hecho de pensar en ella, de difundirla como enfermedad en la población general para su conocimiento y entre los colegas, recordándoles que es una entidad que nos involucra a todos como médicos, sin excepción, de identificarla precozmente, prevenirla en cierto modo y utilizar racionalmente los medios diagnósticos y los terapéuticos con los que contamos, de hecho, son un gran logro ya que trabajamos directamente en la prevención de uno de sus principales factores de morbimortalidad de los pacientes: las fracturas. No me cabe la menor duda de que las investigaciones por esta vía se encuentran en el sendero correcto y de que la luz que arrojen estas investigaciones vislumbrarán un mejor mañana para nuestros sufridos pacientes, por lo que estaremos expectantes en primera fila para decantar estos conocimientos. Hoy contamos con tratamientos eficaces para la OP, pero aún distamos mucho de considerar que la batalla se ha ganado. Debemos continuar trabajando en el campo inmunológico pero sin olvidar que los verdaderos protagonistas de nuestra razón de ser siguen siendo nuestros pacientes.
Referencias
1. Frigo P, Lang C. Osteoporosis in a women of the early Bronze age. N Engl J Med 1995;333:1468.
2. Melton LJ.III. Evidence base for the physician,s guide to prevention and treatment of Osteoporosis. In National OSTEOPOROSIS Foundation. Clinical Symposium for physicians.2000;3-6.
3. Guzmán RA. Osteoporosis: Impacto de una antiquísima enfermedad. Rev Col Reumatol 2000; 7:177-80.
4. Menkes CJ. Metabolic bone disease. Curr Opin Rheumatol 1999; 11:293-94.
5. Guzmán RA. Osteoporosis Secundaria. Boletin Sociedad Peruana de Climaterio. Agosto 2003;1-4.
6. Morrison NA, Qi JC, Tokita A, et al. Prediction of bone density from vitamin D receptor alleles. Nature 1|994;367:284-87.
7. Prockop DJ. Mutation in collagen genes as a cause of connective-tissue diseases. N Engl J Med 1992;326:540-46.
8. Parfitt AM. Targeted and nontargeted bone remodeling: Relationship to basic multicellular unit origination and progression. Bone 2002;30: 5-7.
9. Ferrari S, Rizzoli R, Bonjour JPh. Genetic aspect of Osteoporosis. Curr Opin Rheumatol 1999;11:294-300.
10. Francis RM. Calcium and Vitamin D in Osteoporosis. Calcif Tissue Int 2002; 70:69-70.
11. Reginster JY, Zegel B, Leyune E, et al. Influence of daily regimen with calcium and vitamin D supplementation on parathyroid hormone secretion. Calcif Tissue Int 2002;70:78-82.
12. Jansen H. CJP, Samnson MM, Ver Haar HJJ. Vitamin D deficiency, muscle
13. Dhesi JK, Moniz C, Close JCT, et al. A rationale for Vitamin D prescribing in a falls clinic population. Age Ageing 2002;31:267-71.
14. Pfeifer M, Begerow B, Minne HW. Vitamin D and muscle function. Osteoporosis Int 2002; 13: 187-94.
15. Burckardt P. Calcium and vitamin D in Osteoporosis: Supplementation or treatment. Calcif Tissue Int 2002; 70: 74-77.
16. Utiger RD. The need for more Vitamin D. N Engl J Med 1998; 338: 828-29.
17. Willet WC, Stampfer MJ. What vitamins should I be taking, Doctor?. N Engl J Med 2001; 345: 1819-24.
18. Pfeifer M, Begerow B, Minne HW, et al. Vitamin D status, trunk muscle strength, body sway, falls, and fractures among 237 postmenopausal women with osteoporosis. Exp Clin Endocrinol Diabetes 2001; 109: 87-92.
19. Bischoff HA, Stahelin HB, Dick W, et al. Effects of vitamin D and calcium supplementation on falls: a randomized controlled trial. J Bone Miner Res 2003; 18: 342-51.
20. Shiraki M, Shiraki Y, Aoki Ch, et al. Vitamin K2 effectively prevents fractures and sustains lumbar bone mineral density in Osteoporosis. J Bone Miner Res 2000; 15: 515-21.
21. Booth SL, Tucker KL, Chen H, et al. Dietary vitamin K intake are associated with hip fracture but not with bone mineral density in elderly men and women. Am J Clin Nutr 2000; 71: 1201-8.
22. Promislow JHE, Goodman-Gruen D, Slymen DJ, et al. Retinol intake and bone mineral density in the elderly: The Rancho Bernardo study. J Bone Miner Res 2002; 17:1349-58.
23. Lips P. Hypervitaminosis A and fractures. N Engl J Med 2003; 348:347-49.
24. Boocher BJ. Serum retinal levels and fracture risk. N Engl J Med 2003;348:1927. (letter).
25. Johansson S, Melhus H. Vitamin A antagonizes calcium response to vitamin D in man. J Bone Miner Res 2001;16:1899-905.
26. Waltrous DA, Andrews BS. The metabolism and immunology of bone. Seminars Arthritis Rheum 1989; 19:45-65.
27. Guzmán M.RA. Distrofia simpática Refleja. Importancia de su reconocimiento. Rev Col Reumatol 1998;5:27-39.
28. Guzmán M.RA. Síndrome Doloroso Complejo Regional. Distrofia Simpática refleja. Rev Col Reumatol 2000;7:164-69.
29. Kemler MA., Barendse GAM., Van Kleef M., et al. Spinal cord stimulation in patients with chronic Reflex sympapthetic dystrophy. N Engl J Med 2000;343:618-24.
30. Woolley DE. The mast cell in inflammatory artritis. N Engl J Med 2003;348:1709-11.
31. Guzmán RA. Osteoporosis tipo 1. Fisiopatología, aspectos inmunológicos, factores de crecimiento. Rev Col Reumatol 1994; 1: 85-90.
32. Fitzpatrick L. Metabolic bone diseases. Curr Opin Rheumatol 2001; 13:315-16.
33. Jonsson KB, Zahradnick R, Larson T, et al. FGF 23 in oncogenic osteomalacia and xlinked hyphophosphatemia. N Engl J Med 2003;348:1656-63.
34. Clowies JA, Peel N, Eastell R. Glucocorticoid-induced Osteoporosis. Curr Opin Rheumatol 2001; 13: 326-32.
35. Choy EHS, Panayi GS. Cytokine pathways and joint inflammation in rheumatoid artritis.N Engl J Med 2001;344:907-16.
36. Goldring SR, Gravallese E. Pathogenesis of bone erosion in rheumatoid arthritis. Curr Opin Rheumatol 2000;12:195-99.
37. Gravallese EM, Manning C, Tsay A., et al. Synovial tissue in rheumatoid arthritis is a source of osteoprotegerin. Arthritis Rheum 2000;43:250-58.
38. Guzmán M.RA. Bases inmunológicas de la terapia biológica. Rev Col Reumatol 2003;10:119-34.
39. Patschan D, Loddenkemper K, Buttgereit F. Molecular mechanism of glucocorticoidinduced osteoporosis. Bone 2001,29: 498-505.
40. Dawson-Hughes B. Bone loss accompanying medical therapies. N Engl J Med 2001; 345: 989-91.
41. Prockop DJ. The genetic trail of Osteoporosis.
N Engl J Med 1998; 338:1061-62.
42. Thacher TD, Fischer PR, Pettifor JM, et al. A comparison of calcium, Vitamin D, or both for nutritional rickets in Nigerian children. N Engl J Med 1999; 341:563-68.
43. Bishop N. Rickets today. Children still need milk and sunshine. N Engl J Med 1999; 341: 602-05.
44. Leshe WD, Roe EB. Preventing falls in elderly people. N Engl J Med 2003; 348:1816-17.(letter).
45. Teng M, Wolf M, Laurie E, et al. Survival of patients undergoing hemodyalisis with paricalcitol or calcitriol therapy. N Engl J Med 2003;349:446-56.
46. Drueket TB, McCarron DA. Pericalcitol as compared with calcitrion in patients undergoing hemodyalisis. N Engl J Med 2003;349:496-99.
47. Boyden LM, Mao J., Belsky J, et al. High bone density due to a mutation in LDLreceptor-related protein 5. N Engl J Med 2002;346:1513-21.
48. Prie D, Huart V, Bakouh N, et al. Nephrolithiasis and osteoporosis associated with hypophosphatemia caused by mutations in the type 2a sodium-phosphate cotransporter. N Engl J Med 2002; 347: 983-91.
49. Kronenberg HM. NPT2a. The key to phosphate homeostasis. N Engl J Med 2002; 347: 1022-24.
50. Whyte MP, Obrecht SE, Finnegan PM., et al. Osteoprotegerin deficiency and juvenile Paget,s Disease. N Engl J Med 2002; 347: 175-84.
51. Krane SM. Genetic control of bone remodeling. Insight from a rare disease. N Engl J Med 2002; 347: 210-12.
52. Whyte MP, Wenkest D, Clements KL, et al. Bisphosphonates-induced osteopetrosis. N Engl J Med 2003;349: 457-63.
53. Marini JC. Do bisphosphonates makes children´s bone better or brittles. N Engl J Med 2003;349:423-26.
54. Rosen CJ. Severe hypocalcemia after intravenous bisphosphonates therapy in occult vitamin D deficiency. N Engl J Med 2003;348:1503-04.
55. Solomon CG, Dluhy RG. Rethinking postmenopausal hormone therapy. N Engl J Med 2003; 348: 579-81.
56. Grodstein F, Clarkson TB, Manson JE. Understanding the divergent data on postmenopausal hormone therapy. N Engl J Med 2003;348: 645-51.
57. Riggs BL, Hartmann LC. Selective estrogen-receptor modulators. Mechanism of action and application to clinical practice. N Engl J Med 2003; 348: 618-29.
58. Barham M. Selective Estrogens Receptor Modulator: N Engl J Med 2003;348:2259. (letter).
59. Riggs BL, Hartmann LC. Selective Estrogens Receptor Modulator. N Engl J Med 2003;348:2259. (letter).
60. Grady D, Herrington D, Bittner V, et al. Cardiovascular disease outcomes during
6.8 years of hormone therapy. (HERS II). JAMA 2002;288:49-57.
61. Herrington DM, Reboussin DM, Brosnihan B, et al. Effects of estrogen replacement on the progression of coronary/artery atheroesclerosis. N Engl J Med 2000;343:522-29.
62. Rossouw JE, Anderson GL, Prentice RG, et al. Risk and benefits of estrogen plus progestin in healthty postmenopausal women: principal results from the Women, Health Initiative randomized controlled trial. JAMA 2002;288:321-3.
63. Hays J, Ockene JK, Brunner RL, et al. Effects of estrogen plus progestin on health related quality of life. N Engl J Med 2003;348:1839-54.
64. Grady D. Postmenopausal Hormones: Therapy for symptoms only. N Engl J Med 2003;348:1835-37.
65. Shuzu M, Sebastian S, Takayama K, et al. Estrogen excess associated with novel gain of function mutation affecting the aromatase gen. N Engl J Med 2003; 348:1855-65.
66. Manson JE, Asia J, Johnson KC, et al. Estrogen plus progestin and the risk of coronary hearth diseases. N Engl J Med 2003;349:522-34.
67. Herrington DM, Howard ID. From presumed benefit to potential harms. Hormone therapy and hearth diseases. N Engl J Med 2003;349:519-22.
68. Bailor J. Hormone therapy replacement and cardiovascular diseases. N Engl J Med 2003;349:521-22.
69. Alhburg HG, Johnell O, Turnes CH, et al. Bone loss and bone size after menopause. N Engl J Med 2003;349:327-34.
70. Seeman E. Periosteal bone formation. A neglected determinat of bone strength. N Engl J Med 2003;349:320-23.


