La adiponectina: ¿Qué es?
Posee una extensión de 17Kb, compuesta de 3 exones y 7 intrones. Formada por 4 dominios: secuencia señal terminal, región variable, dominio tipo colágeno(cAd) y dominio globular carboxilo terminal (gAd)18. (figura 2).
Es producida por el gen apMI con un estructura muy similar al colágeno VIII y X precerebilina, factor de necrosis tumoral alfa (TNFa) y al factor de complemento Clq19. Una vez sintetizada la adiponectina se evidencia una serie de hidroxilaciones y glicosilaciones en el dominio tipo colágeno produciendo 8 isoformas.
La estructura básica de la adiponectina forma trímeros reflejando su homología con las isoformas del colágeno y al tener relación con miembros del grupo complemento C1q forma homomultimeros.
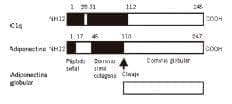 Figura 2. Estructura y dominios de la adiponectina.
Figura 2. Estructura y dominios de la adiponectina.
Por técnicas especiales de laboratorio se logra separar tres especies de adiponectina de acuerdo a su peso molecular (PM).
Se presenta en formas de multímeros como trímeros de 67 kDa, denominada LMW (Low Molecular Weight); hexámeros 136 Kda, denominada MMW (Middle Molecular Weight), y dodecámeros de 300 kDa, denominada HMW (High Molecular Weight). Esta última es la forma más activa y con efectos positivos sobre la sensibilidad a la insulina20 (figura 3).
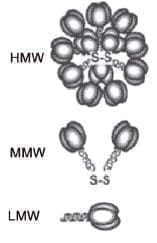 Figura 3. Diferentes tipos de adiponectina. Alto, medio y bajo peso molecular.
Figura 3. Diferentes tipos de adiponectina. Alto, medio y bajo peso molecular.
Niveles
La adiponectina es secretada exclusivamente por los adipocitos19, presenta niveles pulsátiles con un ritmo circadiano de variaciones diurnas, disminuye en la noche y tiene un pico a la madrugada.
Este ritmo circadiano es muy parecido al del cortisol y al de la leptina, postulándose que podría haber un mecanismo de retroalimentación entre estas dos hormonas21.
La secreción de adiponectina se encuentra modulada por diferentes factores como:
1) Insulina: existe evidencia de que disminuye la secreción tanto en humanos como en ratones22.
2) Factor similar a la insulina tipo I (IGF1): aumenta su transcripción y se disminuye con el tratamiento con factor de necrosis tumoral alfa (FNTá), glucocorticoides, agonistas â adrenérgicos y dibutirik-c-AMP.
3) Prolactina y hormona de crecimiento: disminuye los niveles de adiponectina en cultivos celulares con la administración de prolactina21.a, 22,23.
4) Hormonas esteroideas: experimentalmente en ratones hembras ovariectomizadas no se modifican los niveles de adiponectina, mientras en ratones machos castrados se eleva y al administrar testosterona los niveles bajan mejorando la sensibilidad a la insulina24.
Los niveles de adiponectina son diferentes en hombres y mujeres.
La adiponectina circula en el torrente circulatorio entre 5 y 30 μg/ml, que representan el 0,01% de las proteínas plasmática.
Los valores normales de adiponectina sérica se iniciaron con estudios cromatográficos, posteriormente se desarrolla el radioinmunoanálisis y en el 2006 se mejora la técnica ELISA estandarizando los niveles de la adiponectina de alto peso molecular25.
Estos varían según el grupo de edad y sexo, oscilando entre 2 y 24 μg/ ml; excepto niños menores de 3 años con un intervalo de 6 y 40 μg/ml, su concentración es inversamente proporcional al índice de masa corporal (tabla 3).
Se han utilizado diferentes métodos para evaluar los niveles sanguíneos, inicialmente cromatográficos (SDS-PAGE), radioinmunoanálisis (RIA), inmunoensayos (ELISA) y recientemente utilizando la afinidad de los anticuerpos por enzimo-inmunoanálisis (EIA), que sigue siendo la más aceptada25

Receptores
Dos tipos de receptores de la adiponectina han sido identificados de acuerdo a la unión de afinidad globular y a la longitud de sus cadenas. AdipoR1 y AdipoR2, que comparten una afinidad de identidad del 96,8% en humanos y 95,2% en ratones.
En humanos como en ratones el AdipoR1 está localizado en el cromosoma 1p36.12-q41 1E4 mientras el AdipoR2 se encuentra en los cromosomas 12p13.31 y 6F1. En su estructura molecular ambos receptores son significativamente homólogos, con un N-terminal interno y un C terminal externo.
Los receptores AdipoR1 y AdipoR2 hacen parte del grupo complemento C1q del receptor de adiponectina Q (PAQR) cuya secuencia contiene una homología con la ceramidasa alcalina26.
Estudios en ratones han confirmado que el AdipoR1 tenía una expresión ubicua con predilección por el hígado, el músculo esquelético, los macrófagos y el hipotálamo, y el AdipoR2 se expresa en el hígado, el tejido adiposo blanco (WAT) y la vasculatura.
Por otra parte, se evidencia que los receptores AdipoR1 y AdipoR2 in vivo median acciones metabólicas de la adiponectina.
Estos efectos han sido confirmados con AdipoR1 y AdipoR2 en ratones doble knock-out que mostraron intolerancia a la glucosa e hiperinsulinemia, demostrando que AdipoR1 y AdipoR2 regulan el metabolismo normal de la glucosa y la sensibilidad a la insulina.
Estos efectos dependen de tejidos específicos como el hígado, donde el AdipoR1 se encuentra involucrado en la activación de AMP quinasa (AMPK), regulando de esta manera la glucosa y el metabolismo lipídico28. Es necesaria la activación de Ca2/CAMKKb y AMP/LKB1 para estimular el AMPK modulado por la adiponectina27.
El AdipoR2 está implicado en la activación del receptor activador de los peroxisomas gama (PPARy), lo que aumenta la sensibilidad a la insulina. Por este mecanismo se aumenta la oxidación de ácidos grasos, y la captación de glucosa por la adiponectina28. La adiponectina ejerce una acción sensibilizadora de la insulina a través del receptor de PPARá.
A su vez, la secreción de adiponectina guarda mayor correlación inversa con el tejido adiposo visceral que con el subcutáneo, al parecer por el efecto inhibidor sobre su secreción del factor de necrosis tumoral (FNTá)29.
La adiponectina a través de AdipoR1 y AdipoR2 disminuye la ceramida, aumenta la esfingosina 1-fosfato (S1P) y por esta vía previene la apoptosis. El efecto de la adiponectina sobre la T-cadherina es crítico en la protección cardiaca en ratones.
Un receptor de adiponectina aún sin identificar, llamado Adipo RX, aumenta IL-6 en los macrófagos a través de la activación del factor de necrosis kappa beta (NF-kappa-â) y el IRS2 en hepatocitos en estado de ayuno30(figura 4).
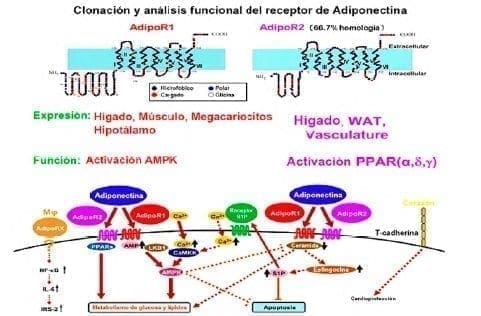 Figura 4. Efectos del receptor de adiponectina.
Figura 4. Efectos del receptor de adiponectina.
Mecanismo de acción
1) La adiponectina aumenta la traducción de señales del receptor de insulina:
Desde el descubrimiento de la adiponectina diferentes investigadores han reportado una correlación negativa entre los niveles de adiponectina y la resistencia a la insulina.
Experimentalmente al administrar adiponectina se encuentra una disminución de la glicemia, aumento de la oxidación de ácidos grasos (AG), pérdida de peso y aumento de la sensibilidad a la insulina31.
Al bloquear el gen de la adiponectina se encuentra resistencia a la insulina (RI), intolerancia a la glucosa, dislipidemia, hipertensión arterial, niveles disminuidos de la proteína transportadora de ácidos grasos, aumento de TNFá; la administración de fragmentos globulares de la adiponectina presenta mejoría de la RI32.
Se sabe que el aumento de los triglicéridos (TG) produce una disminución en la sensibilidad de la insulina y sus señales en el receptor, confirmándose experimentalmente que el contenido aumentado de TG interfiere con la activación de la fosfoinositol-3-quinasa (PI-3K) por la insulina con translocación de GLUT4 en la membrana y captación de glucosa.
A nivel del músculo la adiponectina aumenta la expresión de ácidos grasos (CD36), la oxidación de ácidos grasos (acilcoA oxidasa) y la disipación de la energía a partir de ácidos grasos (Uncoupling protein 2, UP-2).
Por esta vía se presenta un aumento de AG y una disminución de TG que contribuiría a mejorar las señales del receptor de insulina33. En ratones lipodistróficos tratados con adiponectina se observó un aumento de la fosforilación y el sustrato del receptor de insulina-1 (IRS-1).
En estas condiciones, la adiponectina tendría una acción directa sobre la fosforilación del receptor de insulina y sus segundos mensajeros, y una indirecta disminuyendo los TG34.
2) Aumenta la oxidación muscular y hepática de ácidos grasos:
El AdipoR1 estimula la fosforilación y subsecuentemente la activación del AMPK en el músculo esquelético y en el hígado, a diferencia de la adiponectina globular que solo actúa en el músculo esquelético.
Cuando la AMPK es inhibida, la utilización de la glucosa y la combustión de ácidos grasos también se inhiben, evidenciando que la acción de la adiponectina se realiza por activación de AMPK y adicionalmente la oxidación muscular grasa y el transporte de la glucosa se encuentran mediados por la adiponectina globular aumentado la activación de AMPK y la inhibición de la carboxilasaacetil- CoA33.
Estudios en ratones transgénicos ha demostrado que la disminución de enzimas glucogenéticas como la fosfoenopiruvato carboxilasa y la glucosa-6-fosfatasa están disminuidas por acción de la adiponectina por aumento de la fosforilación de la AMPK hepática35.
La deleción del supresor tumoral LKB1 indica que la adiponectina suprime la transcripción hepática del factor SREBP1c (sterolregulatory- element-binding protein) por vía de la síntesis de ácidos grasos (28 ). Por lo tanto, la adiponectina activa el AMPK a nivel hepático inhibiendo la síntesis de glucosa y a nivel muscular aumentando de la captación de glucosa y oxidación de ácidos grasos.
3) Activa PPARa:
El AdipoR2 activa y aumenta la expresión de los ligandos PPARa incrementando la combustión de ácidos grasos y el consumo de energía. Ese efecto se realiza por los elementos de respuesta que posee el proliferador de los peroxisomas (PPRE)36.
No es muy claro cómo la adiponectina al activar los receptores R1 y R2 modula las ceramidas, las cuales por diferentes vías mantienen efectos sobre la sensibilidad a la insulina. Bajos niveles de ceramida activan la ceramidasas, las cuales disminuyen los niveles de esfingosinas que, a su vez, disminuyen la ceramida hepática mejorando la sensibilidad de la insulina37.
Por el contrario, unos niveles disminuidos de adiponectina producen un aumento en los niveles de la ceramida hepática produciendo resistencia a la insulina22. Se ha visto que el aumento de la esfingosina-1-fosfato (SIP ) incrementan los niveles de adiponectina y previenen la apoptosis induciendo palmitato o C2-ceramida en miocitos cardiacos y en las células beta del páncreas.
Por otro lado, la administración de un inhibidor de la ceramida o del SIP reversa dichos efectos22,28 (figura 4). Estos datos permiten afirmar que la adiponectina aumentaría la oxidación de ácidos grasos y el gasto de energía vía PPARa con disminución en el contenido muscular y hepático de TG, con aumento en la sensibilidad a la insulina.
4) Activa la vía de la proteína quinasa por AMP:
La vía AMPK es un sistema que regula el balance energético activándose cuando existe una disminución en los niveles de ATP. En estas condiciones se inhiben las vías metabólicas que consumen energía y la activación de los genes que generan ATP.
La adiponectina a través de AdipoR1 induce flujo intracelular de calcio necesario para activar la protein kinasa kinasa dependiente de Ca2+/calmodulina (CaMKKb), y AMPK. Una alteración en el AdipoR1 en músculo suprime las concentraciones de Ca2+ intracelular y disminuye la activación de CaMKK y AMPK27.
En estas condiciones hay una disminución en la deacetilación de PGC-1 alfa a nivel de enzimas mitocondriales, en la oxidación Tipo I en la miofibrillas y en la detoxificación de enzimas en el estrés oxidativo en el músculo esquelético, las cuales están asociadas a resistencia a la insulina y a una disminución en la resistencia muscular33.
La adiponectina activa el AMPK y PPAR en el hígado y el músculo esquelético.
En el músculo esquelético activa el AMPK, estimulando la fosforilación de la ACC (Acetyl-coenzyme-A carboxylase), la oxidación de ácidos grasos, y la captación de glucosa. La adiponectina por vía PPAR estimula la oxidación de ácidos grasos y la disminución de TG en el músculo.
En el hígado, la adiponectina activa el AMPK, reduciendo la gluconeogénesis y aumentando la fosforilación de ACC y la oxidación de ácidos grasos.
La adiponectina activa PPAR, estimulando así la oxidación de ácidos grasos y la disminución de tejido contenido de TG en el hígado.
Estas alteraciones aumentan la sensibilidad a la insulina in vivo38. Estos hechos soportan la evidencia de que una disminución de AdipoR1 en los pacientes diabéticos causa disfunción mitocondrial y resistencia a la insulina27, 35 (figura 5).
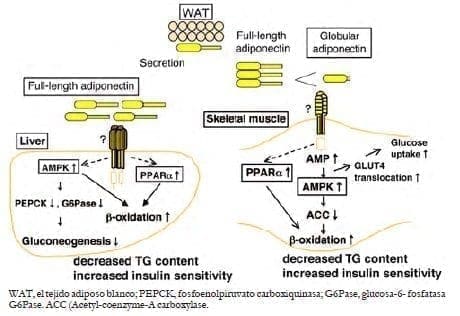 Figura 5. Efecto de la adiponectina en el hígado y el músculo esquelético.
Figura 5. Efecto de la adiponectina en el hígado y el músculo esquelético.
5) Union de la adiponectina a la T-cadherina.
La T-cadherina se encuentra unida a la adiponectina en mioblastos C2C12 y el músculo, pero no se expresa en el hígado38. La T-cadherina no tiene un efecto directo en la señalización celular de la adiponectina sino que más bien puede tratarse de una proteína de unión a la adiponectina.
Esta hipótesis se encuentra sustentada en que no se pudo demostrar que la adiponectina ejerciera un efecto sobre el tejido cardíaco en ratones con deficiencia de Tcadherina. Sin embargo, la T-cadherina es crítica para cardioprotección mediada por adiponectina en ratones38 (figura 1).
Ha sido reportado que la adiponectina modula la respuesta inflamatoria a través de calreticulina, que junto con la CD91 estimula la captación de células apoptóticas. El pretratamiento con anticuerpos anti-calreticulin ha demostrado una disminución en la unión a los miocitos cardíacos, y el aumento de adiponectina inhibe a la activación de Akt y la supervivencia en los cardiomiocitos39 (figura 4).
Factores genéticos
El gen de la adiponectina se encuentra en el brazo largo del cromosoma 3, locus 3q27. El gen se denomina apM1 y posee 3 exones y 2 intrones. La proteína posee cuatro dominios:
1. Secuencia señal amino terminal;
2. Región variable;
3. Dominio tipo colágeno;
4. Dominio globular carboxilo-terminal.
Estudios por cristalografía de rayos X han demostrado una alta homología estructural de la adiponectina con el factor de necrosis tumoralá40.
Diversos reportes han demostrado la existencia de adiponectina de bajo peso molecular (LMW), mediano peso molecular (MMW) y alto peso molecular (HMW ), de los cuales, los dos primeros no tienen diferencias entre los diferentes géneros y el último es más común en mujeres que en hombres41.
Es conocido que la mujer en su vida reproductiva por acción de los estrógenos mantiene una buena funcionalidad de su endotelio. Pero al llegar a la menopausia existe un deterioro progresivo con formación de placa que lleva posteriormente al desarrollo de enfermedad cardiovascular como la hipertensión, infarto y enfermedad cerebro-vascular42.
El conocer los mecanismos involucrados en el aumento del riesgo cardiovascular en esta etapa es perentorio para implementar las estrategias para prevenir este daño. Existe un relativo consenso en la comunidad científica de que diversos factores genéticos están modulando este riesgo, postulándose más de 50 genes como moduladores de la aparición de esta entidad.
Dentro de las variantes genéticas relacionadas con la enfermedad cardiovascular se han descrito 9 polimorfismos que incluyen: apoliproteína B y E, cpy7A1-a204c1, adiponectina (+45TG Y +276GT), CEPT Ba/B2, GP II IPLA I / PLA II, Paroxona I y MTHER43.
Existen 4 polimorfismos clásicos. El +276GT(Entrón 2), que se encuentra asociado a un aumento en los niveles de insulina, resistencia a la insulina y obesidad40. El -11,377CG región promotora del AdipoQ, que se localiza asociado a un aumento en los niveles de glicemia e insulinemia, y disminución de la adiponectina plasmática44.
El polimorfismo +45TG(Exon 2 del AdipoQ), que se ha relacionado con riesgo de resistencia a insulina, hiperglicemia e hipoadiponectinemia. Y el -11,391GA asociado a un aumento en la insulina, resistencia a la insulina y diabetes mellitus tipo 245.
La encuesta longitudinal de Salud y Nutrición Encuesta Cebú (CLHNS) estudiando la asociación de los locus genéticos con la adiponectina plasmática en 1776 mujeres filipinas demostró que existían tres posiciones genéticas: el CDH13 gen (rs3865188,P? 7.2? 10? 16), cerca del gen ADIPOQ (rs864265, P:3,8x 10 9) y 100 kb de KNG1 (Rs11924390, p = 7,6x 10 7).
Las tres señales también se observaron en descendencia en 1.774 adultos jóvenes (CLHNS) y en el análisis combinado que incluye 3.550 madres (p? 1,6? 10? 9). Este es el primer estudio de todo el genoma que proporciona evidencia de la asociación de adiponectina plasmática en el locus CDH13, y el haplotipo KNG1-ADIPOQ con los niveles de adiponectina en mujeres filipinas46.
Estructura y función
El AdipoR1 se encuentra en muchos tejidos del organismo, especialmente en forma abundante en el músculo esquelético, mientras que el Adipo2 se localiza en el hígado. La expresión de estos receptores está representada en órganos blancos para la insulina como el músculo esquelético y el hígado, presentando un aumento en ayuno y una disminución de los AdipoR1/ AdipoR2 por insulina vía fosfoinositolide-3- FoxO147.
Adicionalmente, la adiponectina induce la activación de AMPK en músculo y tejido adiposo en roedores ob/ob resistentes a la insulina. Los niveles de AdipoR1/AdipoR2 están significativamente disminuidos en músculo y tejido adiposo en roedores ob/ob resistentes a la insulina, probablemente debido a la obesidad ligada a la hiperinsulinemia vía FoxO1.
Adicionalmente la adiponectina induce activación del AMPK que se encuentra disminuido en el músculo esquelético de ratones ob/ ob, lo cual sugiere que la disminución de expresión de AdipoR1y AdipoR2 se encuentra asociada a resistencia a la insulina, indicando que la obesidad no solo disminuye los niveles de adiponectina sino que la expresión de AdipoR1/ AdipoR2 disminuye la sensibilidad a la adiponectina llevando a una insulino-resistencia, y crea así un círculo vicioso47,48 (figura 6).
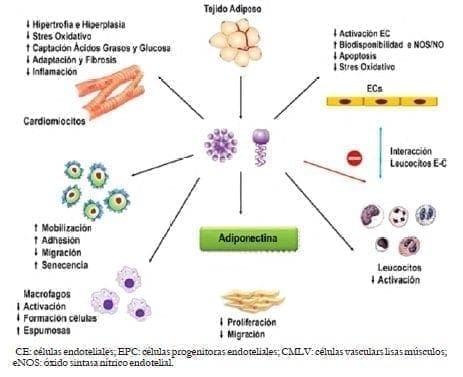
Figura 6. .Acciones de la adiponectina sobre los diferentes tejidos
El AdipoR1 y el AdipoR2 modulan el metabolismo de ácidos grasos en el hígado. En un estudio experimental en roedores se evidencia que en el caso de desarrollar esteatohepatitis no alcohólica (EHNA, hígado graso con inflamación y fibrosis) en ratas fa-fa- Zucker obesas con dieta rica en grasas, la expresión de AdipoR1/R2 se encuentra significativamente disminuida, asociada a una disminución de AMPK alfa 1 y alfa 2 y PPARalfa.
El aumento de la síntesis y disminución de la oxidación de los ácidos grasos por down-regulation de los receptores de adiponectina contribuye a la progresión de EHNA48.
Otra de la funciones de la adiponectina son las propiedades antiinflamatorias por diferentes vías:
1) Promueve el desarrollo de un fenotipo antiinflamatorio sobre los macrófagos, células de Kupffer y los macrófagos RAW264.7, en un mecanismo parcialmente dependiente de AMP quinasa activada25.
La inactivación AMPK inducida por ácidos grasos saturados disminuye la activación de unc-51-quinasa-1 (ULK1), reduce la autofagia y genera ROS mitocondriales.
Esto, a su vez, activa el inflamasoma NLRP3- ASC, causando un aumento en la producción de caspasa-1, IL-1, IL-18 que conduce a una resistencia a la insulina49.
2) Células endoteliales: Suprime la activación inflamatoria inducida por estímulos-NFkappa B, que puede contribuir de manera significativa a los efectos antidiabéticos y antiaterogénicos de adiponectina50. Por otro lado, actuando sobre las células endoteliales disminuye su activación, aumenta la disponibilidad de óxido nítrico (NO), disminuye el estrés oxidativo y la apoptosis. Mantiene un efecto de retroalimentación negativa sobre los leucocitos disminuyendo su activación y formación celular, lo cual impide la formación de placa ateromatosa51.
3) Los mediadores circulantes AdipoR1 y AdipoR2, RPPAR y AMPK aumentan la respuesta inflamatoria por transrepresión del factor nuclear kappa B (NF-kappaB) en genes blanco o diana, incluyendo la COX2, lo cual explica las propiedades antiinflamatorias de la adiponectina52.
4) Cardiomiocitos: La activación del factor de transcripción NF-kappa B actúa en otros tipos celulares como miocitos y microtúbulos C2C1253. Los miocitos cardíacos y tejido cardíaco expresan receptores de adiponectina con disminución de la hipertrofia e hiperplasia, estrés oxidativo, adaptación y fibrosis, e inflamación con aumento en la captación de ácidos grasos y glucosa.
Disminuye la hiperinsulinemia relacionada con la obesidad, a través de la vía PI3K/ Akt y FoxO154. Una disfunción en AdipoR1 disminuye la respuesta angiogénica AMPK-dependiente, y junto con la regulación a la baja de los receptores de adiponectina puede estar causalmente relacionada con disminución de la función cardiovascular55,56 (figura 2).
5) La adiponectina eleva la expresión de COX-2 en células estromales con liberación de prostaglandina E(2), bloquea la formación de las células de grasa en el hueso e inhibe la diferenciación de los preadipocitos estromales clonados57.
6) Macrófagos: La adiponectina aumenta IL- 6 en macrófagos a través de la activación de NF-kappa-â a través de un receptor de adiponectina (no AdipoR1/R2). Este activa STAT3 en los hepatocitos, aumentando el IRS- 2 y la sensibilidad a la insulina49 (figura 6).
La adiponectina se expresa en otros tejidos como mama, próstata, cerebro y endometrio, con efectos clínicos que serán descritos en la segunda parte de esta revisión.
Conclusión
La adiponectina es una adipocitoquina constituida por dos receptores: el AdipoR1, con efectos sobre el hígado, el músculo esquelético y los megacariocitos, activando la vía del AMPK; y el AdipoR2 con acciones sobre hígado y tejido blanco adiposo vía PPAR (a,g,y).
Se revisan los principales mecanismos biomoleculares y genéticos, evidenciando la modulación que tiene la adiponectina sobre el metabolismo de glucosa y lípidos, cardioprotección, antiinflamación y protección endotelial.
Bibliografía
1. Elissondo N, Gómez L., Maidana P, Brites F. Adiponectina: una adipocitoquina con múltiples funciones protectoras. Acta Bioquím Clín Latinoam. 2008; 42 (1): 17-33.
2. Palomera, X., Pérez, A., Blanco-Vaca F. Adiponectina: un nuevo nexo entre obesidad, resistencia a la insulina y enfermedad cardiovascular. Med Clin (Barc). 2005; 124(10): 388-95.
3. Viveros AV, Laviada HM, Bastarrachea RS. Influencia endocrina y paracrina sobre la adipogénesis. Rev Endocrinol Nutri 2002; 10: 151-64.
4. Mick GJ, Wang X, McCormick K. 2002 White adipocyte vascular endothelial growth factor: regulation by insulin. Endocrinology 2002; 143: 948-53.
5. Havel PJ. Control of energy homeostasis and insulin action by adipocyte hormones: leptin, acylation stimulating protein and adiponectin. Curr Opin Lipidol 2002; 13: 51-59.
6. Whitlock G, Lewington S, Sherliker P, Clarke R, Emberson J, Halsey J, et al. Body-mass index and cause-specific mortality in 900 000 adults: collaborative analyses of 57 prospective studies. Lancet. 2009; 373: 1083-96.
7. World Health Organization Report. Fact sheet: obesity and overweight. Available from: http://www.who.int./dietphysicalactivity/publications /facts/obesity/en
8. Von Gierke E. U¨ber fett metabolism. Der Deutsch Ges Path.1906; 10: 182-5.
9. Chudek J, Adamczak M, Nieszporek T, Wiecek A. The adipose tissue as an endocrine organ–a nephrologists’ perspective. Contrib Nephrol. 2006; 151: 70-90.
10. Cannon B, Nedergaard J. Brown adipose tissue: function and physiological significance. Physiol Rev. 2004; 84: 277-359.
11. Galic S, Oakhill JS, Steinberg GR. Adipose tissue as an endocrine organ. Mol Cell Endocrinol 2010; 316: 129-39.
12. Christodoulides C, Lagathu C, Sethi J, Vidal- Puig A. Adipogenesis and WNT signaling. Trends Endocrinol Metabol 2008; 20: 17-24.
13. Logan, C. Y. and Nusse, R. The Wnt signaling pathway in development and disease. Annu. Rev. Cell Dev. Biol. 2004; 20: 781-101.
14. Lau DCW, Roncari DAK, Hollenberg CH. Release of mitogenic factors by cultured preadipocytes from a massively obese human subjects. J Clin Invest 1987; 79: 632-36.
15. Kloting N, Bluher M. Adipocyte dysfunction, inflammation and metabolic syndrome. Rev Endocr Metab Disord. 2014; 15: 277-87.
16. Adamczak M, Wiecek A. The adipose tissue as an endocrine organ. Semin Nefrol 2013; 33: 2-13.
17. Nakano Y, Tobe T, Choi-Miura NH, Mazda T, Tomita M. Isolation and characterization of GBP28, a novel gelatin-binding protein purified from human plasma. J Biochem 1996; 120: 803-12.
18. Kadowaki T, Yamauchi T. Adiponectin and adiponectin receptors. Endocrine Reviews 2005; 26: 439-51.
19. Wong GW, Wang J, Hug C, Tsao TS, Lodish HF. A family of Acrp30/ adiponectin structural and functional paralogs. Proc Natl Acad Sci USA. 2004; 101: 10302-7.
20. Domínguez R. A. Adiponectina: El tejido adiposo más allá de la reserva inerte de energía. Revista de Endocrinología y Nutrición 2007; 15(3): 149-155.
20a. Gavrila A, Peng CK, Chan JL, et al. Diurnal and ultradian dynamics of serum adiponectin in healthy men: comparison with leptin, circulating soluble leptin receptor, and cortisol patterns. J Clin Endocrinol Metab 2003; 88: 2838-43.
21. Kadowaki T, Yamauchi T, Kubota N, et al. Adiponectin and adiponectin receptors in insulin resistance, diabetes, and the metabolic syndrome. J Clin Invest 2006; 116: 1784-92.
22. Motoshima H, Wu X, Sinha MK, et al. Differential regulation of adiponectin secretion from cultured human omental and subcutaneous adipocytes: effects of insulin and rosiglitazone. J Clin Endocrinol Metab 2002; 87: 5662-
23. Nilsson L, Binart N, Bohlooly YM, et al. Prolactin and growth hormone regulate adiponectin secretion and receptor expression in adipose tissue. Biochem Biophys Res Commun 2005; 331: 1120-6.
24. Nishizawa H, Shimomura I, Kishida K, et al. Androgens decrease plasma adiponectin, an insulin-sensitizing adipocyte-derived protein. Diabetes 2002; 51: 2734-41.
25. ALPCO Diagnostics TM. Adiponectin (Multimeric. EIA. 2007). Available in: http://www.alpco.com/pdfs/47/47-ADPH-9755.pdf (accessed June 10, 2015)
26. Holland WL, Miller RA,Wang ZV, et al. Receptor- mediated activation of ceramidase activity initiates the pleiotropic actions of adiponectin. Nat Med 2011; 17. 55-U22.
27. Iwabu M, Yamauchi T, Okada-Iwabu M, et al. Adiponectin and AdipoR1 regulate PGC- 1 alpha and mitochondria by Ca2. And AMPK/SIRT1. Nature 2010; 464: 1313-9.
28. Yamauchi T, Kamon J, Minokoshi Y, et al. Adiponectin stimulates glucose utilization and fatty-acid oxidation by activating AMPactivated protein kinase. Nat Med 2002; 8: 1288-95.
29. Tsuchida A, Yamauchi T, Takekawa S, et al. Peroxisome proliferator-activated receptor (PPAR) alpha activation increases adiponectin receptors and reduces obesity-related inflammation in adipose tissue-comparison of activation of PPAR alpha, PPAR-gamma, and their combination. Diabetes 2005; 54: 3358-70.
30. Liu M, Liu F. Transcriptional and posttranslational regulation of adiponectin. Biochem J 2010; 425: 41-52.
31. Yamauchi T, Kamon J, Waki H, Terauchi Y, Kubota N, Hara K, et al. The fat-derived hormone adiponectin reverses insulin resistance associated with both lipoatrophy and obesity. Nat Med 2001; 7: 941-6.
32. Maeda N, Shimomura I, Kishida K, et al. Diet-induced insulin resistance in mice lacking adiponectin/Acrp30. Nat Med 2002; 8: 731-7.
33. Tomas E, Tsao TS, Saha AK, et al. Enhanced muscle fat oxidation and glucose transport by ACRP30 globular domain: acetyl-CoA carboxylase inhibition and AMP-activated protein kinase activation. Proc Natl Acad Sci U S A 2002; 99:16309-13.
34. Fruebis J, Tsao TS, Javorschi S, et al. Proteolytic cleavage product of 30-kDa adipocyte complement-related protein increasesfatty acid oxidation in muscle and causes weight loss in mice. Proc Natl Acad Sci U S A 2001; 98: 2005-10.
35. Miller RA, Chu Q, Le Lay J, et al. Adiponectin suppresses gluconeogenic gene expression in mouse hepatocytes independent of LKB1- AMPK signaling. J Clin Invest 2011; 121: 2518-28.
36. Yamauchi T, Nio Y, Maki T, et al. Targeted disruption of AdipoR1 and AdipoR2 causes abrogation of adiponectin binding and metabolic actions. Nat Med 2007; 13: 332-9.
37. Hug C, Wang J, Ahmad NS, et al. T-cadherin is a receptor for hexameric and highmolecular- weight forms of Acrp30/adiponectin. Proc Natl Acad Sci U S A 2004; 101: 10308-13.
38. Takashi K, Yamauchi T. Adiponectin and adiponectin receptors. Endocrin Reviews 2005; 26: 439-51.
38ª. Denzel MS, Scimia M-C, Zumstein PM, et al. T-cadherin is critical for adiponectin-mediated cardioprotection in mice. J Clin Invest 2010; 120: 4342-52.
39. Waki H, Yamauchi T, Kamon J, Ito Y, Uchida S, Kita S. Impaired multimerization of human adiponectina mutants associated with diabetes. Molecular structure and multimer formation of adiponectin. J. Biol Chem 2003; 278: 40352-63.
40. Kyriakou T, Collins L, Spencer-Jones N, Malcolm C, Wang X, Snieder H, et al. Adiponectin gene ADIPOQ SNP associations with serum adiponectin in two female populations and effects of SNPs on promoter activity. J Hum Genet 2008; 53: 718-27.
41. Takahashi M, Arita Y, Yamagata K, Matsukawa Y, Okutomi K, Horie M, et al. Genomic structure and mutations in adipose-specific gene, adiponectin. Int J Obes Relat Metab Disord 2000; 24: 861-8.
42. Maturana M, Irigoyen M, Spritzer P. Menopause, estrogens and dysfunction. Current concepts. Clinics 2007; 62: 77-86.
43. Vaxillaire M, Dechaume A, Vasseur DV, Lahmidi S, Vatin V, Leprete F, et al. Genetic analysis of ADIPOR1 and ADIPOR2 candidate polymorphisms for type 2 diabetes in the Caucasian population. Diabetes 2006; 55: 856-61.
44. Gable DR, Hurel SJ, Humphries SE. Adiponectin and its gene variants as risk factors for insuline resistance, the metabolic syndrome and cardiovascular disease. Atherosclerosis 2006; 188 (2): 231-44.
45. Tanko L, Siddiq A, Lecoeur C, Larsen P, Christiansen C, Walley A, et al. ACDC/ Adiponectin and PPAR-? gene polymorphisms: implications for features of obesity. Obesity 2005; 13: 2113-21.
46. Wu Y, Li Y, Lange EM, et al. Genome-wide association study for adiponectin levels in Filipino women identifies CDH13 and a novel uncommon haplotype at KNG1- ADIPOQ. Hum Mol Genet 2010; 19: 4955-64.
47. Tsuchida A, Yamauchi T, Ito Y, et al. Insulin/ foxo1 pathway regulates expression levels of adiponectin receptors and adiponectin sensitivity. J Biol Chem 2004; 279: 30817-22.
48. Matsunami T, Sato Y, Ariga S, et al. Regulation of synthesis and oxidation of fatty acids by adiponectin receptors (AdipoR1/R2 and insulin receptor substrate isoforms (IRS-1/-2) of the liver in a nonalcoholic steatohepatitis animal model. Metab Clin Exp 2011; 60: 805-14.
49. Ohashi K, Parker JL, Ouchi N, et al. Adiponectin promotes macrophage polarization toward an anti-inflammatory phenotype. J Biol Chem 2010; 285: 6153-60.
50. Mandal P, Pratt BT, Barnes M, et al. Molecular mechanism for adiponectin-dependent M2 macrophage polarization: link between the metabolic and innate immune activity of full length adiponectin. J Biol Chem 2011; 286: 13460-9.
51. Kampoli AM, Tousoulis D, Antoniades C, et al. Biomarkers of premature atherosclerosis. Trends Mol Med 2009; 15: 323-322.
52. Wen H, Gris D, Lei Y, et al. Fatty acidinduced NLRP3-ASC inflammasome activation interferes with insulin signaling. Nat Immunol 2011; 12: 408-U461.
53. Chandrasekar B, Boylston WH, Venkatachalam K, et al. Adiponectin blocks interleukin-18- mediated endothelial cell deathvia APPL1- dependent AMP-activated protein kinase (AMPK) activation and IKK/NF-kappa B/ PTEN suppression. J Biol Chem. 2008; 283: 24889-98.
54. Tsao TS, Murrey HE, Hug C, et al. Oligomerization state-dependent activation of NFkappa B signaling pathway byadipocyte complement-related protein of 30 kDa (Acrp30). J Biol Chem 2002; 277: 29359-62.
55. Cui X-B, Wang C, Li L, et al. Insulin decreases myocardial adiponectin receptor 1 expression via PI3K/Akt and FoxO1pathway. Cardiovasc Res 2012; 93: 69-78.
56. Shimano M, Ouchi N, Shibata R, et al. Adiponectin deficiency exacerbates cardiac dysfunction following pressure overload through disruption of an AMPK-dependent angiogenic response. J Mol Cell Cardiol 2010; 49: 210-20.
57. Awazawa M, Ueki K, Inabe K, et al. Adiponectin enhances insulin sensitivity by increasing hepatic IRS-2 expression via amacrophagederived IL-6-dependent pathway. Cell Metab 2011; 13: 401-12.
Conflictos de interés
Ninguno declarado.
Agradecimientos
A las directivas de la Universidad, Vicerrectoría de Investigaciones, Facultad de Ciencias de la Salud de la Universidad de Ciencias Aplicadas por su apoyo en la elaboración de este manuscrito.
