7.1. Hipertensión
La hipertensión arterial controlada médicamente no contraindica el uso de terapia hormonal en la menopausia. El hipoestrogenismo es un factor asociado al incremento de la presión arterial. Por cada 2 mm Hg de reducción en la presión arterial sistólica hay un descenso en la mortalidad por hemorragia cerebral del 10% y del 7% de mortalidad por accidente vascular isquémico. Nivel de evidencia B.
Se han investigado algunas acciones de la terapia hormonal sobre el eje renina-angiotensina-aldosterona y estudios observacionales muestran diferencias en este aspecto con diferentes estrógenos y progestágenos.
En mujeres tanto hipertensas como normotensaslos estrógenos por vía trasdérmica y percutánea han demostrado disminuir tanto la presión arterial sistólica como diastólica, pero es más pronunciado su efecto sobre la presión sistólica. Nivel de evidencia C.
Dentro de los progestágenos, la drospirenona ha demostrado acciones directas sobre el eje renina-aldosterona y, por lo mismo, facultades en disminuir las cifras de presión arterial en mujeres hipertensas con y sin tratamiento médico antihipertensivo concomitante. Nivel de evidencia B.
7.2. Síndrome Metabólico
El síndrome metabólico (SM) es una de las manifestaciones clínicas más frecuentes en pacientes en menopausia, su elevado factor de riesgo cardiovascular y de mortalidad hacen necesario que el médico haga una evaluación cuidadosa y exhaustiva de las pacientes antes de decidir la indicación de la TH, dosis y vía de administración.
En el estudio NHANES III, en 3423 adultos entre 20 y 79 años, la prevalencia de SM fue de 34%. En mujeres de 40 a 59 años de edad es casi tres veces más: RR. 3.20 (IC 95%: 2.32-4.43). En mayores de 60 años fue seis veces más probable: RR. 6.44 (IC 95%: 4.75 a 8.72). Las mujeres obesas tuvieron 17 veces más riesgo de SM que las mujeres de peso normal: RR. 17.14 (IC 95%: 12.54-23.44)1. Nivel de evidencia II b.
La prevalencia según el Framingham Offspring Study en 3224 personas es de 26.7%; en la población total según el ATP III, entre los 40 y 49 años es 37.0 ± 3.4 y entre 50 y 59 años de 47.4±3.6, porcentaje que se incrementa en un 8% cuando se clasifica según IDF2. Nivel de evidencia II b.
En Latinoamérica, según el estudio CARMELA en 11.502 participantes, la prevalencia en mujeres es 22% y en mujeres mayores osciló en entre 25% y 49%3. Nivel de evidencia II b.
En el estudio latinoamericano de REDLINC en 3965 mujeres en menopausia entre 40 y 44 años la prevalencia del SM es del 28,1% y entre los 45 y 64 años del 42.9%4. Nivel de evidencia II b.
En Colombia, Gómez G. en 2005 informa un 31% en 300 mujeres en menopausia5, nivel de evidencia II b, y Sánchez F. un 20.8% en mujeres entre 40 y 64 años, porcentaje que se incrementó al 26.1% en mayores de 65 años6. Nivel de evidencia II b.
Estos estudios de prevalencia confirman incremento del síndrome metabólico con la edad y la obesidad. El 46.5% de las mujeres obesas y con sobrepeso tienen síndrome metabólico7. Nivel de evidencia I.
En el estudio del NHANES 2003-2004, el 38.5% de las pacientes con diagnóstico de síndrome metabólico tenían un riesgo global de enfermedad coronaria, moderadamente alto del 15.8% y riesgo alto del 3.5% a 10 años8.
El SM en mujeres representa un riesgo de morbilidad cardiovascular que se incrementa en pacientes con SM y diabetes tipo II. Dekker J. describe un riesgo de morbilidad cardiovascular en mujeres europeas con diabetes tipo II no fatal de dos veces RR, 2.05 (IC 95%: 1.29-3.26)9. Nivel de evidencia Ia.
El RR de ECV en pacientes con SM es de 2.35 (IC, 95%: 2.02-2.73), mucho menor que la suma de los demás componentes. La hipertensión y los niveles bajos de HDL sumados son más fuertes predictores individualmente de ECV que el SM, lo que confirma que el SM no es más que un grupo de factores de riesgo10. Nivel de evidencia Ia.

La mortalidad por enfermedad cardiovascular en pacientes con SM es el doble con respecto a la población general: RR, 2.4 (IC, 95%: 1.87- 3.08). La mortalidad es mayor en mujeres que en hombres, el RR de mortalidad es de 2.55 en mujeres frente a 1.94 en hombres11. Nivel de evidencia Ia.
El SM en mujeres representa un riesgo de mortalidad muy alto para enfermedad cardio y cerebrovascular: por todas las causas, RR, 1.27 (IC, 95%: 0.90 a 1.78); por enfermedad coronaria, RR, 1.82 (IC, 95%: 1.38-2.38) según ATP III. Este riesgo es más grave si se clasifica por los parámetros de la OMS en donde la mortalidad por todas causas es de 1.37 (IC, 95%: 1.09-1.74) y la mortalidad por enfermedad coronaria es de 2.60 (IC, 95%: 1.55-4.38)12. Nivel de evidencia Ia.
En un estudio de cohorte de 2.815 pacientes, el riesgo de mortalidad por enfermedad cardiovascular con síndrome metabólico según NCEP es de RR, 2.53 (IC, 95%: 1.74-3.67), en tanto el riesgo es mayor asociado al SM e hiperglicemia en ayunas RR, 2.87 (IC, 95%: 1.96-4.20), y ahipertensión arterial sistémica RR, 1.71 (IC, 95%: 1.15-2.54)11. Nivel de evidencia Ia. El estudio del corazón de San Antonio demostró en pacientes con SM que el riesgo de mortalidad por enfermedad cardiovascular es mayor en mujeres 4.65 (IC, 95%: 2.35-9.21) que en hombres 1.82 (IC, del 95%: 1.14-2.91). Según los parámetros de la OMS el RR fue bajo, 2.83 (IC, 95%: 1.55- 5.17) en las mujeres y 1.15 (IC, 95%: 0.72-1.86) en hombres. En conclusión, la morbilidad y la mortalidad son más altas en mujeres en menopausia con SM que en las que no lo presentan13. Nivel de evidencia Ia.
Un meta-análisis y RCT en 87 estudios describen los riesgos de mortalidad, con relación al género, en pacientes con SM y muestran que son mayores en las mujeres11.

Los mecanismos que explican el mayor riesgo cardiovascular en el síndrome metabólico en mujeres con respecto a los hombres no son claros; sin embargo varias teorías han sido postuladas por expertos:
1. La obesidad central suele ser mayor en mujeres posmenopáusicas que en hombres de su edad.
2. El perfil de colesterol es diferente. En la posmenopausia el HDL-colesterol disminuye y el LDL-colesterol se aumenta en partículas pequeñas y densas, por lo tanto más aterogénicas.
3. Hay evidencias de que los triglicéridos elevados en mujeres están más asociados a ECV que en el hombre. En un metaanálisis se mostró que el aumento de 18 mg/dL de triglicéridos en las mujeres se asocia a aumento del 76% de riesgo cardiovascular, en comparación con un 32% de riesgo en hombres.
4. Hay factores únicos de riesgo para las mujeres como son el síndrome de ovario androgénico, el uso de anticonceptivos orales, la diabetes gestacional, la preeclampsia, además de la menopausia, que pueden ser responsables de una asociación más fuerte entre el síndrome metabólico y el riesgo cardiovascular11. Nivel de evidencia III.
Terapia Hormonal
En el estudio multicéntrico ESTHER, en mujeres posmenopáusicas de 45 a 70 años de edad, y con historia de un primer episodio de tromboembolismo venoso (TEV) idiopático, se apreció mayor riesgo de tromboembolismo: RR, 4.2 (IC, 95%: 1.5-11.6) para estradiol oral, frente a RR, 0.9 (IC, 95%: 0.4-2.1) en usuarias de transdérmicos (estradiol 50 g/d). El uso de progesterona micronizada el RR, 0.7 (IC, 95%, 0.3-1.9) y para los derivados didrogesterona, medrogestona, acetato clormadinona, acetato ciproterona o acetato de medroxiprogesterona el RR, 0.9 (IC, 95%: 0.4-2.3) en tanto para los nor-pregnanos se incrementa el riesgo más de tres veces, el RR fue de 3.9 (IC, 95%: 1.5-10.0).
En conclusión: los estrógenos orales y los nor-pregnanos se asocian a mayor riesgo de TEV. En tanto la terapia transdérmica ha demostrado en numerosos estudios menos riesgos14. Nivel de evidencia IIb.
Terapia Hormonal en Pacientes con Síndrome Metabólico
En estudio prospectivo randomizado a corto plazo sugiere que el E2 por vía oral en pacientes con SM puede empeorar los parámetros de resistencia a la insulina y riesgo cardiovascular en tanto el E2 transdérmico tuvo mínimos efectos15. Nivel de evidencia Ib.
Los dos estudios del WHI en 1176 mujeres, compararon las pacientes con y sin SM y evaluaron el riesgo de la TH: se aprecia mayor riesgo de ECV en las 172 pacientes con diagnóstico de SM y TH de 1.72 (IC, 1.20-1.47), en tanto en 243 pacientes sin síndrome metabólico y terapia hormonal el RR de 0.98 (IC, 0.66-1.48) fue no significativo.
Concluye que la TH incrementa el riesgo de enfermedad coronaria en mujeres que tienen SM y que los resultados de los ensayos clínicos no se pueden generalizar a todas las poblaciones y que es necesario hacer estudios selectivos de la población estudiada16. Nivel de evidencia Ia.
Basados en estos hallazgos se propuso, en la reunión 21 de NAMS, que la terapia ideal eran dosis bajas de estrógenos con progestágenos, tal como la terapia transdérmica para los síntomas menopáusicos y la disminución del riesgo cardiovascular17. Nivel de evidencia 4.
Se carece de estudios RCT o meta-análisis y sus efectos relacionados de tibolona y microdosis de estrógenos conjugados con el síndrome metabólico.
Conclusión
Es necesario evaluar el riesgo global de cardiopatía coronaria que tiene cada paciente, efectuar un tratamiento adecuado de su patología cardiovascular antes de prescribirle terapia hormonal y solo se pudieran considerar la TH al momento de estar controlados todos sus factores de riesgo o cuando la paciente esté gravemente incapacitada por su sintomatología menopáusica8.
De acuerdo con esta posición, se propone el tratamiento para el SM basado en las conclusiones de Mottillo sobre los riesgos de cada uno de sus elementos11. Nivel de evidencia IV.
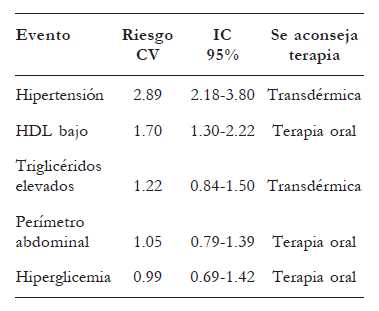
7.3. Diabetes
El envejecimiento se asocia a mayor riesgo de diabetes mellitus tipo II o del adulto (DM2). Se incrementa en mujeres en edad media de la vida1,2. Nivel de evidencia 3.
Factores de Riesgo
Edad avanzada, disminución en la actividad física, aumento de la adiposidad total y central, y disminución de los niveles de hormonas ováricas.
Hay posiciones contradictorias con respecto a la TH y las hormonas ováricas. Estas últimas pueden jugar un papel al aumentar la resistencia a la insulina1,2. Nivel de evidencia 3.
Efecto Benéfico de la TH en la Diabetes Mellitus
1. La TH disminuye el riesgo de diabetes por acción directa sobre el páncreas o a nivel del músculo esquelético o indirecta por reducción de la acumulación de grasa total o visceral, por mejoría en la acción de la insulina en mujeres con resistencia a la insulina, puede ejercer acciones opuestas en varios tejidos.
2. Las discrepancias entre los estudios pueden ser debido a diferencias específicas de la población estudiada, específicas de los estudios, o a estudios indirectos del riesgo de diabetes.
3. Los estudios hasta la fecha no han sido diseñados específicamente para evaluar el papel de TH en prevención de la diabetes, por lo que los datos existentes no son óptimos.
4. Los efectos de TH pueden diferir del efecto de las hormonas ováricas endógenas1,2.
Indicaciones de su Uso
Actualmente ningún medicamento de TH en la menopausia tiene aprobación por la FDA para prevenir la aparición de DM2.
El mecanismo protector de la TEP no es únicamente por disminución de la resistencia a la insulina, puede ser a través de otros mecanismos como la disminución del peso o el perímetro abdominal3. Nivel de evidencia l.
En el WHI, el efecto protector de la THsobre el riesgo de diabetes es menos evidente en mujeres con perímetro abdominal bajo, sugiriendo que son las mujeres obesas las que se benefician de la TH, que modifican su estado metabólico, independiente de la ligera reducción en el IMC o del perímetro abdominal4. Nivel de evidencia l.
En el WHI, la utilización de EEC más AMP en mujeres en menopausia obtuvo reducción estadísticamente significativa de DM en el 21% (RR, 0.79; IC, 95%: 0.67-0.93). Nivel de evidencia I. En el estudio HERS del 35% (RR, 0.65; IC, 95%: 0.48-0.89)6. Nivel de evidencia I.
En el WHI con reducción de TE del 12% (RR, 0.88; IC, 95%: 0.77-1.01) no es estadísticamente significativa7. Nivel de evidencia I.
En el Nurse’s Health Study (NSH) la reducción con TEP fue de 0.80 (IC, 95%: 0.67- 0.96)8. Nivel de evidencia II.
Dos estudios aleatorizados, controlados con placebo, indican que los EEC más AMP tuvieron efectos adversos sobre la sensibilidad a la insulina en mujeres posmenopáusicas con peso normal9. Nivel de evidencia I.
Estudios seccionados transversales sugieren que en mujeres con adiposidad visceral baja pueden tener efectos adversos sobre la sensibilidad a la insulina y la TH10. Nivel de evidencia II-2.
En estudio seccionado transversal en mujeres menopáusicas se observa como los estrógenos endógenos se asocian a mayor riesgo de resistencia a la insulina en contraste con la TH, efecto que puede ser debido a la asociación inversa entre la sensibilidad de la insulina endógena y estrógenos11. Nivel de evidencia II-2.
Un meta-análisis en 107 estudios mostró en mujeres sin diabetes que la TH reduce la grasa abdominal en -6.8% (IC, -11.8 a -1.9%), el HOMA-IR en -12.9% (IC, -17.1 a -8.6%) y la aparición de diabetes, riesgo relativo 0.7 (IC, 0.6-0.9). En las mujeres con diabetes, la TH reduce la glucosa en ayunas -11.5% (IC, -18.0 a -5.1%)] y HOMA-IR -35.8% (IC, -51.7 a – 19.8%)12. Nivel de evidencia I.
Un meta-análisis en mujeres menopáusicas mayores sin enfermedad cardiovascular y con TH presenta mejoría en la resistencia a la insulina y reducción en la incidencia en la aparición de diabetes tipo 2 en un 17%, en tanto en mujeres con ECV la reducción es del 35%4,6. Nivel de evidencia I.
El objetivo primordial con la TH es el control óptimo de la glucosa en mujeres posmenopáusicas con diabetes tipo 2. Por lo que no hay evidencia suficiente para recomendar TH como indicación única o primaria en la prevención de la DM en mujeres peri o posmenopáusicas. Nivel de evidencia III.
Hay evidencia sobre el uso de dosis más bajas de medicamentos para el control de la glicemia en mujeres posmenopáusicas con DM2 y TE oral.
Con la terapia transdérmica no se incrementan los niveles séricos de triglicéridos y factores trombóticos que a menudo son mayores en pacientes con DM, a diferencia de la vía oral.
Los resultados obtenidos en los estudios RCT no pueden ser generalizados a otros medicamentos de TH. Nivel de evidencia III.
El Preventive Services Task Force (USPSTF) concluye que los efectos nocivos de la combinación de estrógeno y progestina son superiores a los beneficios para la prevención de enfermedades crónicas en la mayoría de las mujeres, por lo cual no deben recibir TH las mujeres posmenopáusicas para prevención de enfermedades crónicas13. Grado de recomendación D.
7.4. Endometriosis y TH
La endometriosis es una enfermedad frecuente en la vida reproductiva de la mujer, especialmente en aquellas que consultan por infertilidad. Usualmente los síntomas desaparecen después de la menopausia natural o quirúrgica. La TH se recomienda en los casos de falla ovárica prematura, en los casos de ooforectomía en mujeres jóvenes y en pacientes con severos síntomas del síndrome climatérico. En pacientes con antecedentes de endometriosis que presentan de nuevo dolor pélvico con TH después de la menopausia se debe sospechar una recurrencia de la enfermedad o una transformación maligna de endometriosis residual1. Algunos autores contraindican la TH2. Nivel de evidencia 2c.
En una revisión de la literatura de Chocrane 2009 sobre el tema3 existen dos estudios aleatorizados controlados por Fedele 19994, que comparó la aplicación de estradiol transdérmico 0.05 mg/día combinado con AMP 10 mg por 12 días, o tibolona 2.5 mg/día (pacientes con útero) durante un año, y Matorras 2002 aplicando la vía transdérmica más 200 mg de progesterona micronizada por 14 días por 45 meses5. En estos estudios Fedele reportó aumento del dolor y dispareunia 4/10 con E+P y 1/11 en el brazo con tibolona. No hubo diferencias en los dos grupos (RR, 6.67; IC, 95%: 0.60-74.51). Para Matorras la recurrencia del dolor fue 4/115 con E2 o E+P comparado 0/57 en las que no recibieron tratamiento. Feldene no reportó exacerbación de la endometriosis confirmado histológicamente y Matorras 2/115. En resumen, podemos afirmar que las pacientes con antecedentes de endometriosis o menopausia quirúrgica a quienes se les administra TH pueden presentar exacerbación del dolor y recurrencia de la enfermedad. Recomendación B.
7.5. Colecistitis, Colelitiasis y TH
La colecistitis es una enfermedad que es más frecuente en mujeres en edad media de la vida que en hombres. La TH incrementa el riesgo de colecistitis y colecistectomía, es por ello que a la paciente a quien se le va a prescribir TH se le debe hacer una evaluación adecuada de su estado de salud, interrogarla sobre los factores de riesgo y complementar con estudio de ultrasonido si se sospecha enfermedad vesicular, con el fin de evitar complicaciones posteriores y principalmente en aquellas pacientes que tienen situaciones especiales de salud.
Prevalencia
La prevalencia de la enfermedad vesicular viene en aumento posiblemente por el incremento en la expectativa de vida, cambios en el estilo de vida, incluyendo factores nutricionales, sedentarismo y obesidad. En la literatura hay prevalencias que oscilan entre 10% y 20% en estudios americanos y europeos. En la población de NHANES III el 11% de la población encuestada tiene historia de enfermedad clínica de vías biliares o colecistectomía previa y en la población del HERS asciende al 38%. En el Reino Unido se estima que el 1.1% de mujeres de mediana edad y que nunca han usado la TH ingresan al hospital para colecistectomía.
Factores de riesgo:
• Mujeres blancas3
• Edad avanzada3-4,6
• Obesidad2-4,6
• Síndrome metabólico3
• Aumento del perímetro abdominal2,6
• Aumento de la relación cintura/cadera2,6
• Descenso rápido de peso en pacientes obesas1,3
• Embarazo
• Multíparas
• Posmenopausia
• Cambios en el estilo de vida
• Tabaquismo
• Hiperinsulinemia en ayunas2,6
• HOMA elevado6
• Colesterol HDL bajo2-6
• Triglicéridos elevados2
• Diuréticos2
• Uso de derivados del ácido fíbrico (fibratos)1
• Terapia de reemplazo hormonal2
• Factores de protección
• Actividad física3
• HDL colesterol elevado1,4
• Ingesta de alcohol1,4
• Uso de estatinas (45%)1
• Proteínas vegetales3
• Fibra3
• Café 3
• Alcohol3
Fisiopatología
El hígado tiene receptores de estrógenos que permiten que los estrógenos provoquen saturación de colesterol en la bilis, inhibición de secreción del ácido quenodeoxicólico y aumento de ácido cólico.
La formación de cálculos de colesterol es el resultado de varios procesos fisiológicos:
1. Sobresaturación de colesterol y lecitina en la bilis, alterando su composición, hipersecreción hepática y precipitación de las sales de colesterol7. Nivel de evidencia I.
2. Disminución del flujo, estasis biliar y formación de cristales de colesterol debido a la disminución de la nucleación del colesterol en la bilis7. Nivel de evidencia I.
3. Crecimiento de microcristales individuales y cálculos biliares macroscópicos.
4. Hipomotilidad vesicular.
5. Parece que intervienen otros factores que aumentan las glicoproteínas, como el incremento del ácido araquidónico y PGE2.
Las progestinas inhiben la contracción de la vesícula, incrementan la estasis biliar y disminuyen la respuesta de cálculos a la acción de la colecistokinina8. Nivel de evidencia 3.
Estudios prospectivos de cohortes como el Nurse’ s Health Study (NHS) indican incremento del riesgo de la enfermedad biliar de 2,5 veces más que el grupo control con la TH, pero no todos los estudios observacionales informan incremento del riesgo de enfermedad biliar2. Nivel de evidencia II-1.
El estudio Nurse’s Health Study (NHS) encontró mayor riesgo de colecistectomía en usuarias de estrógenos de más de 10 años RR, 2.6 (IC, 95%: 2.2-3.1). En pacientes que utilizan dosis mayores de estrógenos (1.25 mg de EEC) no se incrementó la colecistectomía (RR, 2.4 [IC, 95%: 2.0-2.9] en relación con los controles. El riesgo disminuyó considerablemente en mujeres luego de haber suspendido la terapia por 1 a 2.9 años (RR, 1.6; IC, 95%: 1.2-2.0), aunque persistió un pequeño riesgo9. Nivel de evidencia II-2.
El estudio RCT del WHI en mujeres sanas sugiere incremento en el riesgo de colecistitis en mujeres posmenopáusicas de edad promedio de 63 años y con terapia de estrógenos, con relación al placebo. EEC: (RR, 1.80; IC, 95%: 1.42-2.28) y E + P (RR, 1.54; IC, 95%: 1.22-1.94)10. Nivel de evidencia I.
El riesgo de colecistitis se incrementa con el uso de la TH y con el mayor tiempo de ingesta en comparación con mujeres quienes nunca han utilizado la TH: RR, 1.94 (IC, 95%: 1.17-3.22) comparado con utilización de menos de 1 año, RR, 2.04 (IC, 95%: 0.79-5.30) y más de 1 año: RR, 4.05; (IC, 95%: 1.12-14.76)11. Nivel de evidencia I.
Los estrógenos solos y los estrógenos progestágenos en pacientes en menopausia aumentan el riesgo de colecistitis1,10,12,13. Nivel de evidencia I.
Estudios RCT como el WHI sugieren incremento en el riesgo de colecistectomía tanto en mujeres posmenopáusicas de edad promedio de 63 años y con terapia de EEC: RR, 1.93; (IC, 95%: 1.52-2.44) y E + P: RR, 1.67; (IC, 95%: 1.32-2.11) y el HERS en pacientes menopáusicas con enfermedad cardiovascular demostró mayor riesgo de colecistectomía en el primer año, luego del ajuste del uso de estatinas: RR, 2.12 (IC, 95%: 1.04-4.32). El estudio del millón de mujeres informó un RR, 1.64 (IC, 95%: 1.58-1.69). En resumen, el tratamiento con TEP oral aumenta el riesgo de colecistectomía1,10,12. Nivel de evidencia I.
El RR para colecistitis no se modificó con la paridad, el uso de anticonceptivos orales, el ejercicio, el cigarrillo, el alcohol, la HTA, la histerectomía, o el HSDL elevado12. WHI Nivel de evidencia I.
Las mujeres que usan estrógenos equinos conjugados tienen un riesgo significativamente mayor de colecistitis que las que usan estradiol: RR, 1.79 (IC, 95%: 1.72-1.87) frente a 1.62 (IC, 95%: 1.54-1.70) 12. Nivel de evidencia I.
El riesgo de colecistitis se incrementa significativamente más en las usuarias actuales (RR, 1.64, (IC, 95%: 1.58-1.69) que en las usuarias en el pasado; sin embargo, el riesgo persiste 1.27 (IC, 95%: 1.22-1.32); hasta los 10 años con relación al grupo control12. Nivel de evidencia I.
El riesgo relativo de colecistectomía en usuarios actuales fue de 1.69 (IC, 95%, 1.63-1.75) y disminuyó en las usuarias en el pasado, RR, 1.29 (IC, 95%: 1.23-1.34), prevalencia que es mayor que el grupo control12. Nivel de evidencia I.
El uso de estrógenos equinos conjugados se asoció a un RR ligeramente mayor de colecistitis que el estradiol: RR, 1.79 (IC, 95%: 1.72-1.87) frente a RR, 1.62 (IC, 95% 1.54-1.70) 12. Nivel de evidencia I.
La utilización de EEC y estradiol en dosis altas se asocia a mayor riesgo de colecistitis que con dosis bajas: con EEC, el RR fue 1.76 (IC, 95%: 1.68-1.84) para 0.625 mg y 1.91 (IC, 95%: 1.78-2.04) para más de 0.625 mg; con estradiol es de 1.44 (IC, 95%: 1.31-1.59) para 1 mg y 1.68 (IC, 95%: 1.59-1.77) para más de 1 mg. En conclusión, la TH se debe utilizar en la menor dosis y durante el menor tiempo posible12. Nivel de evidencia I.
Los estrógenos transdérmicos, como los estrógenos equinos conjugados administrados por vía oral, favorecen la formación de cálculos biliares al alterar significativamente los lípidos biliares incrementando el índice de saturación y reduciendo el tiempo de nucleación del colesterol7,13. Nivel de evidencia I.
El tratamiento transdérmico confiere un riesgo sustancialmente menor de colecistitis que la terapia oral RR, 1.17 (IC, 95%: 1.10-1.24) frente a 1.74 (IC, 95%: 1.68-1.80)7,12. Nivel de evidencia I.
Los estrógenos transdérmicos tienen un menor RR de colecistitis que los orales 1.17 (IC, 95%: 1.10-1.24 frente a 1.74 (IC, 95%: 1.68-1.80)12. Nivel de evidencia I.
La terapia transdérmica confiere un riesgo menor de colecistectomía que la terapia oral: RR 1.18 (IC, 95%, 1.10-1.27) frente a 1,80 (IC, 95%: 1.74-1.87), respectivamente 12. Nivel de evidencia I.
La adición de progestágenos a la terapia estrogénica no tiene un efecto importante sobre el RR de la colecistitis12. Nivel de evidencia I.
La tibolona tiene un RR elevado de colecistitis con relación a los estrógenos transdérmicos 1.84 (IC, 95%: 1.69-2.00) frente a 1.17 (IC, 95%: 1.10-1.24)12. Nivel de evidencia I.
Con el aumento en el tiempo de ingesta de TH no hay incremento del RR de colecistitis, el cual permanece estable: menos de 5 años: 1.76 (IC, 95%: 1.68-1.85), de 5 a 9 años: 1.72 (IC, 95%: 0.64 a 1.80) y más de 9 años: 1.77 (IC, 95%: 1.67-1.86)12. Nivel de evidencia I.
Los diferentes RCT muestran mayor riesgo de enfermedad vesicular en mujeres de mayor edad, con sobrepeso y obesas que en pacientes en las que usualmente se prescribe la TH, lo que puede ser un sesgo de selección12. Nivel de evidencia III.
Se deben considerar las decisiones sobre el uso de la TH a raíz de los resultados obtenidos sobre morbilidad y costos generados en la patología vesicular10. Nivel de evidencia III.
Los resultados obtenidos en estos estudios no necesariamente pueden extrapolarse a otros tipos de terapia de estrógenos y otras vías de administración10. Nivel de evidencia III.
Mujeres que presentan cálculos biliares asintomáticos no deben recibir TH debido a la posibilidad de desarrollar una colecistitis12. Nivel de evidencia III.
Según la Preventive Services Task Force (USPSTF), que afirma los efectos nocivos de los estrógenos sin oposición en mujeres histerectomizadas con enfermedades crónicas, es probable que los riesgos superen beneficios en la mayoría de las mujeres14. Nivel de evidencia III, grado recomendación D.
La Preventive Services Task Force (USPSTF) concluye que los efectos nocivos de la combinación de estrógeno y progestina son superiores a los beneficios para la prevención de enfermedades crónicas en la mayoría de las mujeres, por lo cual no deben recibir TH las mujeres posmenopáusicas para prevención de enfermedades crónicas14. Grado de recomendación D.
De acuerdo con los resultados obtenidos en la literatura, se aconseja que a toda mujer en menopausia a quien se le vaya iniciar TH se le debe interrogar sobre enfermedad vesicular, y si hay sospecha se le debe solicitar previamente una ecografía abdominal.
Conflicto de intereses: Los colaboradores de este consenso manifiestan no estar asociados ni tener relaciones económicas con ninguna compañía farmacéutica, aparte de los acuerdos de consultoría, honorarios por disertaciones en reuniones científicas y respaldo de la investigación.
Fuente de financiación. Los costos de redacción de este artículo se han financiado por completo con fondos de la Asociación Colombiana de Menopausia.





