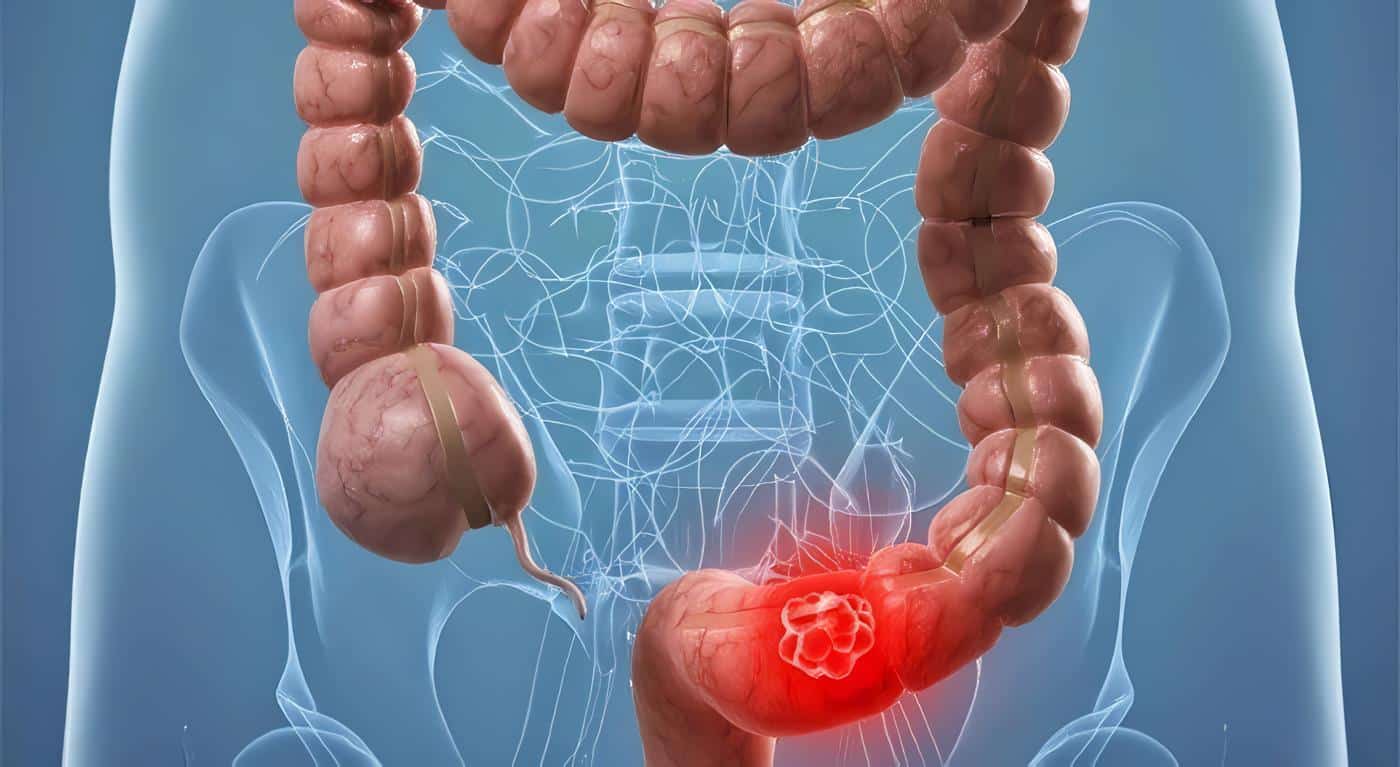
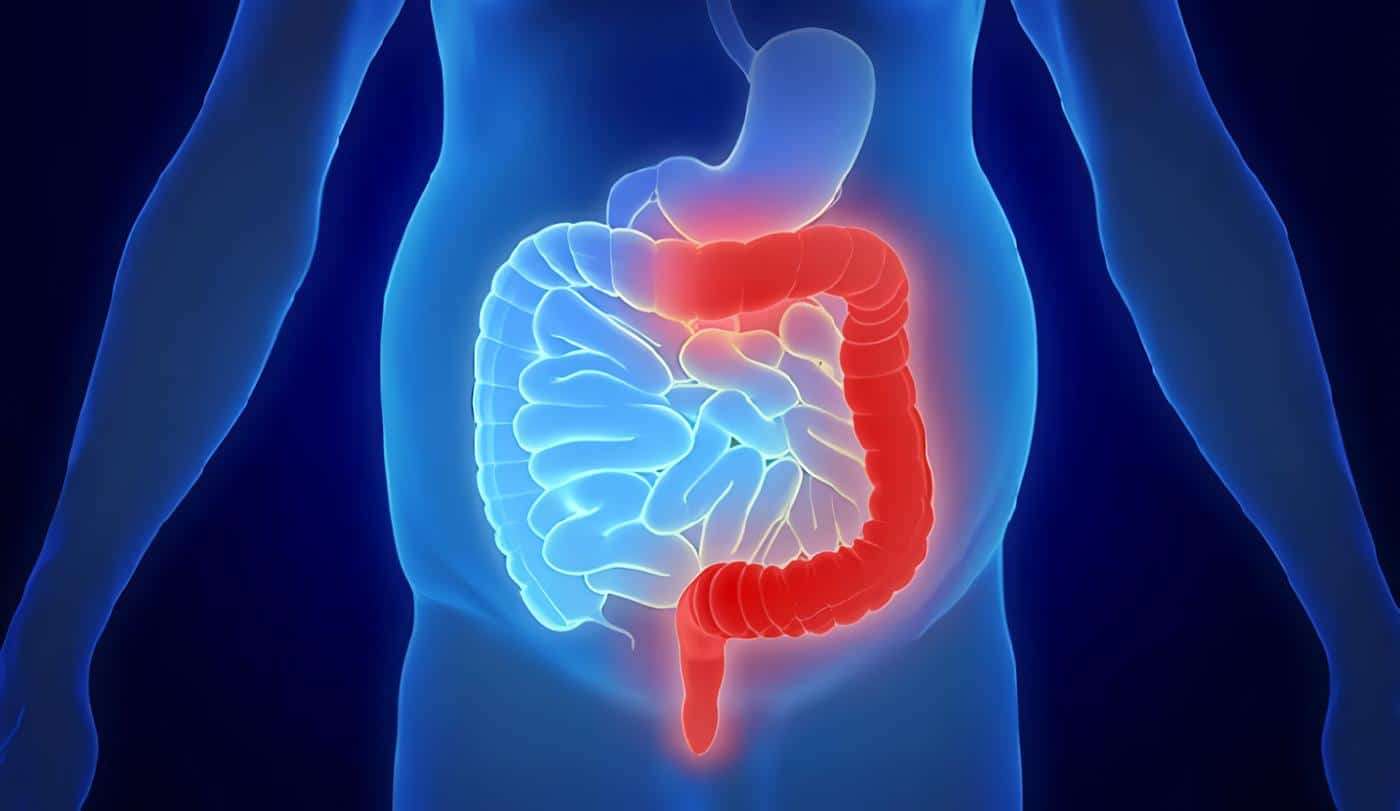
La CU debe ser considerada en pacientes que presentan deposiciones mucosanguinolentas asociado a síntomas y signos constitucionales.
Los principales diagnósticos diferenciales son con las infecciones bacterianas y parasitarias, la colitis isquémica. La colitis actínica y la enfermedad de Crohn así como también debe tenerse en cuenta la inflamación secundaria a la acción del Clostridium difficile.
Recientemente se ha observado una relación entre CU y anticuerpos ciclosplasmaticos antineutrófilos circulantes (ANCA). Éstos se han encontrado en 50 a 80% de los pacientes con CU y colangitis esclerosante primaria asociada o no.
Endoscopia.
La colonoscopia es el mejor procedimiento para el diagnóstico de la CU. Se debe practicar por lo menos una rectosigmoiodoscopia rígida en caso de colitis severa con sangrado masivo, y colonoscopia total en casos de colitis moderada o leve. Siempre se debe de tomar una biopsia para confirmar el diagnóstico endoscópico.
Como la colitis ulcerativa tiene con frecuencia un comportamiento ascendente, el examen de recto y sigmoide basta para establecer el diagnóstico. Pero la colonoscopia es decisiva para determinar su extensión. Los hallazgos endoscópicos ayudan a determinar la actividad de la enfermedad.
Radiología.
En la colitis ulcerativa el colon por enema con doble contraste muestra las mismas lesiones que es posible visualizar por colonoscopia: edema y erosiones. Imagen en sierra o espículas y defectos de llenamiento que representan los seudopólipos. Más tardíamente aparecen úlceras grandes, fibrosis, acartonamiento del colon con pérdida de las haustras, rigidez y aspecto tubular con acortamiento del colon en la etapa crónica.
Diagnóstico de la EC.
La EC debe ser considerada en pacientes que presentan una diarrea crónica o de presentación nocturna, dolor abdominal, obstrucción intestinal y síntomas y signos constitucionales, además de la aparición de fístulas.
Otras enfermedades inflamatorias del intestino deben ser consideradas en su diagnóstico diferencial tales como infecciones, colitis isquémica. Inducidas por radiación o como respuesta a medicamentos principalmente antiinflamatorios no esteroideos.
También deben ser consideradas enfermedades de origen ideopático como la colitis ulcerativa, la enfermedad celiaca y la colitis microscópica y por último el síndrome de intestino irritable. La presencia de leucocitos en las heces confirma la inflamación.
En la presencia de diarrea como presentación inicial o recaída de la enfermedad, las heces deben ser examinadas por patógenos entéricos, principalmente el Clostridium difficile. Estudios serológicos por el Saccharomyces cerevisiae tiene 97% de especificidad en la EC.
Estudios radiológicos.
En la EC el colon por enema y el tránsito intestinal por enteroclisis son los procedimientos radiológicos de elección para confirmar la localización de la enfermedad y sus complicaciones intestinales. La ultrasonografía endoscópica, la tomografía computarizada y la resonancia magnética pueden delinear y discriminar masas intrabdominales, abcesos o complicaciones perianales.
Estudios endoscópicos.
La endoscopia gastrointestinal alta o baja es usada para confirmar el diagnóstico de la EC localización de esta y obtención de tejido para evaluación patológica.
La apariencia endoscópica no se correlaciona con la clínica después de la terapia con corticoides, pero sí existe una estrecha correlación entre los efectos terapéuticos y el mejoramiento de la mucosa con el Infliximab. La biopsia endoscópica puede confirmar el diagnóstico o identificar displasia o cáncer.
(Lea También: Glucocorticoides)
Tratamiento médico de la EII
Hasta que no se consiga identificar las causas de la enfermedad el tratamiento es empírico y se fundamenta en el control de los fenómenos inflamatorios. Los ensayos clínicos realizados han intentado aclarar que los pacientes responden mejor a los diferentes tratamientos utilizados en función de localización, extensión, gravedad y comportamiento clínico.
En la práctica clínica la indicación de su tratamiento se realiza según la gravedad de la actividad inflamatoria y la forma de evolución. En este sentido hay que distinguir si se trata de un ataque inicial y clasificar su severidad de acuerdo a criterios médicos, biológicos, endoscópicos e histológicos.
Determinación de la actividad en la CU (Tabla 1)
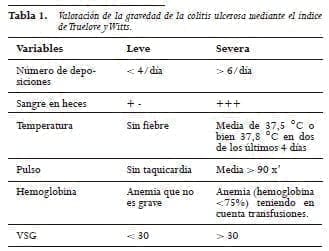
La evaluación de la gravedad de la enfermedad puede hacerse a través de los criterios originales de Truelove y Witts. Los cuales son simples y fáciles de usar y han demostrado ser una guía valiosa de la severidad de la enfermedad a través del tiempo, los cuales se describen a continuación:
Enfermedad leve:
menos de cuatro deposiciones en el día con sangre o sin ella, sin alteraciones sistémicas y con eritrosedimentación normal.
Enfermedad moderada:
más de cuatro deposiciones en el día con alteraciones sistémicas mínimas.
Enfermedad severa:
más de seis deposiciones sanguinolentas por día, evidencia de alteraciones sistémicas como fiebre, taquicardia, anemia o con eritrosedimentación de más de 30.
También son útiles los criterios endoscópicos para conocer la extensión de la enfermedad, y para realizar un seguimiento adecuado en los respectivos controles (Tabla 2).

En cuanto a los datos de laboratorio, la enfermedad activa puede asociarse con un aumento de los reactantes de fase aguda (proteína C reactiva, orosomucoide, la eritrosedimentación globular). También puede haber una disminución de la hemoglobina y la albúmina sérica.
La enfermedad limitada al recto, incluso al rectosigmoide, rara vez causa un aumento de proteína C reactiva a menos que sea particularmente severa.
Evaluación de la actividad en la EC
El índice de actividad conocido es el CDAI (Crohn’s Disease Activity Index). A continuación se describen los grados de actividad:
Enfermedad leve a moderada:
aplica para pacientes ambulatorios que toleran la vía oral sin manifesta ción de deshidratación, toxicidad (fiebre alta, ataque al estado general), dolor abdominal, masa palpable, obstrucción o pérdida mayor de 10 % del peso corporal.
Enfermedad moderada a severa:
aplica para pacientes, los cuales no han respondido al tratamiento de la enfermedad de leve a moderada y que presentan síntomas prominentes como fiebre, significativa pérdida de peso, dolor abdominal, náuseas o vómito intermitente (sin hallazgos obstructivos). Estos pacientes también pueden presentar anemia.
Enfermedad severa y fulminante:
este término se refiere a los pacientes en los cuales persisten los síntomas, a pesar de la introducción de esteroides. O pacientes que presentan fiebre alta, vómitos intermitentes, evidencia de obstrucción, caquexia o evidencia de un abceso.
Remisión:
Se refiere a los pacientes que están asintomáticos o sin secuelas de EII. Además, incluye pacientes que han respondido a una intervención médica aguda o que han sido sometidos a cirugía sin una evidencia de enfermedad residual.
También es útil conocer el término de corticodependencia que se refieren a la recidiva de la enfermedad tras dos intentos de suspensión de corticoides en un intervalo de 6 meses o necesidad de 6 a 15 mg de prednisona al día para mantener la inactividad.
El término corticorresistente se refiere a la persistencia de la actividad inflamatoria o ausencia de mejoría clínica tras un tratamiento con 80 mg por día de prednisona durante 2 meses.
Aminosalicilatos
La sulfasalazina fue inicialmente sintetizada para su empleo en la artritis reumatoide en un intento por combinar la acción antibacteriana de los compuestos de sulfonamidas con la acción antinflamatoria de los salicilatos.
La sulfasalazina está compuesta por sulfapiridina enlazada al ácido 5-Aminosalisílico (5-AAS) por un enlace AZO.
Se absorbe mal en el tracto gastrointestinal superior y es escindida por las azorreductoras de las bacterias del colon en 5-AAS (mesalamina) y sulfapiridina.
La parte 5-AAS del producto parece ser el componente antinflamatorio activo de la sulfasalazina, mientras que la sulfapiridina, que es la responsable de la mayor parte de la toxicidad del medicamento. Actúa sobre todo como transportadora del 5-AAS para impedir su absorción en la parte proximal del intestino delgado y permitir su llegada al colon.
Aunque no se ha definido ningún mecanismo específico de acción de la sulfasalazina y el 5-AAS. Son muy numerosas sus propiedades antiinflamatorias con actividad potencial en la EII.
Se ha prestado particular atención a la cascada de mediadores inflamatorios del ácido araquidónico, en los que el 5-AAS y la sulfasalazina tienen numerosos efectos sobre la síntesis de las prostaglandinas y el tromboxano. La vía de la lipoxigenasa y la inhibición de la sintetasa del factor activador de las plaquetas.
Otros mecanismos de acción de los aminosalicilatos son: inhibición de la producción de radicales libres de oxígeno. El 5-AAS también inhibe la producción de interleuquina 1, altera la función de leucocitos y monocitos y reduce la producción de inmunoglobulinas por las células plasmáticas. Más recientemente se ha encontrado que la sulfasalazina inhibe el Factor de Necrosis Tisular Beta (NFk beta).
Remisión de la EC
En dosis de 2 a 6 g por día la sulfasalazina consigue una mejoría o la remisión de la EC leve a moderada en cerca de 2/3 de estos pacientes.
Además, existe una respuesta a la dosis para el mantenimiento de la remisión, y cerca de 75% de los pacientes con CU. Pueden ser mantenidos en remisión con 2 a 4 g de sulfasalazina al día con una eficacia ligeramente superior para la dosis de 4 g por día (37). A pesar de la eficacia de esta droga, existe una alta incidencia de efectos adversos relacionados con la dosis, los cuales ocurren en 45 % de los pacientes limitando su uso (37, 38).
Se ha reconocido que los principales efectos adversos están relacionados con la sulfapiridina y que el 5-AAS es el componente activo antiinflamatorio.
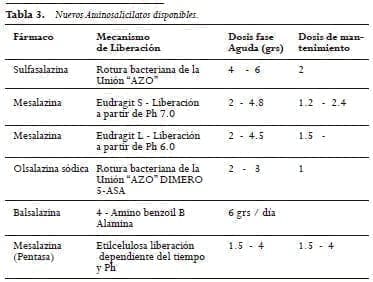
Debido a esto en las dos últimas décadas, el principal esfuerzo se hizo para encontrar alternativas para liberar adecuadamente el 5-AAS.
Esto se consiguió con el revestimiento de la molécula con polímeros acrílicos que dependían del pH. Para su liberación o por el contrario la unión del 5-AAS a otras moléculas transportadoras con menos efectos adversos o inactivas desde el punto de vista farmacológico (Tabla 3).
Estos nuevos aminosalicilatos orales son la droga de elección en pacientes con CU de moderada a severa en muchos países (39). Cerca de 80% de los pacientes tratados tiene una respuesta clínica adecuada al uso de mesalazina con dosis de 2 a 4,8 g al día.
En un metanálisis prospectivo, randomizado, doble ciego se encontró que el 5-AAS fue más efectivo que el placebo en el tratamiento de la CU activa y en el mantenimiento de su remisión.
La incidencia de efectos adversos en los diferentes estudios:
Fue significativamente más frecuente con 5 sulfasalazina que con 5-AAS. Esta diferencia no fue encontrada en el mantenimiento de la remisión sugiriendo que estos pacientes pueden tolerar sulfasalazina con baja dosis (38).
La mayor innovación en el tratamiento de la CU fue la introducción de preparaciones tópicas. Estas preparaciones fueron preferidas para el tratamiento de la CU del lado izquierdo o distal. Estas incluyen supositorios, espumas y enemas líquidos.
La administración del 5-AAS rectal ofrece la ventaja de la liberación y el tratamiento directo en el sitio de máxima inflamación y con el mínimo de efectos adversos.
La dosis adecuada varía entre 1 y 4 g / día. Varios estudios han presentado que el 5-AAS tópico (supositorios y enemas) fueron superiores a la mesalazine oral en el tratamiento de la CU distal o del lado izquierdo con buena tolerancia al medicamento.
La combinación del tratamiento oral y rectal con 5-AAS es más efectiva que con un único agente y es utilizada en pacientes con enfermedad refractaria.
El 5-AAS tiene importancia en el mantenimiento de la remisión. No se ha encontrado ninguna diferencia entre utilizar enemas y supositorios en días alternos o utilizarlos cada tres días (40, 41).
La mesalazina:
Ha sido efectiva en el tratamiento de la EC de leve a moderada, pero ha fallado en el mantenimiento de la remisión. El papel en la prevención de las recaídas postoperatorias fue recientemente refutado y la discusión sigue aún abierta.
La mesalazina ha sido bien estudiada en la prevención de las recaídas postquirúrgicas por Caprile (42) y sus colegas-. Quienes encontraron una reducción de las recaídas de 41 a 18 % desde el punto de vista clínico y endoscópicamente de 85 a 52% en un seguimiento de dos años.
McLeod (43) y colegas trataron 163 pacientes con recesión quirúrgica por EC con 3 g diarios. Después de un seguimiento de tres años, 31% de los pacientes que recibían mesalazina tenían una recurrencia clínica comparado con 41% del grupo control.
Brignola y cols (44) trataron 87 pacientes después de la resección intestinal por complicación de EC con 3 g/día de pentasa o placebo por un año. La frecuencia de severa recurrencia endoscópica fue de 24% en el grupo de la mezalacina y 56% en el grupo placebo. Pero la tasa de recurrencia clínicamente sintomática fue similar.
Lochs (45) y colegas han publicado un estudio randomizado, doble ciego, placebo con mesalazina 4 grs/día en la prevención de la recurrencia clínica en postoperatorio por EC. Un total de 318 pacientes fueron estudiados.
La mesalazina falló en la mejoría de la remisión después de 18 meses de tratamiento. La significación estadística fue alcanzada únicamente en el subgrupo de enfermedad confinada al ileon terminal.
Debido a que la mejoría en la rata de recurrencia es pequeña, se dificulta recomendar la mesalazina en el contexto de un paciente postquirúrgico por EC. Pues aunque es un fármaco muy seguro el costo por su uso rutinario puede ser considerable.