Resultados
Los 39 pacientes estudiados tuvieron un rango de edad entre 19 y 83 años y fueron reunidos en tres grupos: 13 con gastritis superficial, 8 mujeres y 5 hombres (con edades promedios de 43,7 y 47,4 años, respectivamente), 13 con gastritis crónica atrófica, 5 mujeres y 8 hombres (con edades promedios 129 de 57,8 y 67 años, respectivamente) y 13 con úlcera duodenal , 4 mujeres y 9 hombres (con edades promedio de 37,7 y 45,2 años, respectivamente).
El estudio histológico determinó la presencia de H. pylori en el 97,5% de los pacientes. La totalidad de ellos fueron positivos para anticuerpos séricos contra H. pylori, por la técnica de ELISA.
La correlación histológica reveló que el 97,2% de los pacientes fueron positivos por histología para H. pylori, y el 100% de los pacientes, lo fueron por serología demostrando así la buena sensibilidad y la especificidad de la prueba.
Los anticuerpos contra la mucosa gástrica fueron detectados en 5 pacientes de los 39 analizados, dos de los cuales estaban dirigidos contra las células parietales y los tres restantes contra la porción apical de la glándula basal en el cuerpo gástrico (Figuras 1 y 2).

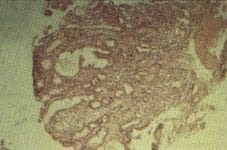
Figura 1. Inmuno.uorescencia indirecta en mucosa gástrica humana, positiva para autoanticuerpos contra la porción apical de las glándulas.

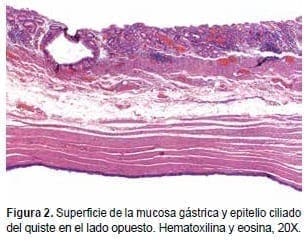
Figura 2. Técnica de inmunoperoxidasa indirecta en mucosa gástrica humana, ositiva para porciones apicales de las glándulas.
No se detectaron anticuerpos contra el antro gástrico en ninguno de los grupos del estudio. Se encontró para el grupo de gastritis superficial un p de 0,5 (p<0,05), para gastritis crónica atrófica un p de 1 (p<0,05) y úlcera duodenal de un p de 0,5 (p<0,05), lo cual revela que no es estadísticamente significativa la presencia de estos anticuerpos.
Se correlacionaron estos hallazgos entre los grupos por la prueba de Mann-Whitney, encontrándose un p de 0,6 (p<0,05) entre gastritis superficial y gastritis atrófica, un p de 1,0 (p<0,05) entre gastritis atrófica y úlcera duodenal y un p de 0,7 (p<0,05) entre úlcera duodenal y gastritis superficial. Estos datos demuestran que no hay significancia entre la relación de resultados de los grupos.
Se detectaron más casos positivos por pruebas heterólogas (estómago de ratón) que por las autólogas (estómago humano), y más por la técnica de inmunoperoxidasa que por la técnica de inmunofluorescencia (Tabla 1).
Tabla 1. Patología gástrica, determinación de Helicobacter pylori y de auto-anticuerpos contra la mucosa gástrica.

ª anticuerpos contra células parietales
* anticuerpos contra la parte apical de las glándulas basales
Discusión
Para que se desarrolle una enfermedad gastroduodenal, se requiere de la participación de múltiples factores tales como la predisposición genética del hospedero, su respuesta inmune, los factores ambientales (dieta, aguas, contaminantes) y los agentes patógenos como Helicobacter pylori (4-8).
Helicobacter pylori es la única bacteria capaz de colonizar, sobrevivir y persistir en un nicho ecológico inhóspito como el medio ácido gástrico. La ureasa bacteriana, su motilidad flagelar y sus moléculas de adhesión son responsables de la colonización (9).
A pesar de la alta prevalencia de la infección, no todas las personas infectadas desarrollan enfermedades y la mayoría permanece asintomática. Se ha postulado que cepas bacteriana de mayor virulencia son las responsables de las enfermedades.
La presencia de cepas de H. pylori que expresan la citotoxina vacuolizante (vacA), que causa daño de las células epiteliales, no es consistente con el desarrollo de enfermedades.
La proteína cagA es el marcador del denominado islote de patogenicidad; tampoco ha tenido suficiente correlación con la presencia de enfermedad gastroduodenal (10).
Algunos estudios han demostrado que la úlcera duodenal, los linfomas gástricos del tipo MALT y el adenocarcinoma gástrico son más frecuentes en pacientes infectados por cepas cagA positivas (11). Sin embargo, estos resultados no se han observado en estudios realizados en nuestro país (12).
En el presente estudio, se observó que la mayoría de los pacientes con atrofia gástrica eran hombres mayores de 50 años, como ya ha sido descrito (4-6).
Los pacientes que resultaron positivos para autoanticuerpos eran mujeres distribuidas en un amplio rango de edad e infectadas con H. pylori. Las enfermedades autoinmunes se desarrollan con mayor frecuencia en mujeres debido quizá a influencias hormonales, concordando esto con lo obtenido en el estudio (13,14).
El diagnóstico histopatológico:
Reveló grados diversos de inflamación en los diferentes pacientes y determinó la presencia de la infección por H. pylori en el 97,5% de las biopsias analizadas. Mediante la técnica de ELISA, se encontró que el 100% de los pacientes tenían anticuerpos contra la bacteria de la clase anti IgG, resultado similar a otros informados en los cuales la seroprevalencia es mayor a la positividad de detección en estudios histológicos, lo que sugiere que estas personas estuvieron infectadas por H. pylori en algún momento de su vida (15).
El 2,5% de los pacientes que no resultaron positivos para la detección de H. pylori por histología, tenían anticuerpos específicos contra proteínas de H. pylori.
Este hallazgo puede deberse a la falta de uniformidad de colonización de la bacteria en la mucosa (en parches) y, por lo tanto, el sitio de toma de la biopsia, muy probablemente, no estaba colonizado, situación que se trató de evitar con la toma de múltiples biopsias (16).
La infección por H. pylori podría producir una reacción autoinmune:
Por el fenómeno de mimetismo molecular con el grupo sanguíneo Lewis (1,17-19) o por otro tipo de mecanismos involucrados en la generación de autonticuerpos (exposición a antígenos anatómicamente secuestrados, regulación deficiente por células T, entre otros) (20,21).
En el presente estudio, se comprueba la presencia de autoanticuerpos contra las células parietales gástricas en el 15% de los pacientes con gastritis superficial infectados con H. pylori y anticuerpos contra la porción de las glándulas basales del cuerpo gástrico en pacientes diagnosticados con úlcera duodenal en el 15% de los casos y en el 7,6% de los pacientes con gastritis atrófica, todos ellos infectados con H. pylori.
Los hallazgos de este estudio concuerdan con lo propuesto por Negrini y colaboradores (2) quienes describieron la existencia de anticuerpos dirigidos contra los canalículos secretores de las células parietales y contra la superficie luminal de las células glandulares del cuerpo gástrico, en pacientes con gastritis asociadas con H. pylori. Faller y colaboradores (20) reportaron también anticuerpos contra la membrana luminal del epitelio foveolar y contra los canalículos secretores de las células parietales.
Ellos proponen que los pacientes infectados con H. pylori y con autoanticuerpos positivos tienen mayor posibilidad de desarrollar atrofia glandular.
En los pacientes con gastritis superficial y úlcera duodenal:
La detección de los autoanticuerpos contra antígenos propios del cuerpo gástrico no está relacionada con procesos atróficos; estos anticuerpos pueden ser el reflejo de una respuesta inmune patológica hacia lo propio y ser la causa del desarrollo de atrofia gástrica posterior (20,22).
La menor detección de autoanticuerpos contra la mucosa gástrica en pacientes con gastritis crónica atrófica pudo deberse a que durante el proceso atrófico se han perdido células constitutivas de las glándulas gástricas y, por lo tanto, no existe el substrato con el cual pueda reaccionar el anticuerpo.
En estas condiciones, los niveles de autoanticuerpos se encuentran disminuidos por una menor respuesta inmunológica y, por esta razón, no es posible detectarlos mediante las técnicas utilizadas en este estudio.
En ninguno de los pacientes analizados se detectó la presencia de anticuerpos contra el antro gástrico, esto posiblemente debido a las diferencias histológicas y moleculares entre el cuerpo y el antro gástricos, las poblaciones linfoides de estas dos regiones son también diferentes pudiéndose encontrar clonos reactivos en el cuerpo gástrico contra antígenos propios que no fueron reconocidos durante la ontogenia de células T (22).
Los resultados del estudio, aunque no son estadísticamente significativos, pueden proveer algún tipo de evidencia sobre la relación entre la aparición de autoanticuerpos contra la mucosa gástrica, el desarrollo de gastritis atrófica y la infección por H. pylori.
De alguna manera, estos autoanticuerpos en estadíos posteriores de la enfermedad pueden producir atrofia y ésta progresar a metaplasia, displasia y cáncer gástrico (2,18).
Se hace necesario ampliar la investigación a una muestra de población mayor para establecer una mejor relación entre la infección por H. pylori, la presencia de autoanticuerpos contra la mucosa gástrica y el desarrollo de atrofia gástrica.
Referencias
- 1. Appelmecck B, Simoons-Smith I, Negrini R. Potential role of molecular mimicry between H. pylori lipopolysaccharide and Host Lewis Blood group antigens in autoimmunity. Infect Immun 1996;64:2031-40.
- 2. Negrini R, Savio A, Poresi C, et al. Antigenic Mimicry between Helicobacter pylori and gastric mucosa in the pathogenesis of body atrophic gastritis. Gastroenterology 1996;111:655.
- 3. Dixon M, Yardley J. Classification and grading of gastritis the update Sydney system. Am J Surg Pathol 1996;20(10):1161-82.
- 4. Ricaurte O, Gutiérrez O. Gastritis crónica. En: Alvarado J, Otero W, Archila PE, Rojas E, eds. Gastroenterología y Hepatología. Santafe de Bogotá: Asociación Colombiana de Endoscopia Digestiva; 1996:294-303.
- 5. Arsmtrong D. Helicobacter pylori infection and dyspepsia. Scand J Gastroenterol 1996;31(supp 215):38-47.
- 6. Atherton J, Covacci A. Pathogenic properties of Helicobacter pylori. The year in Helicobacter pylori 1997;13(supp 1):20-4.
- 7. Graham D, Go M. Helicobacter pylori: Estado actual. Infectología 1994;2:65-9.
- 8. Cave DR. H. Pylori Update. AGA, Syllabus, 2001:25-8.
- 9. Moran AP, Wadstrom T. Pathogenesis of Helicobacter pylori. Curr Opin Gastroenterol 1998:14(Suppl 1): S9- S14.
- 10. Padnis Sh, Ilver D, Janzen L, et al. Pathological significance and molecular characterization of vacuolating toxin gene of Helicobacter pylori. Inf ect Immun 1994;62(5):1557-65.
- 11. Mitchel HM, Hazell Sl, Li Yy, Hu Pj. Serological response to specific H . pylori antigens. Am J Gastroenterol 1996; 91(9):1785-88.
- 12. Citelly D, Henao Sc, Martinez JD, et al. Antibody profiles to Helicobacter pylori in Gastric cancer and peptic ulcer in Colombian population. XVth International Congress of Tropic Medicine and Malaria. Cartagena, August 2000. Abstracts.
- 13. Paul W. Fundamental immunology. Cuarta edición. Lippincott-Raven. 1999:1067-88.
Bibliografías
- 14. Rose N, Conway De Macario E, Fahey J. Friedman H. Manual of clinical laboratory immunology. Cuarta Edición. 1992.
- 15. Wirth Hans-Peter; Yang Manqiao; Peek Richard M; Tham Kyi T, Blaser M. Helicobacter pylori Lewis expression is related to the host Lewis phenotype. Gastroenterology 1997;113:1091-8.
- 16. Theofilopoulos A. The basis of autoimmunity: part 1, mechanisms of aberrant self recognition. Inmunol Today 1995;16(2):90-8.
- 17. Peter W, Yang M, Peek R, Tham K, Blaser J. Helicobacer pylori Lewis expression is related to the host Lewis phenotype. Gastroenterology 1997: 113;1091-8.
- 18. Otero W, Gutiérrez O. Helicobacter pylori, mecanismos de infección y de lesión de la mucosa gástrica. Rev Colomb Gastroenterol 1997 Vol XII (4):187-95.
- 19. Karnes We, Samloff Im, Siurala M, Kekki P, Sipponen Swr. Positive serum antibody and negative tissue stainning for Helicobacter pylori in subjects with atrophic body gastritis. Gastroenterology 1991; 101:167-74.
- 20. Faller G, Steininger H. Antigastric autoantibodies in Helicobacter pylori infection complications of histological and clinical parameters of gastrtis. Gut 1997;41:619-23.
- 21. Morris A, Ali Mr, Brown P. Campylobacter pylori, infection in biopsy specimens of gastric antrum. Laboratory diagnosis and stimation of sampling error. J Clin Pathol 1989;42:727-32.
- 22. Janeway C, Travers P. Immunobiology, the immune system in health and disease. Current biology limited 1994;11:14- 11-29.
Correspondencia
Sandra C. Henao R.
Cr. 19 No. 90-47 Apto.404
Tel: 6233923
Email: edsanchealatino.net.co.