Mutación del Gen de la Menina
Desde el Hiperparatiroidismo Familiar Aislado a la Neoplasia Endocrina Múltiple de Tipo 1
LUCÍA BEATRIZ TABOADA1, ALONSO VERA2, WILLIAM KATTAH3, ROCÍO LÓPEZ4,
VILMA LUCÍA MEDINA5, DEYANIRA GONZÁLEZ6
Palabras clave: menina; neoplasia endocrina múltiple; hiperparatiroidismo primario; prolactinoma; carcinoma neuroendocrino
Resumen
La menina es una proteína supresora de tumor codificada por el gen MEN1, cuya mutación produce procesos neoplásicos en múltiples tejidos del organismo que pueden manifestarse por generaciones como síndromes familiares. La mutación genera un espectro de enfermedad que va desde el hiperparatiroidismo familiar aislado hasta la neoplasia endocrina múltiple de tipo 1, caracterizada por neoplasias de paratiroides, hipófisis anterior, páncreas endocrino y duodeno, entre otras.
Como ejemplo, se presentan dos casos de pacientes con neoplasias endocrinas secundarias a la mutación del gen MEN1. Se revisa la información actual sobre la etiopatogenia y carcinogénesis entendidosapenas recientemente, al igual que otras mutaciones involucradas en los síndromes neoplásicos expuestos y se dan unas recomendaciones finales.
Introducción
Los síndromes neoplásicos hereditarios son responsables del 5 al 10% de todos los cánceres, aproximadamente (1). En la mayoría de los casos se producen por una mutación que inactiva un gen de supresión tumoral y pocos casos se deben a mutaciones que activan oncogenes. Entre los síndromes neoplásicos hereditarios, se hallan los causados por la mutación del gen MEN1 que codifica para la menina, una proteína supresora de tumores. En la mayoría de los casos, su mutación lleva a la aparición de la neoplasia endocrina múltiple de tipo 1; sin embargo, se han encontrado mutaciones en el gen MEN1 en pacientes con hiperparatiroidismo familiar aislado (2).
La neoplasia endocrina múltiple de tipo 1 es un síndrome genético, autosómico dominante con una alta penetrancia, estimada en 80% a los 50 años de edad; la mayoría de los pacientes se diagnostican al final de la juventud (3). Se caracteriza principalmente por neoplasias de glándula paratiroides, hipófisis anterior, páncreas endocrino y duodeno. También, puede asociarse con tumores neuroendocrinos de pulmón, tubo digestivo y timo, tumores de corteza suprarrenal, lipomas múltiples y angiofibromas (4).
La presentación clínica de esta enfermedad es muy diversa y depende en gran parte del tejido endocrino afectado; la condición más comúnmente expresada es el hiperparatiroidismo primario, que está presente en alrededor de 95% de los pacientes (5), mientras que el porcentaje de pacientes con neoplasia endocrina múltiple de tipo 1 en pacientes con hiperparatiroidismo primario, es de 1 a 5% (6).
Para el diagnóstico de la neoplasia endocrina múltiple de tipo 1, se requiere la presencia de tumor en dos de los tres principales órganos endocrinos relacionados (paratiroides, tejido endocrino enteropancreático, pituitaria anterior) y se considera un síndrome familiar si hay, al menos, un caso de pariente en primer grado con mínimo uno de los tumores principales (7).
Por su parte, el hiperparatiroidismo familiar aislado se define como hiperparatiroidismo hereditario sin otras neoplasias o endocrinopatías asociadas; su forma de herencia es autosómica dominante y se caracteriza por tumores paratiroideos benignos únicos o multiglandulares (8). Se presenta usualmente en una edad más temprana y corresponde sólo a 1% de los casos de hiperparatiroidismo (9).
Las bases genéticas de esta enfermedad están menos claras. Las mutaciones en diversos genes pueden llevar a esta condición, entre ellas, la mutación de MEN1, aunque en muchos casos no se ha logrado identificar el gen causante.
Nuestro objetivo fue revisar la información actual relacionada con el mecanismo de carcinogénesis involucrado en la mutación del MEN1, la etiopatogenia del hiperparatiroidismo familiar aislado asociada a este trastorno y otras alteraciones genéticas presentes en la neoplasia endocrina múltiple de tipo 1, y presentar como ejemplo dos casos clínicos de tumores endocrinos originados por mutaciones en el gen MEN1, el primero correspondiente a hiperparatiroidismo familiar aislado y el segundo, a neoplasia endocrina múltiple de tipo 1.
Descripción de los Casos
Caso 1: Hiperparatiroidismo Familiar Aislado
Se trata de una mujer de 54 años con antecedentes de hipotiroidismo primario e hiperparatiroidismo primario recidivante, diagnosticado en el año 2000, que requirió paratiroidectomía en 2001 y confirmó un adenoma de la glándula paratiroides inferior izquierda; en 2002, por persistencia de hipercalcemia, requirió otra intervención que demostró un nuevo adenoma.
En 2003, ingresó para control y se encontraron niveles de parathormona (PTH) de 91,5 pg/ml (valor normal, 15 a 68 pg/ml), de calcio ionizado de 1,29 mmol/L (valor normal, 1,16 a 1,32 mmol), de TSH de 18,3 mUI/ml (valor normal, 0,4 a 4,0 mlU/L) y densitometría ósea normal, medida por DXA (Dualenergy X-ray Absorptiometry).
Se inició tratamiento con carbonato de calcio, 1.500 mg dos veces al día, hasta junio de 2008, cuando se consideró que la paciente cursaba nuevamente con hiperparatiroidismo activo leve debido a niveles elevados de paratohormona (91 pg/ml), hipercalcemia leve (10,4 mg/dl) y densitometría ósea con discreta disminución de la masa ósea al compararla con las previas.
En la gammagrafía de paratiroides se encontró un adenoma paratiroideo por debajo del polo inferior del lóbulo izquierdo de la tiroides.
Fue llevada a junta médica en julio de 2008, en la que determinaron no practicar intervención quirúrgica en el momento, debido a que la enfermedad no tenía gran relevancia clínica, y se dejó en seguimiento. Se completaron los estudios que mostraron niveles normales de 25 OH vitamina D en 36,3 ng/ml y se investigó la posibilidad de una neoplasia endocrina múltiple de tipo 1, la que se descartó mediante resonancia magnética (RM), en la que se observó una hipófisis normal, y los niveles de prolactina y somatomedina C fueron normales. La tomografía computadorizada (TC) de abdomen fue normal y no había manifestaciones clínicas de aumento de la producción de hormonas pancreáticas (hipoglucemia, hipergastrinemia, entre otros).
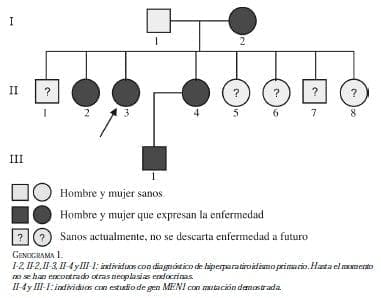
En marzo de 2010, a un sobrino de la paciente, con hipercalcemia por hiperparatiroidismo primario, se le confirmó la mutación en el gen MEN1.Posteriormente, se confirmó la misma mutación en la paciente y su hermana. En el estudio de sangre periférica se identificó la variante familiar MEN1:c.665A>C en el exón 4 del gen MEN1 en estado heterocigoto mediante GENDIA Genetic Diagnostic Network.
Esta substitución es una variación “sin sentido”; se predice que conduce a la substitución de una tirosina por una serina en la posición del aminoácido 222 de la proteína resultante MEN 1 (MEN1: pTYR222Ser).
La variante MEN1: c.665A>C es nueva y no ha sido descrita previamente en otros pacientes ni controles. Por esta razón, su significancia clínica no es aún clara.
Con este hallazgo, se confirmó la presencia de hiperparatiroidismo familiar y se advirtió la posibilidad de que, potencialmente en el tiempo y de manera asincrónica, puedan aparecer otro tipo de neoplasias de hipófisis anterior y de páncreas, por lo cual es necesario el control anual permanente de las personas afectadas y de los no afectados cada tres años. Actualmente, la enfermedad la presentan ocho hermanos, la madre y un sobrino de la paciente (genograma 1), y no se han demostrado hasta el momento otras neoplasias endocrinas en esta familia.
La paciente cursa con niveles normales de calcio ionizado y paratohormona persistentemente elevada pero estable. En los últimos exámenes de laboratorio, tomados en abril de 2010, se encontró calcio ionizado de 1,32 mmol/L, PTH de 128 pg/ml, gastrina de 15,7 pg/ml (normal); RM de silla turca, normal; en la TC de abdomen y pelvis se observaron quistes hepáticos simples, sin lesiones sospechosas de enfermedad de páncreas ni de las suprarrenales.
Caso 2: Neoplasia Endocrina Múltiple de Tipo 1
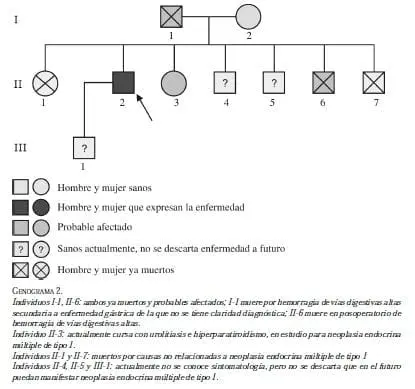
Se trata de un hombre de 48 años con historia de carcinoma neuroendocrino de páncreas, metastásico a hígado, diagnosticado en 2007 y tratado con múltiples esquemas de quimioterapia, sin buenos resultados, que ingresó en septiembre de 2009 para nuevas propuestas terapéuticas.
Entre los antecedentes, presentaba gastritis crónica de varios años de evolución, hipotiroidismo primario en tratamiento con suplemento, hipertensión arterial en tratamiento con losartán e historia de urolitiasis con litotripsia renal izquierda. En el 2008, se le resecó un lipoma en la región abdominal. En ese mismo año, se visualizó en la TC de tórax un nódulo pulmonar izquierdo de 15 mm, con características benignas.
Entre los antecedentes familiares, el padre murió a los 40 años por hemorragia de vías digestivas altas, la madre de 70 años estaba viva, con hipertensión arterial sistémica y cardiopatía. De los seis hermanos, uno murió durante el posoperatorio por una úlcera péptica perforada a los 24 años, una hermana murió por cáncer genitourinario metastásico a columna a los 50 años, y en el momento, una hermana de 37 años presentaba urolitiasis e hiperpartiroidismo primario en estudio por posible neoplasia endocrina múltiple de tipo 1. Tenía un hijo sano en el momento (genograma 2).
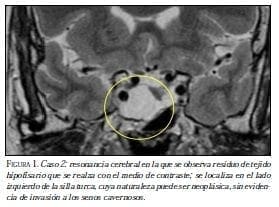
Con la historia clínica descrita, se sospechó una neoplasia endocrina múltiple de tipo 1, se caracterizó desde el punto de vista de las hormonas y se hicieron los estudios radiológicos correspondientes. Las imágenes de la RM cerebral revelaron un macroadenoma hipofisiario y el panel de hormonas hipofisiarias mostró elevación de prolactina, sin compromiso de las otras líneas hormonales (figura 1). El valor máximo de prolactina fue de 350 ng/ml, para lo cual se inició cabergolina hasta requerir 0,5 mg dos veces semanales para control hormonal.
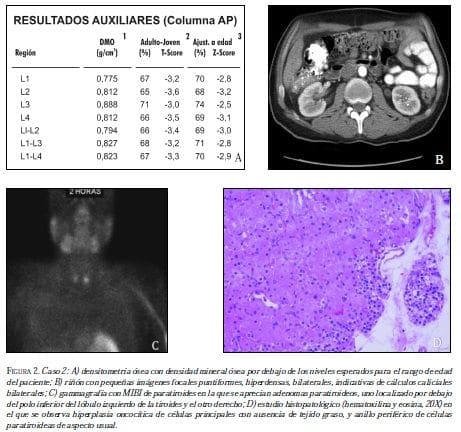
La densitometría ósea DXA demostró deterioro de la masa ósea asociado a urolitiasis por hiperparatiroidismo primario, con niveles elevados de PTH y calcio ionizado (172,80 pg/ml y 1,67 mmol/L, respectivamente), y nivel normal de 25 OH vitamina D en 33,5 ng/ml (figuras 2A y 2B); se inició corrección de la hipercalcemia con hidratación y bisfosfonatos orales. La gammagrafía con 99mTecnecio-sestamibi de paratiroides mostró adenomas paratiroideos, uno localizado por debajo del polo inferior del lóbulo izquierdo de la tiroides y el otro en el lado derecho (figura 2C).
Se resecaron cuatro glándulas paratiroides y se reimplantó una de ellas en el cuello, en febrero de 2010, con hallazgos patológicos correspondientes a cambios por hiperplasia. Se descartó neoplasia paratiroidea y la coloración de rojo Sudán confirmó el diagnóstico (figura 2D).
En la TC de abdomen y la gammagrafía con octreótido se observó una masa pancreática metastásica a hígado (figuras 3A y 3B). En la biopsia hepática se reportó un carcinoma neuroendocrino metastásico, con reacción intensa de células tumorales para la somatostatina y la sinaptofisina y CAM 5.2 (figura 3C), ocasionales células tumorales reactivas para cromogranina, con resultados negativos para serotonina, glucagón, CDX2, insulina, factor VII y CD34, e índice de proliferación celular por Ki 67 de 5%.
En julio de 2010, el paciente fue intervenido para metastasectomía hepática y pancreatectomía distal más esplenectomía. El estudio de histopatología reportó un carcinoma neuroendocrino bien diferenciado, con tamaño tumoral de 5,3 x 4,5 x 4,0 cm y reacción de las células tumorales para cromogranina, sinaptofisina, CAM5.2, CK19 difusa e intensa, Ki-67 del 20%, y conteo mitótico 3 por 10 campos de gran aumento, negativo para glucagón, somatostatina e insulina. En el parénquima pancreático no tumoral se encontraron múltiples microadenomas de las células de Langerhans, que medían entre 0,4 y 0,5 cm, y que igualmente presentaban reacción con la cromogranina y la sinaptofisina.
Mediante análisis de las mutaciones por secuencia directa de la región codificante del MEN1 en sangre periférica, se encontró una mutación deletérea c619 del ACAG en el exón 3, la cual conduce a la pérdida de cuatro pares de bases (ACAG) correspondientes al codón 210 (ACA) y a la primera base del codón 211 (GTC), generando un codón de parada 13 tripletas delante de la deleción. Actualmente, se tiene controlada la hipersecreción hormonal y no hay enfermedad en progresión (tabla 1).
1 Estudiante de Medicina, X semestre, Universidad de los Andes, Bogotá, D.C., Colombia.
2 Jefe, Servicio de Trasplante Hepático y Cirugía Biliopancreática, Hospital Universitario Fundación Santa Fe de Bogotá, Bogotá, D.C., Colombia.
3 Jefe, Servicio de Endocrinología, Hospital Universitario Fundación Santa Fe de Bogotá, Bogotá, D.C., Colombia.
4 Departamento de Patología, Hospital Universitario Fundación Santa Fe de Bogotá, Bogotá, D.C., Colombia.
5 Grupo de Genética y Oncología Molecular, Instituto Nacional de Cancerología, Bogotá, D.C., Colombia.
6 Servicio de Endocrinología, Hospital Universitario Fundación Santa Fe de Bogotá, Bogotá, D.C., Colombia.
CLIC AQUÍ Y DÉJANOS TU COMENTARIO