A pesar de los avances en el diagnóstico y manejo de los pacientes con LGP, persiste la controversia sobre cuál es la mejor forma de tratamiento; hay varias opciones terapéuticas. El objetivo del tratamiento debe ser lograr la máxima sobrevida con la mejor calidad de vida, mínima morbilidad y menor costo para el paciente y la sociedad.
Aunque en definitiva no se conoce cuál es la etiología del LGP, se ha postulado una asociación con varios factores como los virus de Epstein Barr, el virus linfotrópico de células T, el citomegalovirus, herpes, hepatitis C, VIH, enfermedades inmunológicas como el síndrome de Sjögren, enfermedad inflamatoria intestinal, medicamentos, entre otros (1). También se han identificado algunas alteraciones como trisomías 3, 7 y 12 (17) que aunque no aparecen constantemente, sugieren un factor etiológico genético.
Tanto los síntomas como los signos clínicos son inespecíficos y no permiten hacer el diagnóstico de LGP. La endoscopia de vías digestivas altas con biopsia seguida de un completo estudio histológico, que incluya marcadores específicos, siguen siendo la base para el diagnóstico. Recientemente la ecoendoscopia ha desempeñado un papel importante como método diagnóstico, dado el compromiso submucoso de la enfermedad.
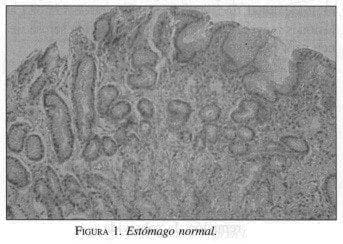
Se considera que en estado normal no existe un tejido linfoide organizado en el estómago (17,27) (figura 1). Para que se genere un linfoma es necesario que el estómago adquiera un MALT que posteriormente pueda sufrir una transformación neoplásica. Se ha postulado que el H. pylori, dado que produce una infección crónica, puede ser el responsable del MALT en el estómago (17, 28,29).
Frecuentemente se ha encontrado en los linfomas extranodales la presencia de un proceso inflamatorio crónico que podría corresponder a una condición preexistente a la lesión o ser parte innata de ella. Está constituido por un conglomerado linfocitario, cuyas células predominantes son linfocitos B, que luego de un estímulo antigénico dan origen al linfoma.
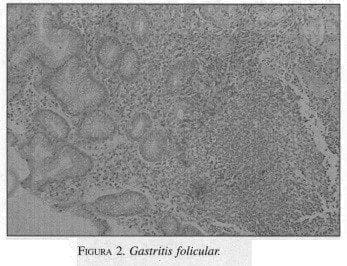
Es por esto que el LGP se puede entender como una patología que se inicia desde un proceso inflamatorio, como corresponde a una gastritis crónica, encontrando un infiltrado linfoide anormal en la pared gástrica, especialmente de tipo folicular. Esto es lo característico de la infección por H. pylori (figura 2).
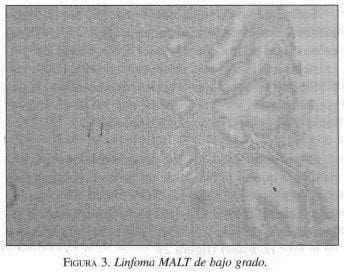
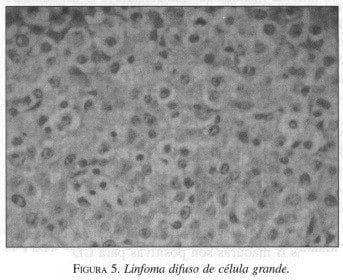
El proceso es dinámico y progresa a infiltrado difuso linfoide monoclonal que constituye el denominado linfoma MALT de bajo grado (figura 3), y para lo cual se requiere una serie de eventos genéticos, que sumados a una invasión de las glándulas por células linfoides o lesiones linfoepiteliales (figura 4), llegan a la sustitución completa de las glándulas por tejido linfoide tumoral, esto es lo que se denomina linfoma MALT de alto grado (figura 5).
 |
 |
El estudio inmunohistoquímico es fundamental para definir el tipo celular y por ende el pronóstico; son muy útiles los marcadores inmunológicos, dentro de los cuales los más usados son el CD 3, CD 5, CD 19, CD 20. La mayoría de las neoplasias provenientes de células B maduras son positivas para CD 19 y CD 20 (30).
La figura 6 muestra el sistema de mapeo que utiliza el HUSI para realizar el estudio histopatológico completo de los pacientes con LGP. En este caso en particular, se realizaron 75 cortes histológicos.

Desde la introducción del concepto de MALT a comienzos de los años 80, como un subtipo de linfoma B extraganglionar (27), ha persistido la controversia sobre la mejor forma de tratamiento del LGP. La literatura actual es confusa y en ocasiones contradictoria, y la mayoría de las publicaciones se basa en un número reducido de casos y no en estudios controlados.
Los principales factores que influyen en el pronóstico del LGP son: grado de penetración de la pared, multifocalidad, tipo histológico y tamaño del tumor. Las lesiones mayores de 5 cm o que invadan la serosa tienen peor pronóstico (20).
Es así como aquellos linfomas considerados de bajo grado, o en estadios IE o IIE, pueden tener mejor pronóstico y sobrevida a largo plazo; la presencia de H. pylori es fundamental en el momento de definir la terapia para realizar.
La estrecha relación entre el H. pylori y el LGP ha permitido adoptar estrategias de tratamientos fundamentadas en el porcentaje de remisión, la sobrevida y la disminución de la recidiva tumoral. Es así como todo paciente con diagnóstico de linfoma de bajo grado y presencia de H. pylori inicialmente se trata con medicamentos para erradicar el microorganismo. Estudios clínicos con cerca de 400 pacientes y reportes de casos han mostrado que la erradicación del H. pylori se asocia a remisión del linfoma MALT de bajo grado en aproximadamente el 80% de los pacientes (17).
Si no hay respuesta o no es posible determinar la presencia de esta bacteria, el tratamiento más aceptado es la cirugía. El manejo quirúrgico consiste en la extirpación del tumor con suficientes márgenes de tejido sano y con una disección ganglionar D2. Esto se logra con una gastrectomía subtotal en el 35% de los casos, especialmente en los que el tumor es único, exofitico y localizado en el tercio distal del estómago. En los tumores multifocales o más extendidos es necesario practicar una gastrectomía total (10,14).
En el manejo del linfoma de alto grado se han encontrado varias estrategias terapéuticas; sin embargo, es la radioterapia con posterior cirugía y quimioterapia la que ha demostrado ser de mayor efectividad. El tratamiento de erradicación del H. pylori, previo a esta modalidad, se basa en la posibilidad de influenciar componentes de bajo grado de malignidad (figura 7).

En general los estados avanzados de LGP (IIIE y IVE) requieren un tratamiento combinado de quimioterapia y radioterapia y muy rara vez es posible o está indicada la cirugía; ésta desempeña un papel en la toma de muestras o en la corrección de complicaciones como perforaciones u obstrucciones. En estos casos la tasa de curación es de menos del 40% (30).
En la mayoría de los casos el tratamiento varía de acuerdo a la especialidad que trate al paciente y no hay evidencia de que una forma sea superior a la otra. De todas maneras la cirugía sigue cumpliendo un papel importante en el manejo de los pacientes con LGP. Hasta el momento, la mayor sobrevida se obtiene cuando se la incluye en el esquema terapéutico (10,21). Una de las dificultades que se presenta cuando se elige un tratamiento no quirúrgico es que, si bien es cierto que los métodos de imágenes diagnósticas, como la TAC y la ecoendoscopia han mejorado notablemente, aún no permiten una adecuada estadificación del tumor, dado que ésta, al menos por ahora, solamente se logra con un estudio histopatológico.
Los principales factores que influyen en el pronóstico del LGP son el grado de la penetración de la pared, que empeora cuando la serosa se invade, la multifocalidad, el tipo histológico, y el tamaño del tumor, que es peor cuando pasa de 5 cm (20).
Es así, como aquellos linfomas considerados de bajo grado, o estadios IE o IIE, pueden tener un mejor pronóstico y sobrevida a largo plazo; la presencia de H. pylori es fundamental en el momento de definir la terapia que se va a realizar.
Un estudio multicéntrico alemán (18), que incluía pacientes con cirugía o tratamiento conservador, a criterio del médico pero sin aleatorización, está a favor del tratamiento conservador, entendiendo por esta radioterapia o quimioterapia pero sin cirugía.
Un estudio francés (19) incluyó 54 pacientes que en forma prospectiva se sometieron a cirugía, siempre que ésta se pudiera realizar en forma segura, y todos recibieron quimioterapia; no hubo aleatorización y los resultados fueron: respuesta completa en el 67% de los pacientes con linfoma de alto grado y 89% aquellos que el linfoma era de bajo grado. Luego de ocho años de seguimiento los porcentajes de sobrevida libre de enfermedad fueron 84 y 94% respectivamente.
Un estudio multicéntrico austro-alemán (20) no aleatorizado pero siguiendo un estricto protocolo, en el que los pacientes con linfoma IE y H. pylori positivo se trataban médicamente y si se erradicaba la bacteria continuaban bajo estrecha observación. En los que no se lograba erradicar o se encontraban en estado IIE, o en los que no se encontraba el H. pylori, se sometían a cirugía; de éstos los que tenían bajo riesgo, es decir, si el tumor medía menos de 5 cm, no era multifocal o no comprometía la serosa, continuaban en observación y el resto era irradiados. A todos se les administró quimioterapia postoperatoria.
Los autores concluyen que la sobrevida a dos años es similar para todos los grupos en el linfoma de bajo grado (89 – 96%) y que en el de alto grado la sobrevida es mayor en pacientes a los que se les practicó resección macroscópica completa del tumor (83 – 88%), comparada con aquellos en los que quedó tumor residual macroscópico, que fue del 53%.
Finalmente, el único estudio prospectivo aleatorizado (21) que se encontró en las bases de datos consultadas, asigna 75 pacientes a tres grupos: cirugía sola, cirugía con quimioterapia adyuvante y radioterapia preoperatoria, seguida de cirugía y quimioterapia. Los resultados de sobrevida a cinco años fueron 51% para el primer grupo, 79% para el segundo y 100% para los pacientes sometidos radioterapia preoperatoria y quimioterapia después de la cirugía. Desafortunadamente el estudio no contempla un grupo de pacientes con tratamiento no quirúrgico, y aunque la asignación a cada grupo no se hizo al azar, al analizarlos son comparables en términos demográficos, de mortalidad y de morbilidad.
El anterior análisis nos permite concluir que la mejor evidencia disponible, hasta el momento, es que el tratamiento ideal para el LGP es la radioterapia, a una dosis de 5 Gy diarios hasta completar 25 – 30 Gy, seguida de cirugía radical 24 a 48 horas después de terminada la radioterapia y luego quimioterapia con régimen de ciclofosfamida, vincristina y prednisona (COP) o ciclofosfamida, vincristina clorbutin y prednisona (COPP) a intervalos de 24 a 28 días durante seis a ocho ciclos.
Es importante la realización de estudios controlados con grupos que incluyan o no incluyan cirugía, así como también tener en cuenta los efectos secundarios, tanto de la quimio como de la radioterapia.
Abstract
Our group hereby presents a report on primary gastric lymphomas treated at San Ignacio University Hospital in the period January 1, 1990 to June 30, 2003. The series comprises 23 patients, corresponding to 7.9% of all malignant gastric tumors; there were 13 males and 11 females, with mean age of 58 years. Principal presenting symptoms were pain, hemorrhage, anemia, and weight loss. Diagnosis was established by endoscopy, biopsy and hisptopathology; 20 cases were of the diffuse gastric lymphoma type and four were MALT lymphomas. A literature review reveals that the best survival rates are obtained with surgical treatment alone or combined with other therapeutic modalities, although radiotherapy and chemotherapy exhibit good survival rates; we have found no controlled studies comparing surgery with other treatment modalities. Best available evidence comes from a controlled randomized study, that shows that the optimal treatment for primary gastric lymphoma is preoperative radiotherapy followed by radical surgery and chemotherapy.
Key words: gastrectomy, limphoma in mucosa associated limphoid tissue.
Referencias
l. VELASCO M, CONCEPCIÓN L, JONES D. Primary gastric and intestinallymphomas. En: Kelsen D, Daly J, Kem S, Levin B (eds.) Gastrointestinal Oncology. Lippincot Williams & Wilkins. Philadelphia, 2002, p.899.
2. Shutze WP, Halpern NB. Gastric lymphoma. Surg Gynecol Obstet 1991; 172: 33-38.
3. Stephens J, Smith J. Treatment of primary gastric lymphoma and gastric mucosa-associated lymphoid tissue lymphoma. J Am Coll Surg 1998; 187: 312-320.
4. Faria RE, Morais JC, Silva AC, et al. Gastric Malt lymphomas: clinical and pathological study of 30 patients submitted to a gastrectomy. J Bras Patol 1998; 34: 286-295.
5. Martínez O. Linfoma gástrico primario. Acta Médica Colombiana 1991;16: 88-93.
6. Velasco B, Gutiérrez O, Ricaurte O y col. Aspectos clínicos, endoscópicos e histológicos de pacientes con linfoma gástrico primario de tejido linfoide asociado a mucosas (MALT). Rev Colomb Gastroenterol 1997; 12: 125-134.
7. Schechter NR, Yahalom J. Low-grade Malt lymphoma of the stomach: A review of treatment options. Int J Radiation Oncology Biol Phys 2000; 46: 1093-1103.
8. Kodera Y, Yamamura Y, Nakamura S, et al. The role of radical gastrectomy with systematic lymphadenectomy for the diagnosis and treatment of primary gastric lymphoma. Ann Surg 1998; 227: 45-50.
9. Pisano R, Llorens P, Levy I y col. Linfoma gástrico primario. Análisis de 86 casos. Rev Med Chile 1994;122:1031-1036.
10. Sano T, Sasako M, Kinoshita T, et al. Total gastrectomy for primary gastric lymphoma at stages IE and IIE: A prospective study of fifty cases. Surgery 1997; 121: 501-505.
11. Schechter N, Portlock C, Yahom J. Treatment of mucosa-associated lymphoid tissue lymphoma of the stomach with radiation alone. Journal of Clinical Oncology 1998; 16: 1916-1921.
12. Tsang RW, Gospodarowicz MK, Pintilie M, et al. Stage I and II Malt lymphoma: Results of treatment with radiotherapy. Int J Radiation Oncology Biol Phys 2001; 50: 1258-1264.
13. Hsu C, Chen C, Chen L, et al. Comparison of Malt and non-Malt primary large cell lymphoma of the stomach. Does histologic evidence of Malt affect chemotherapy response? Am Ca Soc 2001; 91: 49-56.
14. Raderer M, Valencak J, Österreicher C, et al. Chemotherapy for the treatment of patients with primary high grade gastric B-cell lymphoma of modified ann arbor stages IE and IIE. Am Ca Soc 2000; 88: 1979-1985.
15. Sonnen R, Catavrezos A, Grim HA, et al: Combined Chemo-and radiotherapy of localized gastric lymphoma. Dtsch Med Wschr1994;119: 863-868.
16. Bartlett D, Karpeh M, Filippa D, et al. Long-term follow –up after curative surgery for early gastric lymphoma. Ann Surg 1996; 223: 53-62.
17. Morgner A, Bayerdörffer E, Neubauer A, et al. Malignant tumors of the stomach. Gastric mucosa-associated lymphoid tissue lymphoma and Helicobacter pylori. Gastroenterol Clin of North Am 2000; 29: 593-607.
18. Koch P, Del Valle F, Berdel W, et al. Primary gastrointestinal non-Hodgkin’s lymphoma: II. Combined surgical and conservative or conservative management only in localized gastric lymphoma-results of the prospective german multicenter study GIT NHL 01/92. J Clin Onc 2001; 19: 3874-3883.
19. Vaillant JC, Ruskoné-Fourmestraux A, Aegerter P, et al. Management and long-term results of surgery for localized gastric lymphomas. Am J Surg 2000; 179: 216-222
20. Fischbach W, Dragosics B, Kolve-Goebeler ME, et al: primary gastric B-cell lymphoma: Results of a prospective multicenter study. Gastroenterology 2000; 119: 1191-1202.
21. Shchepotin IB, Evans SRT, Shabahang M, et al. Primary non-Hodgkin’s lymphoma of the stomach: Three radical modalities of treatment in 75 Patients. Ann Surg Onc 1996; 3: 277-284.
22. Alvarado J, Hani A, Quintana H y col. Linfoma gástrico primario. Universitas Médica 1991;32:103-109.
23. López F, Llanos O, Guzmán S y col. Linfoma no Hodgkin del estómago evaluación del tratamiento quirúrgico en 24 pacientes. Rev Med Chile 1994; 122: 1378-1384
24. Rodríguez-Sanjuán JC, Álvarez-Cañas C, Casado F, et al. Results and prognostic factors in stage IE – IIE primary gastric lymphoma after gastrectomy. J Am Coll Surg 1999; 188: 296-303.
25. Fung CY, Grossbard ML, Younger J. et al. Mucosa associated lymphoid tissue lymphoma of the stomach. Cancer 1999; 85: 9-17.
26. Galindo F, Kogan Z, Cabanne AN y col. Linfoma gástrico primario y cirugía. Rev Argent Cirug 2001; 80: 36-48.
27. Isaacson P, Wright DH. Extranodal malignant lymphoma arising from mucosa-associated lymphoid tissue. Cancer 1984; 53: 2515-2524.
28. Correa P. Impacto social de la infección por Helicobacter pylori en Colombia. Academia Nacional de Medicina de Colombia, Sesión Solemne junio 3, 1999.
29. Arista-Nasr J, Jiménez-Rosas F, Uribe-Uribe N, et al. Pathological disorders of the gastric mucosa surrounding carcinomas and primary lymphomas. Am J Gastroenterol 2001; 96: 1746-1750.
30. Koniaris LG, Drugas G, Katzman PJ, et al. Management of gastrointestinal lymphoma. J Am Coll Surg 2003; 197: 127-141.
Correspondencia:
Francisco Henao
Hospital Universitario de San Ignacio
Cra. 7ª No 40- 62 consultorio 725
Bogotá, D.C., Colombia
Tel.: 320 83 20 ext.: 2770
fhenao@javeriana.edu.co.
