Estado de la Terapia Inmunosupresora en el Trasplante Cardíaco, Corticosteroides
Entre los primeros agentes inmunosupresores empleados se mencionan los corticosteroides, cuyos efectos sobre el sistema linfático habían sido notados desde el siglo XIX, cuando Thomas Addison observó que en pacientes con insuficiencia adrenocortical, se comprobaba un aumento en la masa del tejido linfoide, contrario a lo que ocurría en pacientes con Síndrome de Cushing, en los que el efecto predominante era la linfopenia y la disminución de la masa de tejido linfoide. Esto ocurría como resultado de una exposición crónica a altos o bajos niveles de corticosteroides, a diferencia de lo observado en animales, en los que con períodos cortos de exposición se producían rápidas lisis del tejido linfoide (3).
En esencia, se considera que los corticosteroides tienen efectos sobre el sistema inmune a través de 4 vías:
l. Efecto antiinf1amatorio por estabilización de la membrana lisosomal, suprimiendo la síntesis de prostaglandinas.
2. Inhibiendo la transcripción del gen de la interleucina l (IL- 1), evitando de esta forma su síntesis por los macrófagos.
3. Inhibiendo la transcripción del gen de la interleucina 6 (lL-6).
4. Linfolisis (1).
Los corticosteroides en el plasma se ligan en un 90% a las proteínas, ya sea a la albúmina que tiene poca afinidad pero una gran capacidad para ligarlos, o a la globulina que tiene gran afinidad pero poca capacidad de unión. El metabolismo de los corticoides ocurre en dos fases. la primera que es la reducción de la doble unión 4, 5, puede ocurrir en el hígado o en sitios extrahepáticos, generando un metabolito inactivo. La reducción del sustituyente 3 cetona por el contrario sólo ocurre en el hígado, en donde los metabolitos se acoplan a través del 3 hidroxilo (producto de la reducción del 3 cetona) a glucoronato, formando sales hidrosolubles que se excretan. En menor proporción en el riñón puede haber algo de conjugación de los metabolitos, pero tanto estos como los conjugados en el hígado, son fundamentalmente excretados por vía urinaria.
Los efectos colaterales de los esteroides son numerosos y se relacionan con la dosis total y la duración de la administración. Son ellos, cambios de temperamento, ganancia de peso, hipertensión, intolerancia a los carbohidratos, hipercolesterolemia , úlcera péptica, osteoporosis, acné, retardo del crecimiento en niños, necrosis aséptica de la cabeza femoral, glaucoma, cataratas y miopatía.
En pacientes con trasplante cardíaco los corticoides son empleados por vía intravenosa y oral siguiendo este esquema: durante la profilaxis temprana del rechazo, se administra de 500 a 1000 mg de metilprednisolona intraoperatoria (una vez se haya descontinuado la circulación extracorpórea, siguiendo con dosis de 125 mg intravenosos cada 6 horas por 36 horas. Doce horas después de la última dosis de metilprednisolona, es decir, 48 horas después de la cirugía, se inicia la administración de prednisolona con dosis de 1 mg/kg/día, que se va disminuyendo progresivamente hasta el día séptimo en el que se administra 0.2 mg/kg/día, que será la dosis de los días subsiguientes (En algunos centros se emplea como dosis final 0.3 mg/kg/día). Una forma de hacerlo es como se indica a continuación:
Día 2: 1.0 mg/kg/día.
Día 3: 0.8 ”
Día 4: 0.6
Día 5: 0.4
Día 6: 0.3
Día 7: 0.2
Dividida la dosis en dos tomas al día.
Sin embargo, la introducción de anticuerpos monoclonales (OKT3), Y globulinas antitimocítica y antilinfocítica (ATG y ALG) a la profilaxis del rechazo, han modificado el esquema, permitiendo disminuir las dosis de prednisona a 0.25 mg/kg/día hasta que la terapia anticélulas T se complete, momento en el cual se incrementa la dosis de prednisona a I mg/kg/día, intentando bloquear la rápida expansión de los linfocitos que ocurre al descontinuar los OKT3, para luego progresivamente disminuirla a 0.2 mg/kg/día (4) (Tabla 1).
Los efectos adversos de los corticoides dependen del tiempo durante el cual se administren y de las dosis que se empleen. Para el manejo crónico de la inmunoterapia de los pacientes con trasplante cardíaco, se han propuesto esquemas de triple-droga (ciclosporina, azatioprina y corticosteroides) y de doble-droga (libre de corticosteroides). En los de triple droga, la dosis de 0.3 mg/kg/día es mantenida durante el primer mes después del trasplante y posteriormente es disminuida a 0.2, 0.1 Y 0.05 mg/kg/día a los 2, 3 Y 4 meses, respectivamente. El esquema sin esteroides fue inicialmente publicado por Yacoub en 1985 (5). Regímenes sin corticoides fueron utilizados, informándose en estos casos reducciones en las complicaciones infecciosas postoperatorias (6), así como mejoría en la calidad de vida, en el estado emocional y en la retención de líquidos (7), sin modificar la mortalidad (6). Sin embargo, este protocolo no es ideal para todos los pacientes; en general, las mujeres (8) y los pacientes más jóvenes tienden a hacer más rechazo (9). La supresión de los corticoides requiere una vigilancia más estrecha de lo convencional en los pacientes trasplantados y demanda más frecuentes biopsias endomiocárdicas y ecocardiogramas hasta que se demuestre que la terapia crónica de mantenimiento sin corticoides es adecuada para cada paciente. Se ha visto que si un paciente ha sobrevivido al sexto mes postoperatorio con un esquema con ciclosporina y azatioprina, la posibilidad de tener que usar esteroides para garantizar el mantenimiento es muy baja, (es decir no se incrementa a largo plazo la incidencia de rechazos tardíos). De otro lado, también se ha observado que más allá del primer año postoperatorio no hay diferencia significativa en la incidencia de infección entre pacientes que reciben corticosteroides y los que no, distinto de lo que ocurría en etapas tempranas (10). La sobrevida a 5 años es muy similar entre el esquema triple y el doble, por lo que si algún paciente se incluye en el doble, debe seleccionarse con cuidado entre los que tienen bajo riesgo de rechazo, para que se beneficie verdaderamente y no exponerlo a la posibilidad de rechazo (11). Recientemente se ha señalado. que a pesar de las modificaciones propuestas, la terapia de triple droga es el protocolo de mantenimiento más empleado en los programas de trasplante en Estados Unidos (94% de los centros) (12).
También se ha comenzado a estudiar la posibilidad de emplear esteroides sintéticos, como el deflazacort. que han producido disminución significativa de la glicemia, el colesterol total y el de baja densidad, comparados con la prednisona, aunque no se ha probado que disminuyan el riesgo de infección o el de rechazo (13).
Los corticoides tienen un papel preponderante en el tratamiento del rechazo al trasplante. que se divide en hiperagudo, agudo y crónico. El hiperagudo se produce por la presencia de anticuerpos preformados en el receptor contra antígenos específicos del donante. Usualmente su curso es fatal y no tiene otra alternativa que el retrasplante, a pesar de que en su tratamiento se han intentado altas dosis de corticoides, ciclofosfamida y plasmaféresis (4). El rechazo agudo es el más frecuente y aunque su principal determinante es celular, ocasionalmente se puede presentar sin infiltrados intersticiales mononucleares; en estos pacientes, estudios recientes han demostrado incremento en los niveles de anticuerpos anti HLA del donante (14). Su tratamiento varía dependiendo de los protocolos de cada institución, que los discutiremos más adelante. El rechazo crónico hace referencia a la generación de enfermedad coronaria del aloinjerto. El desarrollo de la lesión vascular ha sido explicado a través de la hipótesis de que la lesión endotelial generada por un daño inmunomediado sobre el endotelio del aloinjerto, activa las células endoteliales produciendo localmente citoquinas que estimulan las células musculares lisas para proliferar y migrar a la íntima, que junto con proliferación de fibroblastos y aumento de la matriz extracelular va generando el proceso obstructivo. La pérdida del heparán sulfato de la matriz extracelular, un inhibidor natural de la proliferación muscular lisa, podría contribuir al trastorno (15).
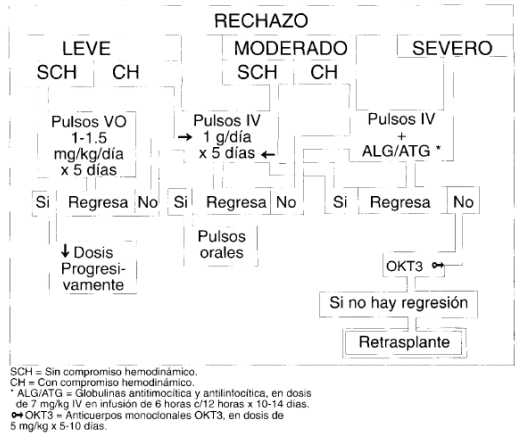
Los corticoides empleados para el rechazo van desde los pulsos orales, con prednisona 1-1.5 mg/kg/día por 5 días, para casos de rechazo leve sin compromiso hemodinámico, hasta el más común esquema de pulsos intravenosos de l/g/día de metilprednisolona administrado por 3 a 5 días, seguido por el pulso oral de esteroides, como lo describimos antes, con un período posterior de disminución progresiva de las dosis hasta el nivel previo, para los casos de rechazo leve con compromiso hemodinámico, y los rechazos moderados sin trastorno hemodinámico.
También se emplea para el rechazo moderado con inestabilidad hemodinámica o para el rechazo severo, pero adicionando las globulinas antitimocítica y antilinfocítica y el OKT3, como se ampliará adelante (Diagrama de variables No. 1).
Diagrama de Variables N° 1. Uso de corticoides en el rechazo agudo.


CLIC AQUÍ Y DÉJANOS TU COMENTARIO